Приложение N 2. Правила ведения и хранения специальных журналов учета операций, связанных с обращением лекарственных средств для медицинского применения
Правила
ведения и хранения специальных журналов учета операций, связанных с обращением лекарственных средств для медицинского применения
С изменениями и дополнениями от:
5 апреля 2018 г.
1. Настоящие Правила устанавливают требования по ведению и хранению специальных журналов учета операций, связанных с обращением лекарственных средств для медицинского применения, включенных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету*(1) (далее соответственно — журналы учета, лекарственные средства).
Информация об изменениях:
Пункт 2 изменен с 14 мая 2018 г. — Приказ Минздрава России от 5 апреля 2018 г. N 149Н
2. Настоящие Правила не распространяются на ведение и хранение специальных журналов учета операций, связанных с обращением лекарственных средств, содержащих наркотические средства, психотропные вещества и их прекурсоры и включенных в списки II, III, IV перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации*(2), а также комбинированных лекарственных препаратов, которые содержат кроме наркотических средств, психотропных веществ и их прекурсоров другие фармакологически активные вещества и в отношении которых в соответствии с пунктом 4 статьи 2 Федерального закона от 8 января 1998 г. N 3-ФЗ «О наркотических средствах и психотропных веществах»*(3) предусмотрены меры контроля, аналогичные тем, которые установлены в отношении наркотических средств, психотропных веществ и их прекурсоров, содержащихся в них..
3. Введение и хранение специальных журналов учета операций, связанных с обращением лекарственных средств, указанных в пункте 2 настоящих Правил, осуществляется в соответствии с Правилами ведения и хранения специальных журналов регистрации операций, связанных с оборотом наркотических средств и психотропных веществ, утвержденными постановлением Правительства Российской Федерации от 4 ноября 2006 г. N 644*(4), и Правилами ведения и хранения специальных журналов регистрации операций, связанных с оборотом прекурсоров наркотических средств и психотропных веществ, утвержденными постановлением Правительства Российской Федерации от 9 июня 2010 г. N 419*(5).
4. Журналы учета, заполняемые на бумажном носителе, сброшюровываются, пронумеровываются и скрепляются подписью руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя) перед началом их ведения.
Журналы учета оформляются на календарный год.
5. Листы журналов учета, заполняемых в электронной форме, ежемесячно распечатываются, нумеруются, подписываются лицом, уполномоченным на ведение и хранение журналов учета, и брошюруются по наименованиям лекарственного средства, дозировке, лекарственной форме.
По истечении календарного года сброшюрованные листы оформляются в журнал, опечатываются с указанием количества листов и заверяются подписью лица, уполномоченного на ведение и хранение журналов учета, руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя).
6. Записи в журналах учета производятся лицом, уполномоченным на ведение и хранение журнала учета, шариковой ручкой (чернилами) в конце рабочего дня на основании документов, подтверждающих совершение приходных и расходных операций с лекарственным средством.
7. Поступление лекарственного средства отражается в журнале учета по каждому приходному документу в отдельности с указанием номера и даты. Расход лекарственного средства записывается ежедневно. Аптечные организации и индивидуальные предприниматели, имеющие лицензии на фармацевтическую деятельность, записывают ежедневный расход лекарственного средства с указанием отдельно по рецептам, выписанным медицинским работникам, и по требованиям медицинских организаций.
8. Исправления в журналах учета заверяются подписью лица, уполномоченного на ведение и хранение журналов учета. Подчистки и незаверенные исправления в журналах учета не допускаются.
9. На последнее число каждого месяца лицо, уполномоченное на ведение и хранение журналов учета, проводит сверку фактического наличия лекарственных средств с их остатком по журналу учета и вносит соответствующие записи в журнал учета.
10. Журнал учета хранится в металлическом шкафу (сейфе), ключи от которого находятся у лица, уполномоченного на ведение и хранение журнала учета.
Приходные и расходные документы (их копии) подшиваются в порядке их поступления по датам и хранятся вместе с журналом учета.
11. Заполненные журналы учета хранятся в архиве юридического лица (индивидуального предпринимателя).
*(1) Статья 58.1 Федерального закона от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств» (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815, N 31, ст. 4161, N 42, ст. 5293, N 49, ст. 6409; 2011, N 50, ст. 7351; 2012, N 26, ст. 3446; N 53, ст. 7587).
*(2) Постановление Правительства Российской Федерации от 30 июня 1998 г. N 681 «Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации» (Собрание законодательства Российской Федерации, 1998, N 27, ст. 3198; 2004, N 8, ст. 663; N 47, ст. 4666; 2006, N 29, ст. 3253; 2007, N 28, ст. 3439; 2009, N 26, ст. 3183; N 52, ст. 6572; 2010, N 3, ст. 314; N 17, ст. 2100; N 24, ст. 3035; N 28, ст. 3703; N 31, ст. 4271; N 45, ст. 5864; N 50, ст. 6696, ст. 6720; 2011, N 10, ст. 1390; N 12, ст. 1635; N 29, ст. 4466, ст. 4473; N 42, ст. 5921; N 51, ст. 7534; 2012, N 10, ст. 1232; N 11, ст. 1295; N 19, ст. 2400; N 22, ст. 2864; N 37, ст. 5002; N 48, ст. 6686; N 49, ст. 6861; 2013, N 9, ст. 953; N 25, ст. 3159; N 29, ст. 3962; N 37, ст. 4706; N 46, ст. 5943; N 51, ст. 6869; 2014, N 14, ст. 1626; N 23, ст. 2987; N 27, ст. 3763; N 44, ст. 6068; N 51, ст. 7430; 2015, N 11, ст. 1593; N 16, ст. 2368; N 20, ст. 2914; N 28, ст. 4232; N 42, ст. 5805; 2016, N 15, ст. 2088; 2017, N 4, ст. 671, N 10, ст. 1481, N 23, ст. 3330; N 30, ст. 4664; N 33, ст. 5182).
*(3) Собрание законодательства Российской Федерации, 1998, N 2, ст. 219; 2002, N 30, ст. 3033; 2003, N 2, ст. 167; N 27, ст. 2700; 2004, N 49, ст. 4845; 2005, N 19, ст. 1752; 2006, N 43, ст. 4412; N 44, ст. 4535; 2007, N 30, ст. 3748; N 31, ст. 4011; 2008, N 30, ст. 3592; N 48, ст. 5515; N 52, ст. 6233; 2009, N 29, ст. 3588, 3614; 2010, N 21, ст. 2525; N 31, ст. 4192; 2011, N 1, ст. 16, ст. 29; N 15, ст. 2039; N 25; ст. 3532; N 49, ст. 7019, ст. 7061; 2012, N 10, ст. 1166; N 53, ст. 7630; 2013, N 23, ст. 2878; N 30, ст. 4057; N 48, ст. 6161, ст. 6165; 2014, N 23, ст. 2930; 2015, N 1, ст. 54; N 6, ст. 885; N 29, ст. 4388; 2016, N 1, ст. 28; N 15, ст. 2052; N 27, ст. 4160; ст. 4238.
*(4) Собрание законодательства Российской Федерации, 2006, N 46, ст. 4795; 2008, N 50, ст. 5946; 2010, N 25 ст. 3178; 2012, N 37, ст. 5002.
*(5) Собрание законодательства Российской Федерации, 2010, N 25, ст. 3178; 2011, N 51, ст. 7534; 2012, N 1, ст. 130, N 41, ст. 5623, N 51, ст. 7235.
Источник
Разъяснения по «Маркировке»
Специалисты оператора ЦРПТ комментируют вопросы аптек: ФАПы, отпуск лекарственных средств по безналу, работа в личном кабинете ИС «Маркировка», перемещение ЛП внутри аптечной сети и другие практические аспекты
Мы продолжаем серию материалов, в которых представители «Центра развития перспективных технологий» отвечают на вопросы читателей «Катрен-Стиль», посвященные работе с маркированными лекарственными препаратами. Вопросы возникают в ходе специальных бесплатных вебинаров, а также приходят на почту редакции. На этот раз руководитель проекта «Фарма» компании «ЦРПТ» Алексей Косарев и его коллеги решили ответить на самые распространенные вопросы, которые повторяются из раза в раз. Для большей ясности в начале статьи авторы объясняют, где брать информацию самостоятельно — кому из пользователей МДЛП пригодится тот или иной официальный документ.
Вступление: три категории пользователей
Всех пользователей МДЛП можно условно разделить 3 категории. Первая — это участники оборота с объемами более 10 упаковок в день. Они работают с МДЛП через ИТ-интеграторов и ККТ, которые передают данные в МДЛП автоматически. ЦРПТ сотрудничает со всеми крупными ИТ-интеграторами и поставщиками ККТ. Если ваш поставщик ПО есть на сайте «Честный знак» в разделе «Партнеры и Протестированные решения», то интеграция у вас уже есть. Если вы работаете с другим поставщиком, то уточните у него наличие в системе модуля для работы с маркированным товаром. Если у вас «самописная» система, ее надо доработать в соответствии с документами, которые предназначены для ИТ-специалистов (см. ниже). Рекомендуем получить все разъяснения у провайдеров услуг и пройти обучение по работе с новым функционалом в том интерфейсе, в котором вы осуществляете свою ежедневную деятельность.
Вторая категория — это участники оборота с объемами менее 10 упаковок в день. Они могут (но не должны) работать с ИС «Маркировка», внося данные о лекарственных средствах «вручную» через личный кабинет.
Третья категория пользователей — это ИТ-специалисты, которые взаимодействуют с МДЛП на уровне программы.
Для этих трех категорий пользователей подготовлены схемы и инструкции разного уровня погружения в технические детали. Просим обращать внимание на это при изучении ответов на вопросы. Для 1‑й категории основной документ — «Паспорта процессов». Для 3‑й категории (и 2‑й по желанию) основной документ — это «Логическая модель файлов обмена функциональной подсистемы информационной системы маркировки товаров контрольными (идентификационными) знаками лекарственных препаратов для медицинского применения».
Ответы на вопросы
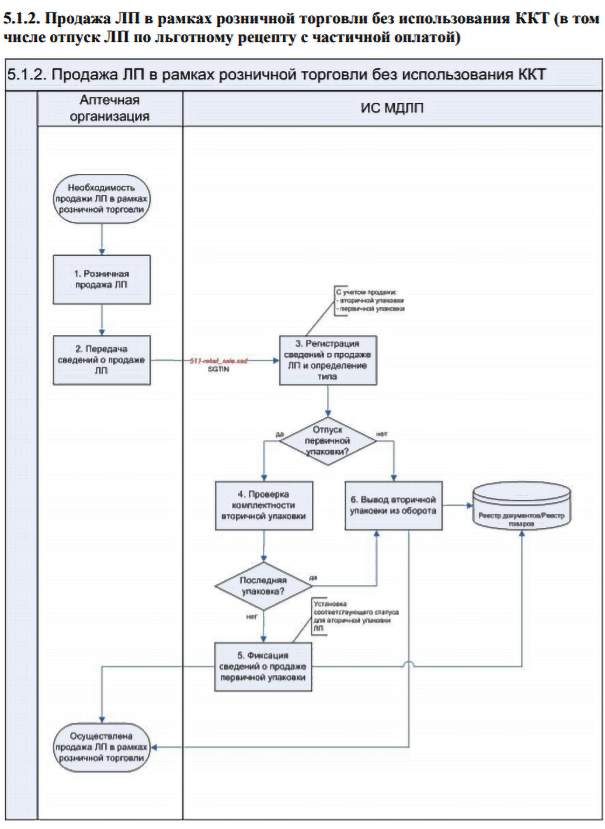
Как будет проходить процесс маркировки товаров в аптечных учреждениях отдаленных населенных пунктов, где работают онлайн-кассы без передачи данных?
Сведения о розничной продаже маркированных лекарств должны передаваться вручную через личный кабинет или через головную организацию при наличии таковой (в таком случае процесс не меняется).
При наличии у учреждения вышестоящей (головной) организации, сведения о выбытии передает указанная организация. Действия происходят по схеме:
Детальное описание последовательности действий описано в документе «Паспорта процессов» в разделе 5.1.2.
Подскажите, мы планируем осуществлять деятельность в рамках договора комиссии с ФАП, расположенными в сельской местности. Каким образом нам организовать деятельность по маркировке ЛП?
При отпуске лекарственных препаратов через ФАП, сведения о выбытии передаются вышестоящей организацией.
Отпуск препаратов на медпункты, детские сады и детские лагеря при оплате по безналичному расчёту (без ККМ). Как работать с маркированными ЛС?
Если участник оборота, которому осуществляется отпуск ЛП, имеет лицензию на медицинскую деятельность, то он должен быть зарегистрирован в МДЛП. Если не зарегистрирован, тогда выполняется операция отгрузки ЛП под названием «Регистрация в ИС «Маркировка» сведений об отгрузке лекарственных препаратов на незарегистрированное место деятельности».
Как отражать в МДЛП безналичный расчет между организациями, как аптека регистрирует выбытие ЛП, купленных по безналичному расчету другой организацией?
В данном случае осуществляются операции об отгрузке лекарственных препаратов со склада отправителя/приема лекарственных препаратов на склад. Детальное описание последовательности действий описано в документе «Паспорта процессов» в разделах 4.1 и 4.2 соответственно.
Подскажите, какие действия нужно совершать поставщику. Мы небольшая компания, зарегистрированы в «Честном знаке». Дальше непонятно — что нам нужно делать, когда мы получаем товар от производителя и когда мы производим отгрузку в ЛПУ. Где можно найти подробную инструкцию по работе дистрибьютора?
Каждая операция (приемка, перемещение, выбытие лекарственных препаратов) должна фиксироваться в МДЛП. Для каждой из этих операций определен состав передаваемых данных и последовательность действий. Имеется два руководящих документа. Последовательность действий описана в документе «Паспорта процессов».
Первично осуществляется приемка товара от производителя. Для этого необходимо использовать операцию «Регистрация в ИС «Маркировка» подтверждения (акцептования) сведений».
Далее при реализации товара другому участнику оборота (ЛПУ), выполняются следующие операции:
- В случае прямого акцептования — «Регистрация в «ИС «Маркировка» сведений об отгрузке лекарственных препаратов со склада отправителя»
- В случае обратного акцептования — «Регистрация в ИС «Маркировка» подтверждения (акцептования) сведений».
Допустимо ли будет с 01.01.2020 для аптечной сети отражать в ИС МДЛП перемещение отозванной из обращения (забракованной) серии лекарственного препарата между местами осуществления деятельности (из аптеки на аптечный склад) при осуществлении централизованного возврата поставщику с аптечного склада?
Допустимо, если в дальнейшем с отозванной из обращения серией будут выполнены следующие операции:
- Регистрация в ИС «Маркировка» сведений о передаче лекарственных препаратов на уничтожение.
- Регистрация в ИС «Маркировка» сведений о факте уничтожения лекарственных препаратов.
Как будет производиться отпуск лекарственных препаратов в структурные подразделения юридического лица? Как будет осуществляться отпуск в структурных подразделениях, если в них нет программы товарного учета, а только ККТ? Как осуществлять отпуск по договорам, школам и т. д.?
Для выполнения операции перемещения лекарственных средств между местами деятельности в рамках одного ИНН необходимо выполнить операцию — «Регистрация в ИС «Маркировка» сведений о перемещении лекарственных препаратов между различными адресами осуществления деятельности».
При использовании ККТ в аптеке данные о выбытии ЛП будут передаваться в МДЛП в момент осуществления покупки. Данные передаются оператором фискальных данных автоматически, в рамках стандартного пакета.
Учреждения, обладающие лицензией на медицинскую или фармацевтическую деятельность, должны быть зарегистрированы в ИС МДЛП. Реализация ЛП происходит по операциям:
- В случае прямого акцептования — «Регистрация в «ИС «Маркировка» сведений об отгрузке лекарственных препаратов со склада отправителя».
- В случае обратного акцептования — «Регистрация в ИС «Маркировка» подтверждения (акцептования) сведений».
Если препарат в стационаре забракован после списания в отделение регистратором выбытия — как его вернуть поставщику?
Необходимо выполнить операцию повторного ввода ЛП в оборот, а затем осуществить возврат поставщику. Далее выполнить операции:
«Регистрация в ИС «Маркировка» сведений о передаче лекарственных препаратов на уничтожение» и «Регистрация в ИС «Маркировка» сведений о факте уничтожения лекарственных препаратов».
Что будет с остатками в МДЛП, если аптека не смогла принять КиЗы от поставщика при обратном акцептовании (КиЗы, например, на производителе), а продавать уже начала?
В МДЛП рассматривается возможность реализации реестра ожиданий, позволяющего выводить ЛП до момента акцептования. После того как ЛП будет оприходован, он будет выведен из оборота.
Как можно будет осуществлять перемещение товара из одной аптеки в другую в одной сети аптек?
Движение ЛП между местами деятельности в рамках одного ИНН регистрируется операцией — «Регистрация в ИС «Маркировка» сведений о перемещении лекарственных препаратов между различными адресами осуществления деятельности». Данные передаются автоматически через товарно-учетную систему, интегрированную с МДЛП, или вручную посредством функционала личного кабинета МДЛП (последнее целесообразно, если оборот — не более 10 уп./сутки).
Как осуществлять возврат ЛС от структурных подразделений?
Возврат регистрируется операцией — «Регистрация в ИС «Маркировка» сведений о перемещении лекарственных препаратов между различными адресами осуществления деятельности». Данные передаются автоматически.
Если у вас еще остались вопросы по работе с маркированными ЛС, приглашаем вас 11 декабря посетить очередной бесплатный вебинар на тему «АРМ в аптеке: знакомимся с техническими средствами маркировки». Там вы сможете не только услышать официальные рекомендации, но и задать свои вопросы в режиме онлайн. Спешите регистрироваться, количество мест ограниченно.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Источник