Мониторинг движения лекарственных препаратов (маркировка лекарств)
Правительством Российской Федерации в числе основных направлений определена работа по модернизации процесса движения лекарственных препаратов в соответствии с лучшими международными практиками, в том числе по унификации и упрощению процедур вывода лекарств на рынок без ущерба качеству, проведению мониторинга ассортиментной политики и цен на лекарственные препараты, совершенствованию методики регистрации предельных отпускных цен производителей на жизненно необходимые лекарственные препараты, мониторингу движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя с использованием средств идентификации.
25 октября 2016 г. президиумом Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов». Краткое наименование — «Лекарства. Качество и безопасность».
Ключевые участники приоритетного проекта:
- Минздрав России;
- Росздравнадзор;
- ФНС России;
- Минпромторг России;
- Минфин России;
- Минкомсвязи России.
Субъекты обращения лекарственных препаратов:
- российские производители;
- российские и иностранные держатели регистрационных удостоверений и их представительства;
- организации оптовой и розничной торговли лекарствами;
- медицинские организации.
Цель приоритетного проекта:
- Защита населения от фальсифицированных, недоброкачественных и контрафактных лекарственных препаратов и предоставление неограниченному кругу потребителей (граждан) возможности проверки легальности зарегистрированных лекарственных препаратов, находящихся в гражданском обороте. Обеспечение прозрачности и развития справедливой конкуренции на фармацевтическом рынке.
Основными ресурсами, освещающими реализацию проекта МДЛП, являются официальные сайты Минздрава России, Росздравнадзора, Национальной системы цифровой маркировки «Честный знак». Информации в соответствующих разделах много, но в сегменте вопросов, касающихся медицинских организаций, она крайне дозированная и отвечает далеко не на все вопросы. При этом важно разобраться, что находится в силах и компетенции самой медицинской организации, и к чему придется тщательно готовиться, особенно к тем аспектам процесса лекарственного обеспечения, на которые система МДЛП влияет опосредованно, без регуляторного или технического воздействия.
Система мониторинга движения лекарственных препаратов будет внедряться с 01.07.2020 одномоментно по всей стране, вовлекая огромное число субъектов обращения лекарственных препаратов. По официальным оценкам в системе будут зарегистрированы около тысячи производителей и держателей регистрационных удостоверений на лекарственные препараты, порядка 2,5 тысяч оптовых фармацевтических организаций и 350 тысяч медицинских и аптечных организаций, не говоря о том, что эта система коснется всех без исключения конечных потребителей — пациентов, а это, без преувеличения, всё население Российской Федерации.
Эксперимент по внедрению системы маркировки лекарств в соответствии с Постановлением Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (вместе с «Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения») стартовал в начале 2017 года и закончится непосредственно перед переходом к промышленной эксплуатации в конце 2019 года. Промежуточные результаты и опыт добровольных участников эксперимента уже сегодня объективно показывают, что задачи, стоящие перед субъектами оборота лекарственных препаратов, далеко не простые и требуют серьезной подготовки, как организационной, так и финансовой.
При подготовке к внедрению системы МДЛП руководству медицинской организации необходимо самым тщательным образом подойти к оценке готовности и достаточности всех видов её ресурсов.
Человеческий ресурс
Трудоёмкость приемки товара при внедрении системы маркировки неизбежно возрастает, особенно, если мест приемки и выбытия лекарств из гражданского оборота в организации несколько. Частично решить этот вопрос можно при применении автоматизированных средств оптимизации считывания кодов с упаковок, но на рынке пока нет доступных решений, которые бы подходили для данных целей.
Места хранения
С 29.11.2019 ст. 67 Федерального закона от 12.04.2010 № «Об обращении лекарственных средств» дополняется ч. 7.1 в следующей редакции «Лекарственные препараты для медицинского применения, введенные в гражданский оборот до 1 января 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности.». Это значит, что с 1 января 2020 года поток медикаментов разделится на маркированный подтвержденный, маркированный неподтвержденный и немаркированный, что потребует увеличения площадей и мест хранения препаратов, так как совместное хранение этих групп товаров может привести к нарушению требований системы мониторинга движения.
С учетом вышеописанных возможных проблем с увеличением длительности проведения закупочных процедур необходимо пересмотреть в сторону увеличения нормативы складских запасов лекарств, которые смогут обеспечить непрерывность лечебно-диагностического процесса в случае непредвиденных обстоятельств.
Финансовый ресурс
Вышеуказанный прирост численности работников требует увеличения фонда оплаты труда. Потребуются затраты на организацию новых рабочих мест, оснащенным специальным оборудованием, оптимизацию систем хранения, увеличение объемов складских запасов, а также на закупку или развитие информационных систем. Это существенные затраты для любой организации, их надо планировать и своевременно изыскивать.
Время
Временные затраты на администрирование всех этапов движения лекарственных препаратов также вырастут, этот фактор крайне важно заложить в систему управления производственными процессами.
Одним из важнейших аспектов внедрения системы МДЛП для медицинского учреждения является необходимость перенастройки порядка взаимодействия с поставщиками лекарственных препаратов. В соответствии с п. 44 Положения о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденного Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (далее — Положение) при передаче лекарственных препаратов между субъектами обращения внесение информации в ФГИС МДЛП может происходить двумя способами:
При этом решение о выборе типа порядка предоставления сведений принимается субъектами обращения лекарственных препаратов, предоставляющими данные сведения, самостоятельно. Это решение необходимо закрепить в контракте на поставку лекарственных препаратов.
Прямой порядок
В случае выбора прямого порядка предоставления сведений субъект обращения, осуществляющий передачу лекарственных препаратов другому субъекту обращения в рамках гражданско-правовых отношений (поставщик), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты отгрузки лекарственных препаратов предоставляет об этом в ФГИС МДЛП сведения, предусмотренные пунктом 2 приложения № 6 к Положению.
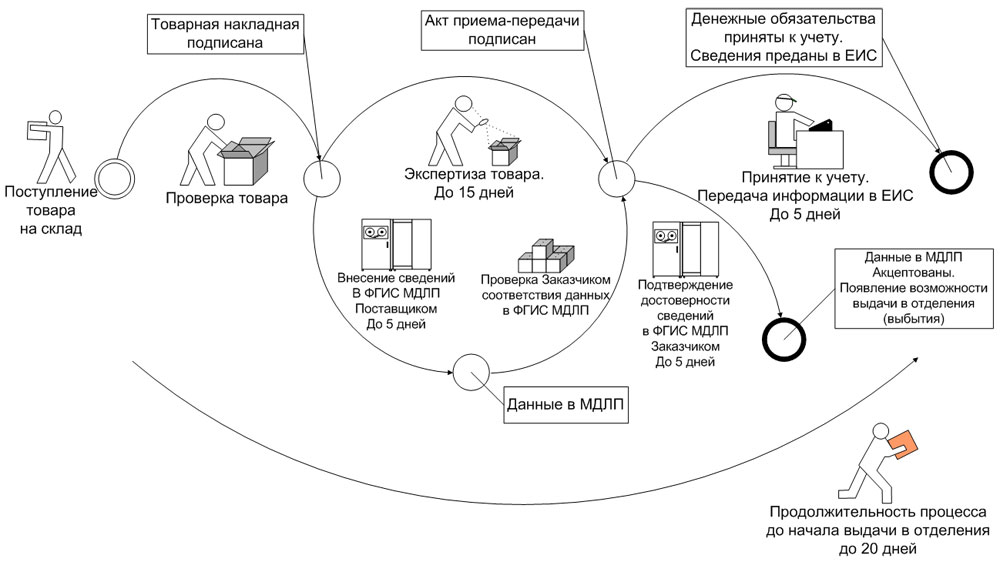
При этом субъект обращения, осуществляющий приемку лекарственных препаратов от другого субъекта обращения ЛП в рамках гражданско-правовых отношений (заказчик, медицинская организация), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки лекарственных препаратов и регистрации в ФГИС МДЛП сведений об отгруженных медикаментах, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о принимаемых лекарственных препаратах, предоставляя об этом сведения в ФГИС МДЛП, предусмотренных пунктом 4 приложения № 6 к Положению (рис. 1).
Рис. 1. Прямой способ внесения информации в ФГИС МДЛП
Обратный порядок
В случае выбора обратного порядка предоставления сведений субъект обращения, осуществляющий приемку медикамента от другого субъекта обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на ЛП, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки ЛП предоставляет в ФГИС МДЛП сведения о принятых ЛП, предусмотренные пунктом 3 приложения № 6 к Положению.
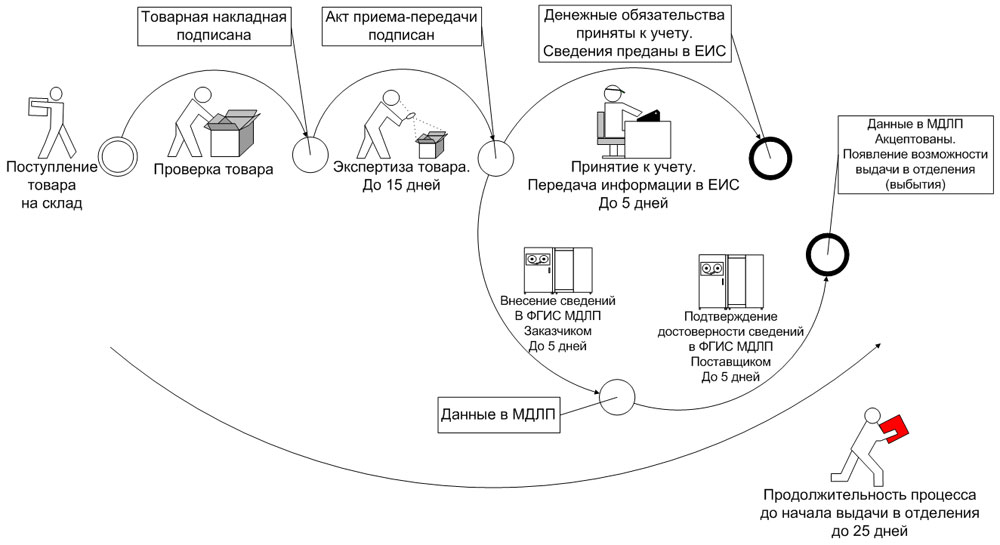
При этом субъект обращения, осуществивший передачу лекарства другому субъекту обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты регистрации в ФГИС МДЛП сведений о принятом товаре, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о переданных лекарственных препаратов, предоставляя об этом сведения в ФГИС МДЛП, предусмотренные пунктом 4 приложения № 6 к Положению (рис. 2).
Рис. 2. Обратный способ внесения информации в ФГИС МДЛП
В ходе подготовки к работе в новых условиях системы МДЛП важно учесть особенности медицинской организации в части её системы финансирования, организационной структуры, наличию удаленных (обособленных) подразделений, организации закупок лекарственных препаратов, в том числе участие в централизованных поставках и иные аспекты деятельности, обусловливающие многочисленные внутренние и внешние взаимосвязи, необходимые для бесперебойной работы системы лекарственного снабжения, и проводить внедрение новой системы в контексте данных качественного анализа деятельности организации.
* На заседании рабочей группы Росздравнадзора было принято решение о внесении изменений в Положение, предусматривающих сокращение сроков регистрации операций в ИС МДЛП по передаче лекарственных препаратов всеми участниками до 1 рабочего дня, в целях соблюдения приоритета интересов пациента и предоставления медицинской организации возможности выполнения требований законодательства в сфере охраны здоровья, обращения лекарственных препаратов и закупок (контрактной системы) без нарушений.
Источник
Журнал мониторинг лекарственных средств
1. Утвердить Положение о правилах осуществления мониторинга безопасности лекарственных препаратов и медицинских изделий в областных государственных медицинских организациях (далее – Положение) согласно приложению № 1.
2. Утвердить форму Журнала учета выявленных неблагоприятных побочных реакций при применении лекарственных средств и медицинских изделий согласно приложению № 2.
3. Утвердить Правила ведения журнала учета выявленных неблагоприятных побочных реакций при применении лекарственных средств и медицинских изделий согласно приложению № 3.
4. Руководителям областных государственных медицинских организаций обеспечить, руководителям Федерального государственного бюджетного учреждения науки «Кировский научно-исследовательский институт гематологии и переливания крови» Федерального медико-биологического агентства, Федерального государственного бюджетного учреждения здравоохранения «Медико-санитарная часть № 52» Федерального медико-биологического агентства, Федерального государственного бюджетного учреждения здравоохранения «Медико-санитарная часть № 43» УФСИН России, Негосударственного учреждения здравоохранения «Отделенческая клиническая больница на станции Киров» ОАО РЖД рекомендовать:
4.1. Назначить приказом по учреждению лицо, ответственное за сбор информации и представление отчетности о неблагоприятных побочных реакциях на лекарственные препараты и медицинские изделия (далее – ответственное лицо).
4.2. Представить в министерство здравоохранения Кировской области (адрес электронной почты: Svetlana.patrusheva@medkirov.ru) информацию об ответственном лице с указанием фамилии, имени, отчества, должности, номера контактного телефона (в случае не предоставления ранее).
4.3. Организовать работу в соответствии с Положением.
4.4. Организовать предоставление информации о побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов (далее – нежелательная реакция), а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов (далее – иной информации по безопасности и эффективности), выявленных на всех этапах в Росздравнадзор через Автоматизированную информационную систему Росздравнадзора (далее – АИС Росздравнадзора), либо по электронной почте pharm@roszdravnadzor.ru.
Возможно предоставление информации путем направления извещения о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата по установленной форме в территориальный орган Росздравнадзора по Кировской области по адресу электронной почты: info@reg43.roszdravnadzor.ru,
4.5. Организовать предоставление сведений обо всех случаях выявленных побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий.
Информация направляется в Федеральную службу по надзору в сфере здравоохранения посредством внесения сведений на информационный ресурс АИС Росздравнадзора.
Порядок регистрации описан в информационном письме Росздравнадзора от 15.05.2012 № 04И-749/12, размещенном на официальном сайте Росздравнадзора по адресу: http/roszdravnadzor.ru Возможно предоставление информации путем направления извещения по установленной форме в территориальный орган Росздравнадзора по Кировской области путем направления на адрес электронной почты: info@reg43.roszdravnadzor.ru,
4.6. Ознакомить с настоящим распоряжением медицинских работников с высшим и средним медицинским образованием, предупредить об ответственности в соответствии с законодательством Российской Федерации за несообщение или сокрытие информации о выявленных фактах неблагоприятных побочных реакций на лекарственные препараты и медицинские изделия.
4.7. Обязать лечащих врачей, заведующих отделениями медицинской организации в оперативном режиме сообщать ответственному лицу о выявленных фактах неблагоприятных побочных реакций на лекарственные препараты и медицинские изделия.
4.8. Обеспечить представление врачебными комиссиями областных государственных медицинских организаций сведений о выписке лекарственных препаратов по торговому наименованию в рамках программ льготного лекарственного обеспечения в случаях индивидуальной непереносимости лекарственных средств в Росздравнадзор, либо в территориальный орган Росздравнадзора по Кировской области в срок, не превышающий пяти рабочих дней с даты выписки соответствующего лекарственного препарата по торговому наименованию.
4.9. При подаче дополнительных заявок в министерство здравоохранения Кировской области на обеспечение пациента в рамках Федерального закона от 17.07.1999 № 178-ФЗ «О государственной социальной помощи» и постановления Правительства Российской Федерации от 30.07.1994 № 890 «О государственной поддержке развития медицинской промышленности и улучшении обеспечения населения и учреждений здравоохранения лекарственными средствами и изделиями медицинского назначения» лекарственным препаратом под торговым наименованием при индивидуальной непереносимости или иным причинам в соответствии с распоряжением министерства здравоохранения Кировской области от 18.02.2015 № 102 «Об утверждении правил направления дополнительных заявок на лекарственные препараты» прикладывать копию Извещения о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата, подписанную руководителем областной государственной медицинской организации.
4.10. Обеспечить предоставление копий сообщений, направленных в Росздравнадзор и территориальный орган Росздравнадзора по Кировской области, в отдел лекарственного обеспечения министерства здравоохранения Кировской области на адрес электронной почты: Svetlana.patrusheva@medkirov.ru.
5. Начальнику отдела лекарственного обеспечения министерства здравоохранения Кировской области организовать сбор сведений о неблагоприятных побочных реакциях на лекарственные препараты и медицинские изделия.
6. Главному специалисту клиническому фармакологу министерства здравоохранения Кировской области осуществлять оказание консультативной помощи лицам, ответственным за фармаконадзор в медицинских организациях в пределах компетенции.
7. Приостановить деятельность Регионального центра мониторинга безопасности лекарственных препаратов и медицинских изделий при Кировском областном государственном бюджетном учреждении здравоохранения «Кировская областная клиническая больница» до особого распоряжения.
8. Признать утратившими силу распоряжения министерства здравоохранения Кировской области от 28.03.2016 № 430 «Об организации мониторинга безопасности лекарственных препаратов и медицинских изделий в государственных медицинских организациях Кировской области.
Контроль за исполнением настоящего распоряжения возложить на заместителя министра здравоохранения Кировской области, курирующего вопросы лекарственного обеспечения.
Министр А.В. Черняев
Возможно он-лайн заполнение Карты-извещения в Росздравнадзор на сайте npr.roszdravnadzor.ru с помощью персонализированного доступа в информационный ресурс «Фармаконадзор» АИС Росздравнадзора. Порядок регистрации для входа в АИС Росздравнадзора размещен на информационном официальном сайте Федеральной службы по надзору в сфере здравоохранения в сети «Интернет» по адресу: www.roszdravnadzor.ru, раздел «Лекарственные средства», подраздел «Мониторинг безопасности лекарственных средств, находящихся в обращении на территории Российской Федерации», рубрика «Автоматизированная система «Фармаконадзор».
Настоящее Положение о правилах осуществления мониторинга безопасности лекарственных препаратов и безопасности медицинских изделий в областных государственных медицинских организациях (далее – Положение) утверждено в целях безопасного применения, использования лекарственных препаратов и медицинских изделий, своевременности сообщения, предупреждения о побочных действиях лекарственных средств, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов (далее – нежелательная реакция), а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов и разработано в соответствии с Федеральным законом от 12.04.2012 № 61-ФЗ «Об обращении лекарственных средств», статьей 96 Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», приказом Министерства здравоохранения Российской Федерации от 14.09.2012 № 175н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий», приказом Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора», приказом Министерства здравоохранения Российской Федерации от 20.06.2012 № 12н «Об утверждении Порядка сообщения субъектами обращения медицинских изделий обо всех случаях выявления побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий», письмом Федеральной службы в сфере здравоохранения от 28.12.2012 № 04И-1308/12 «О порядке проведения мониторинга безопасности медицинских изделий для организаций здравоохранения».
2. Терминология, применяемая в данном положении.
Побочное действие – реакция организма, возникшая в связи с применением лекарственного препарата в дозах, рекомендуемых в инструкции по его применению, для профилактики, диагностики, лечения заболевания или для реабилитации;
Нежелательная реакция – непреднамеренная неблагоприятная реакция организма, которая может быть связана с применением лекарственного препарата (далее – НПР);
Серьезная нежелательная реакция – нежелательная реакция организма, связанная с применением лекарственного препарата, приведшая к смерти, врожденным аномалиям или порокам развития либо представляющая собой угрозу жизни, требующая госпитализации или приведшая к стойкой утрате трудоспособности и (или) инвалидности;
Непредвиденная нежелательная реакция – нежелательная реакция организма, которая связана с применением лекарственного препарата в дозах, рекомендуемых в протоколе его клинического исследования, брошюре исследования, или с применением лекарственного препарата в дозах, рекомендуемых в инструкции по его применению для профилактики, диагностики, лечения заболевания или медицинской реабилитации пациента, и сущность, тяжесть или исход которой не соответствует информации о лекарственном препарате, содержащейся в протоколе его клинического исследования, брошюре исследователя или в инструкции по применению лекарственного препарата.
3. Осуществление работы в областных государственных медицинских организациях.
3.1. Руководителем медицинской организации назначается ответственный за сбор, обработку и предоставление информации о выявляемых НПР (ответственный по фамраконадзору), преимущественно из числа лиц, имеющих подготовку по специальности «клиническая фармакология».
При отсутствии в медицинской организации указанного специалиста ответственным лицом может быть назначен заместитель руководителя медицинской организации по медицинской части или по организации медицинской помощи населению.
3.2. В задачи ответственного по фармаконадзору должностного лица медицинской организации входят:
- информирование врачей о порядке сбора и передачи информации о НПР в соответствии с существующими нормативными актами;
- доведение до медицинских и фармацевтических работников информации о порядке заполнения Извещения о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата в соответствии с приложением № 1 к Порядку осуществления фармаконадзора, утвержденному приказом Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора»;
- в случае наличия у областной государственной медицинской организации соответствующего разрешения на проведение клинических исследований – о порядке заполнения Сообщения о серьезной непредвиденной нежелательной реакции на лекарственный препарат, изучающийся в клиническом исследовании в срок не более 15 календарных дней;
- сбор Извещений о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата в подразделениях медицинской организации и Сообщений о серьезной непредвиденной нежелательной реакции на лекарственный препарат, изучающийся в клиническом исследовании. Копии вышеуказанных документов остаются у ответственного лица и сохраняются в медицинской документации пациентов;
- верификация данных о выявленных НПР в медицинской организации;
- предоставление информации в Росздравнадзор:
о серьезных нежелательных реакциях с летальным исходом или угрозой жизни, за исключением нежелательных реакций, выявленных в ходе проведения клинических исследований, проводимых в данной медицинской организации – в срок не более 3 рабочих дней,
3.3. Передача информации о НПР в Росздравнадзор.
Медицинские организации срок, не превышающий 15 календарных дней, сообщают в Росздравнадзор и территориальный орган Росздравнадзора по Кировской области о следующих нежелательных реакциях и иной информации по безопасности и эффективности, выявленной данной медицинской организацией, за исключением нежелательных реакций, выявленных в ходе проведения клинических исследований:
- серьезных нежелательных реакциях на лекарственные препараты,
- за исключением серьезных нежелательных реакций, выявленных в ходе проведения клинических исследований, проводимых в данной медицинской организации;
- случаях передачи инфекционного заболевания через лекарственный препарат;
- случаях отсутствия заявленной эффективности лекарственных препаратов, применяемых при заболеваниях, представляющих угрозу
- для жизни человека, вакцин для профилактики инфекционных заболеваний, лекарственных препаратов для предотвращения беременности, когда отсутствие клинического эффекта не вызвано индивидуальными особенностями пациента и (или) спецификой его заболевания;
- нежелательных реакциях, возникших вследствие злоупотребления препаратом, в случаях умышленной передозировки лекарственного препарата, при воздействии, связанном с профессиональной деятельностью, или в случаях использования лекарственного препарата в целях умышленного причинения вреда жизни и здоровью человека.
3.4. Критерии минимального объема информации о нежелательной реакции, от даты получения которой отсчитываются сроки представления данных о ней в Росздравнадзор.
Срок исчисляется с даты, когда ответственному по фармаконадзору должностному лицу медицинской организации стали известны следующие сведения о НПР:
- информация, позволяющая идентифицировать юридическое или физическое лицо, выявившее нежелательную реакцию или особую ситуацию;
- информация, позволяющая идентифицировать физическое лицо, у которого наблюдалась нежелательная реакция;
- информация, позволяющая идентифицировать лекарственный препарат и симптомы нежелательной реакции.
3.5. Врачебным комиссиям медицинских организаций направлять в Росздравнадзор и Территориальный орган Росздравнадзора по Кировской области информацию о случаях индивидуальной непереносимости лекарственных средств, явившихся основанием для выписки лекарственных препаратов по торговому наименованию в рамках программ льготного лекарственного обеспечения, в срок не превышающий 5 рабочих дней с даты выписки лекарственного препарата в порядке, установленном приказом Минздрава России от 05.05.2012 № 502н «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации».
3.6. Рекомендуемый порядок действий медицинских работников при выявлении НПР на лекарственные препараты или медицинские изделия:
- информация о НПР доводится незамедлительно до ответственного лица либо до заведующего отделением, где находится (наблюдается) пациент с выявленной НПР;
- заполняется карта-извещение. Заполненная карта-извещение передается ответственному лицу или заведующему отделением. Для обеспечения доступности извещений бланки карты-извещения должны быть в достаточном количестве в доступных медицинским работникам местах. Возможно заполнение карты-извещения в электронной форме;
- информация о НПР вносится в Журнал учета выявленных неблагоприятных побочных реакций при применении лекарственных средств и медицинских изделий.
- ответственное лицо передает информацию в Росздравнадзор и либо территориальный орган Росздравнадзора в установленной форме.
3.6. Ответственность за работу по мониторингу безопасности ЛП и МИ в медицинской организации несет руководитель медицинской организации.
Источник