Особенности разработки и выведения нового препарата на рынок
Для современного специалиста-провизора очень важны знания особенностей разработки и внедрения новых лекарственных препаратов на фармацевтический рынок. Описанные в специальной маркетинговой литературе рекомендации по продвижению различных товаров и услуг не всегда могут быть использованы на фармацевтическом рынке, где существуют свои специфические особенности, законодательные ограничения в области маркетинга и продвижения лекарственных средств, и где особую значимость имеют социальная и этическая стороны, которые могут не учитываться в других сферах бизнеса.
Но вывод нового препарата на рынок – это очень длительный, трудоемкий и финансовозатратный процесс. Разработку оригинального препарата могут позволить себе только очень крупные фармацевтические компании. Именно те фармацевтические компании-производители, которые уделяют повышенное внимание вопросам научных исследований, разработки новых препаратов, определяют и во многом формируют стратегию развития фармацевтического рынка и, в конечном итоге, получают максимальную прибыль.
В последние годы наиболее активно созданием и выводом на фармацевтический рынок новых лекарственных препаратов занимаются такие компании, как GlaxoSmithKline, Pfizer, Hoffmann-LaRoche, Merck&Co, Sanofi-Aventis, AstraZeneca, Novartis, EliLilly, Schering-Plough, Bristol-MyersSquibb и многие другие.
По данным статистических обзоров, около 70% проводимых сейчас в фармации перспективных научных исследований направлены на разработку (синтез) новой молекулы. Примерно 24% всех проводимых исследований – на разработку новой лекарственной формы, совершенствование дозировки и т.д. Около 6% научных исследований – изучение новых показаний уже существующих лекарственных препаратов (ЛП).
Анализ терапевтических направлений исследований новых лекарственных средств показал, что большинство из них (31%) посвящено исследованиям в области онкологии, 14% исследований направлены на создание новых лекарственных средств для лечения различных инфекционных болезней, около 13% исследований – это научные разработки в области лечения сердечно-сосудистых заболеваний. Так же актуальными являются научные исследования по созданию новых противодиабетических, противовоспалительных препаратов, препаратов для лечения различных психических заболеваний и т.д.
Около 67% всех новых активных веществ – это химические соединения, 11% — биологические (полусинтетические), 22% — генноинженерные.
За последние пять лет в России было зарегистрировано более 5000 новых ЛП. Однако, по оценке многих руководителей отделов маркетинга фармацевтических компаний, только треть выводимых на рынок препаратов можно назвать успешными с точки зрения получения финансовой прибыли компанией-производителем.
Причину такого низкого процента возврата инвестиций во многом можно объяснить в отсутствии целостной стратегии вывода нового ЛП на рынок.
Для того, чтобы оценить коммерческую привлекательность вывода на рынок нового лекарственного препарата, еще до начала его производства и реализации определить рентабельность нового проекта и обоснованно принять решение о продолжении или прекращении вывода новинки на рынок, необходимо обязательно провести целый ряд маркетинговых исследований, обязательных по существующему законодательству процедур, плановых мероприятий, моделирующих процесс продвижения товара на рынке с учетом всех его особенностей и закономерностей.
Описанные в специальной маркетинговой литературе рекомендации по продвижению товаров и услуг не всегда могут быть использованы на фармацевтическом рынке, где существуют свои особенности и закономерности в области маркетинга и продвижения и особую значимость приобретает социальная и этическая сторона, которая может не учитываться в других сферах бизнеса.
Любое маркетинговое исследование необходимо начать с изучения факторов внешней и внутренней среды коррелирующих с выводимым на рынок лекарственным препаратом. При изучении факторов внутренней среды следует оценить возможности и ресурсы самой компании-производителя для разработки и продвижения нового препарата (прежде всего финансовые, материальные, человеческие).
При изучении факторов внешней среды следует проанализировать:
— В каком состоянии находится фармацевтический рынок, нет ли причин, препятствующих выводу на него нового лекарственного препарата?
— Насколько распространено заболевание или группа заболеваний, при которых применяется выводимый на рынок новый препарат, и необходимо ли появление на рынке еще одного препарата для лечения заболеваний данной группы?
Только после оценки всех возможностей компании, сильных и слабых сторон, перспектив угроз и рисков (SWOT-анализ) целесообразно приступать к разработке нового препарата
Исследования и разработка (R&D – Research and Development) новых лекарственных препаратов – длительный и дорогостоящий процесс, включающий в себя ряд обязательный стадий. Все начинается с поиска молекулы, формулировки гипотез и разработки программы исследований для определения терапевтического потенциала нового лекарственного средства.
Поиск потенциального препарата может длиться от 2 до 10 лет. По статистике, только 1,5 -2,5% исследованных молекул переходят на следующие этапы разработки.
Дальнейший процесс R&D найденного вещества может длиться до 10 лет, а иногда и до 15 лет. Это, прежде всего, доклинические исследования (preclinicaldevelopment) – исследования на животных – проводятся с целью оценки безопасности и биологической активности, изучения механизма действия, фармакокинетики, токсичности, мутагенности и онкогенности исследуемого вещества. Длительность этапа составляет, в среднем, 2 года.
Клинические испытания (clinical development) состоят из 3 фаз:
— I фаза клинических испытанийпроводится с целью получения данных по фармакодинамике и фармакокинетике активного соединения и определения безопасной дозировки.
— II фаза клинических испытаний (пилотные терапевтические исследования) – проводится с целью оценки эффективности, определения побочных эффектов, оценки соотношения доза/эффект.
— III фаза клинических испытаний (официальные клинические испытания) – проводится с целью подтверждения эффективности, мониторинга побочных реакций при долговременном применении. Длительность этой стадии обычно составляет 3–4 года.
Еще одна очень важная ступень разработки нового лекарственного препарата – это выбор торгового наименования, названия препарата. Название препарата должно быть благозвучным, запоминающимся, оно не должно ассоциироваться с чем-то неприятным, а наоборот, вызывать положительные эмоции и ассоциации.
Запатентованная торговая марка является собственность производителя и играет немаловажную роль в его последующей удачной или неудачной реализации.
Следует уделить особое внимание разработке упаковочных и рекламных материалов для нового препарата. Упаковка препарата должна обеспечивать не только сохранность качества препарата, удобство его хранения и транспортировки, но и привлекать потенциальных покупателей. Внешний вид, цветовое оформление, дизайн упаковки относятся к так называемым «мягким» характеристикам спроса, имеющим, по мнению маркетологов, во многом решающее значения для покупателя при выборе любого товара, в том числе и лекарственного препарата. Именно на этом этапе создания нового ЛП возможно изменение и адаптация некоторых характеристик лекарственного препарата (форма выпуска, вкус, упаковка, маркировка) в соответствии с требованиями целевой группы потребителей и существующего законодательства.
Одним из важнейших аспектов вывода нового лекарственного препарата на рынок является всестороннее изучение характеристик препарата, оценка его конкурентности и анализ факторов внешней среды, релевантных по отношению к нему.
Для количественной оценки динамики развития фармацевтического рынка и выявления положительных и отрицательных факторов необходимо изучить:
— объем и темпы роста фармацевтического рынка, его транспортную доступность;
— темпы роста платежеспособности населения;
— соотношение количества инновационных (оригинальных) препаратов, брэндированных дженериков и традиционных препаратов;
— основные каналы распространения лекарственных средств.
— сегментирование рынка потребителей изучаемого препарата;
— анализ внутренней и внешней конкурентной среды препарата;
— определение оптимальной розничной цены нового лекарственного препарата. Однако вывод препарата на рынок невозможен без его регистрации.
Регистрация лекарственного препарата (registration) – получение разрешения от уполномоченных органов (Министерство здравоохранения) на клиническое применение и реализацию препарата на рынке. Это важный и обязательный этап вывода препарат на рынок. Только получив регистрационное разрешение компания может начинать лонч нового лекарственного препарата.
Лонч – запуск лекарственного препарат (launch) – комплекс мероприятий по выведению препарата на рынок. На этом этапе необходимо составить оптимальный маркетинговый план продвижения нового лекарственного препарата. С этой целью целесообразно оценить эффективность всех известных способов продвижения применительно к выводимому на рынок препарату. К ним относятся:
— методы стимулирование сбыта для препаратов безрецептурного отпуска (конкурсы, лотереи, скидки и т.д.);
— связи с общественностью (спонсорство, благотворительность и т.д.);
— сочетания различных методов продвижения – выставки, обучающие тренинги, семинары, конференции.
Для оценки эффективности перечисленных видов продвижения рекомендуется комплексный подход, сочетающий методы социологического исследования с методом экспертных оценок. При таком подходе сначала проводится оценка эффективности того или иного метода продвижения потребителям информации о новом лекарственном препарате (конечные потребители, врачи, фармацевтические работники), а затем проводится ее корректировка экспертами фармацевтического маркетинга (или топ-менеджерами компании) с учетом эффективности данного метода и его финансовой реализуемости.
Но даже после вывода нового препарата на рынок его исследование не заканчивается.
— IV фаза клинических испытаний – проведение пострегистрационных клинических исследований, позволяющих выявить новые свойства лекарственного средства.
Ключевыми факторами, которые будут в дальнейшем влиять на эффективность проектов, связанных с разработкой новых лекарственных препаратов и выводом их на рынок, останутся: слияния фармкомпаний, продолжение влияния макроэкономических факторов, потеря патентной защиты рядом продуктов, ставших хитами продаж и приносивших колоссальные доходы бывшим патентовладельцам.
Расходы на R&D-проекты в последнее время продолжают повышаться, так в 2011 г. в среднем стоимость выведения на рынок одного лекарственного средства возросла на 25% по сравнению с предыдущим годом и превысила 1 млрд дол. США. При этом среднее количество лекарственных средств, находящихся в завершающей фазе клинических исследований, из расчета на одну компанию уменьшилось с 23 позиций в 2010 г. до 18 в 2011 г. Также было отмечено снижение расходов фармацевтических компаний во всех сферах за исключением R&D-разработок. Это, в свою очередь, привело к увеличению маржинальности продукции и освобождению дополнительных средств, которые могут быть инвестированы в R&D-разработки. По мнению аналитиков, действенным подходом, призванным повысить продуктивность R&D-разработок, может стать более тесное сотрудничество, как между участниками фармацевтического рынка, так и между фармацевтическими компаниями и научными учреждениями.
Т.И. Нужнова, Я.В. Грибова
Казанский государственный медицинский университет, г. Казань
1. Арсентьева И.В. Стратегическое планирование в аптечной практике / И.В. Арсентьева // Новая аптека. – 2009. – № 7. – С. 30–35.
2. Ламбен Ж.Ж. Стратегический маркетинг. Европейская перспектива / Пер. с франц. – СПб.: Наука, 1996. − 589 с.
3. Славич-Приступа А.С. Реклама и Мерчандайзинг в аптеке / А.С. Славич-Приступа. – М.: Литтера, 2006. – 80 с.
Источник
Как с помощью ИТ появляются новые лекарства: мишени, ключи и миллиарды долларов
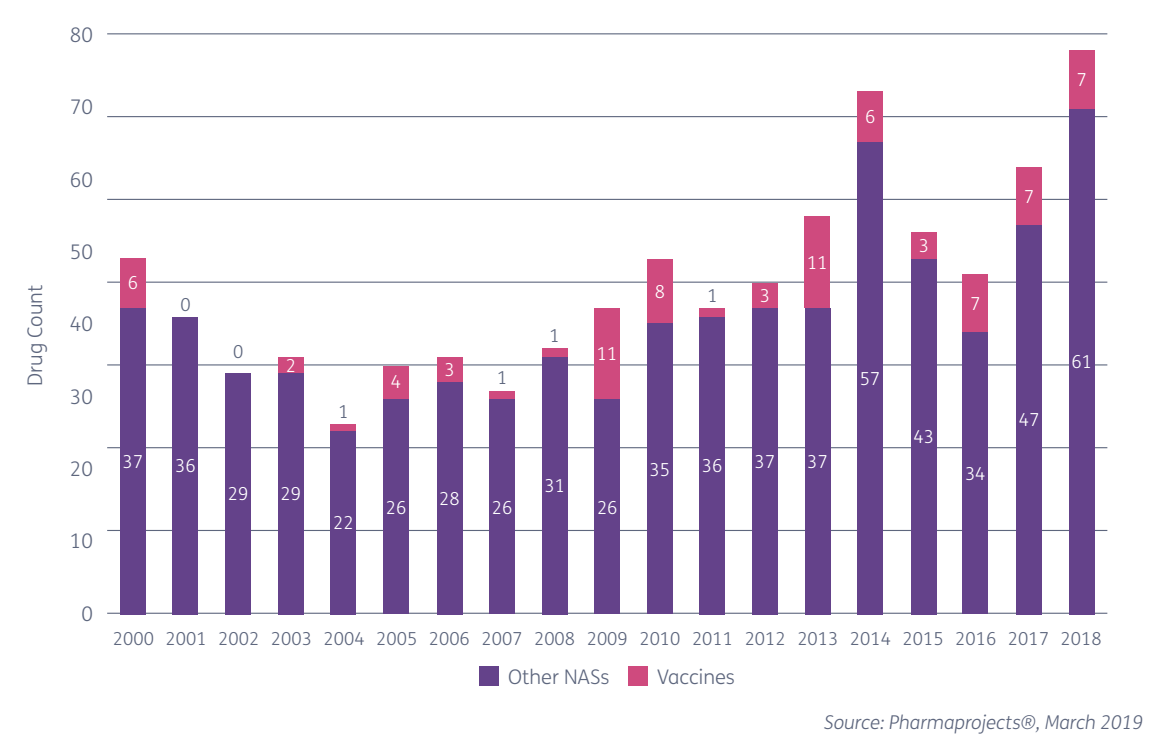
Фармацевтическая индустрия бьет рекорды — с каждым годом выпускается всё больше новых лекарственных препаратов. В 2018 году появилось 68 новых активных фармацевтических субстанций (АФС) — веществ или их смесей, предназначенных для использования в производстве лекарственного препарата. За 9 месяцев 2019 года импорт фармсубстанций в РФ превысил объем поставок за весь 2018 год. Глава евразийского подразделения фармацевтической компании «Босналек» Валентина Бучнева рассказала об этапах разработки лекарств и о том, как появляются новые АФС.
Читайте «Хайтек» в
Разработка новых лекарственных препаратов — долгий и сложный процесс. От исследований в лаборатории до попадания в аптеки и больницы проходит несколько лет — в среднем от 10 до 14. Срок в пять лет — удача для производителя, случается такое крайне редко. Плюс ко всему, из нескольких тысяч веществ, которые исследуются фармацевтами на первых этапах, до аптеки доходит всего одно.
Над созданием препаратов работает команда из нескольких сотен человек. Это биологи, генетики, химики и медики. Первый этап работы — лабораторные исследования.
Прицельное попадание в мишень
Перед тем, как начать разрабатывать лекарство от какого-либо недуга, нужно точно знать причину болезни и ключевую точку, при воздействии на которую болезнь можно остановить и повернуть процесс вспять. Эта точка называется мишенью. Чаще всего это белок или какой-то фермент в организме человека или в болезнетворном организме.
Когда мишень выбрана, начинается формирование целевой терапевтической молекулы — прообраза. Он должен соответствовать поставленным целям и успешно попадать в мишень.
Обычно подходит лишь одно действующее вещество. Для того, чтобы его найти, необходимо перебрать тысячи или даже десятки тысяч вариантов. Сейчас этот процесс выполняется при помощи компьютерных технологий, раньше фармацевты действовали фактически вслепую, методом проб и ошибок, на что уходило гораздо больше времени.
ИТ и математика в фармацевтике
Цифровые технологии позволяют значительно ускорить процесс разработки лекарственных препаратов. Особенно эффективно использование ИТ на начальных стадиях работы по созданию препарата. Для некоторых видов фармацевтических препаратов их лечебные свойства можно предсказать еще на стадии моделирования. Дело в том, что ученым известны параметры модели — физиологические процессы заболевания и мишень. Моделирование дает возможность собрать «ключ» — молекулу, которая идеально подходит для мишени.
Выгода от использования компьютерных технологий еще и в том, что они помогают специалистам обрабатывать огромные массивы данных. Фармацевтические компании обладают гигантскими базами, в которых содержится подробная информация о разработке и свойствах разных препаратов. Мозг человека просто не в состоянии охватить всё это, поэтому на помощь пришли математика, компьютерный анализ, big data и машинное обучение.
В частности, математическая модель ускорила выход на рынок препарата против рассеянного склероза. Его разработчики определили точную концентрацию активного вещества для оказания максимального положительного эффекта на больного. Регулятор из США, FDA, согласился с выкладками ученых и одобрил регистрацию препарата без дополнительных исследований. Пока что это исключение из общего правила, но его можно назвать прецедентным.
Доклинические исследования
Следующий этап — поиск наиболее эффективного действующего вещества. Оптимальный вариант выбирается в ходе тестирования нескольких активных веществ на животных. Фаза называется доклиническими исследованиями. Специалисты оценивают силу биологического действия вещества, наблюдают за возможными побочными эффектами. Это нужно для того, чтобы определить показания к применению препаратов и идентифицировать противопоказания.
Кроме того, доклинический этап исследования позволяет исследователям определить дозозависимость эффектов лекарства плюс максимально возможную безопасную дозу и целесообразность ее повышения. Если доза будет очень большой, лекарство станет токсичным, слишком маленькой — оно может не оказать необходимого лечебного эффекта. Задача — определить терапевтическое окно, то есть такой диапазон доз, когда лекарство дает максимальный эффект, но еще не является токсичным.
На этом этапе тоже используются компьютерные технологии, что снижает количество подопытных животных. К сожалению, полностью отказаться от таких испытаний фармацевты пока не могут. Исследование новых препаратов включает в себя определение общей и специфической токсичности, фармакодинамики (то, как ведет себя препарат в организме) и фармакокинетики (то, как влияет препарат на организм в целом). Математические методы позволяют построить модель как фармакокинетики, так и фармакодинамики. Модель обычно представляет сложную систему, которая учитывает множество факторов.
В ходе доклинических испытаний может отсеяться около 90% потенциально эффективных препаратов.
Клинические испытания
После того, как разработчики препарата провели доклинические испытания, выяснив все важные моменты, наступает стадия клинических испытаний. В ее ходе может отсеяться еще 90% действующих веществ.
Структура клинических испытаний зависит от вида препарата. Обычно выделяют четыре основных этапа клинических испытаний.
- Тестирование препарата на здоровых добровольцах. Как правило, их не должно быть меньше 10. Добровольцы нужны для того, чтобы точно выяснить побочные эффекты, определить переносимость и безопасность препарата. Специалисты на этом этапе проводят новое изучение фармакокинетики и фармакодинамики, но уже на организме человека, а не животных.
- Проверка лечебного воздействия препаратов на пациентах с конкретным заболеванием. Чаще всего добровольцев разделяют на основную группу, которая принимает лекарства, и контрольную группу, которой дают плацебо — лекарство без действующего вещества.
- Масштабная проверка препарата на больших группах добровольцев. Численность таких групп может составлять тысячу человек и больше. Испытуемые должны быть разного возраста, с сопутствующими заболеваниями .
Если всё хорошо, подается заявка на регистрацию препарата (это тысячи документов, отчеты исследователей, результаты доклинических и клинических испытаний). Если у регистрирующих органов возникают какие-то сомнения, заявку могут отправить на доработку или вообще запретить вывод препарата на рынок.
- Пострегистрационный этап, он проводится уже после того, как лекарство выпустили на рынок. Цель — определить эффективность препарата по отношению к аналогам (если они есть), выявить дополнительные побочные эффекты и факторы риска. Если будут найдены серьезные проблемы, лекарство может быть даже отозвано с рынка.
А сколько всё это стоит?
Очень много. По оценке аналитиков, средние затраты фармацевтических компаний на вывод нового лекарственного препарата на рынок составили $802 млн в 2000 году. Через несколько лет сумма увеличилась до $1,7 млрд, сейчас этот показатель еще выше и составляет около $2,5 млрд. А вот вероятность появления на рынке новой молекулы после клинических испытаний составляет всего 11,5%. То есть девять лекарственных препаратов из десяти никогда не попадут в аптеки, несмотря на то, что компании вложили в разработку огромные деньги.
Стоимость исследований постоянно увеличивается, а вот их результативность — падает . По этой причине фармацевтические компании адаптируют свои бизнес-модели к текущим условиям, учитывая такие факторы, как небольшая коммерческая отдача от стадии исследований, замедление роста выручки и конкуренция со стороны других компаний и дженериков (аналоги оригинальных лекарственных препаратов).
Проблема высокой стоимости этапа исследований решается при помощи концепции открытых инноваций — это вовлечение партнеров со стороны в процесс исследований и разработок. Фармацевтические компании активно сотрудничают с научным сообществом, стартапами и институтами развития. В итоге компании помогают исследователям в их разработках, а ученые — приносят пользу фармацевтике за счет новых идей, методов работы, оригинальных решений.
Что касается западных стран, то концепция открытых инноваций там активно работает. В России же она находится на этапе становления. Отечественные фармкомпании начинают активно работать с учеными, научно-исследовательскими организациями и государством. Если всё получится, то российским ученым удастся создать эффективную цепочку производства лекарственных препаратов, ускорив появление новых лекарств и снизив стоимость всего цикла разработки.
Источник