- Перечень взаимозаменяемых лекарственных препаратов для медицинского применения
- Является ли использование данного Перечня обязательным?
- На сегодняшний день сказать, что норма п.5 обязательна для фармацевтических сотрудников нельзя т.к. сам п.5 Правил не содержит конкретного указания на необходимость использования Перечня фармацевтическими работниками, также там не прописано как именно необходимо использовать информацию о взаимозаменяемых ЛП при их отпуске. Таких требований не предусмотрено и Приказом МЗ РФ от 31.08.2016 N 647н « Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения ».
- Единственная обязанность, которая прописана, относится к руководителю аптечной организации. Согласно п.17 Приказа №647н « Руководитель субъекта розничной торговли обеспечивает проведение по утвержденному им плану-графику первичной и последующей подготовки (инструктажа) работников по следующим вопросам:
- л) совершенствование знаний о ЛП, в том числе воспроизведенных ЛП, взаимозаменяемых ЛП, умение представлять сравнительную информацию по ЛП и ценам, в том числе ЛП нижнего ценового сегмента, о новых ЛП, лекарственных формах ЛП, показаниях к применению ЛП ».
- Предусмотрен ли какой-нибудь вид ответственности за неиспользование фармацевтами в своей работе Перечня взаимозаменяемых ЛП?
- Существующая формулировка п.5 ПП №1357 не дает возможности определить что именно будет нарушением, также нигде не прописано как можно контролировать соблюдение аптечными работниками выполнения п.5, соответственно пока нельзя определить вид ответственности.
- Авторское послесловие
- Я бы не хотела, чтобы аптечные работники рассматривали использование Перечня взаимозаменяемых ЛП министерства здравоохранения как дополнительную нагрузку к их обязанностям. На мой взгляд, этот Перечень – скорее подсказка и помощь первостольнику при осуществлении фармацевтического консультирования и в ситуациях, когда необходимо произвести замену ЛП.
- Как работать с перечнем взаимозаменяемых лекарств по 44-ФЗ
- Когда используют взаимозаменяемость лекарств по 44-ФЗ
- Где найти перечень взаимозаменяемых лекарств
- Как с ним работать
- Когда отсутствие ссылки на эквиваленты обосновано
- Взаимозаменяемость лекарственных препаратов таблица взаимозаменяемости
- Постановление Правительства РФ от 5 сентября 2020 г. N 1360 “О порядке определения взаимозаменяемости лекарственных препаратов для медицинского применения”
- Правила определения взаимозаменяемости лекарственных препаратов для медицинского применения
- Обзор документа
Перечень взаимозаменяемых лекарственных препаратов для медицинского применения
Обновленный (дополненный) перечень взаимозаменяемых ЛП опубликован 01.10.2020 на сайте ГРЛС в разделе новости. После опубликования перечня аптечные работники разделились на два лагеря: одни утверждают, что данный перечень только для врачей, другие же, наоборот, считают его обязательным в своей работе и говорят об ответственности, если не пользоваться им.
Разберемся кто прав!
Основные нормативные акты, регулирующие данный вопрос:
Закрепляют ли перечисленные выше нормативные документы необходимость использования данного Перечня фармацевтами в своей работе?
Согласно п.5 Правил использования информации о взаимозаменяемых лекарственных препаратах, утвержденных ПП РФ 04.09.2020 № 1357 «Информация о взаимозаменяемых лекарственных препаратах используется фармацевтическими работниками при реализации лекарственных препаратов, имеющих одинаковое международное непатентованное (химическое или группировочное) наименование, при предоставлении покупателю информации о них в соответствии с правилами надлежащей аптечной практики».
Является ли использование данного Перечня обязательным?
На сегодняшний день сказать, что норма п.5 обязательна для фармацевтических сотрудников нельзя т.к. сам п.5 Правил не содержит конкретного указания на необходимость использования Перечня фармацевтическими работниками, также там не прописано как именно необходимо использовать информацию о взаимозаменяемых ЛП при их отпуске. Таких требований не предусмотрено и Приказом МЗ РФ от 31.08.2016 N 647н « Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения ».
Единственная обязанность, которая прописана, относится к руководителю аптечной организации. Согласно п.17 Приказа №647н « Руководитель субъекта розничной торговли обеспечивает проведение по утвержденному им плану-графику первичной и последующей подготовки (инструктажа) работников по следующим вопросам:
л) совершенствование знаний о ЛП, в том числе воспроизведенных ЛП, взаимозаменяемых ЛП, умение представлять сравнительную информацию по ЛП и ценам, в том числе ЛП нижнего ценового сегмента, о новых ЛП, лекарственных формах ЛП, показаниях к применению ЛП ».
Предусмотрен ли какой-нибудь вид ответственности за неиспользование фармацевтами в своей работе Перечня взаимозаменяемых ЛП?
Существующая формулировка п.5 ПП №1357 не дает возможности определить что именно будет нарушением, также нигде не прописано как можно контролировать соблюдение аптечными работниками выполнения п.5, соответственно пока нельзя определить вид ответственности.
Авторское послесловие
Я бы не хотела, чтобы аптечные работники рассматривали использование Перечня взаимозаменяемых ЛП министерства здравоохранения как дополнительную нагрузку к их обязанностям. На мой взгляд, этот Перечень – скорее подсказка и помощь первостольнику при осуществлении фармацевтического консультирования и в ситуациях, когда необходимо произвести замену ЛП.
Резюмируя, хочется порекомендовать руководителям проинформировать сотрудников и распечатать данный Перечень, а фармацевтам положить его в удобном и доступном месте и использовать при необходимости.
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Чтобы оставить комментарий к статье, вам нужно зарегистрироваться или войти .
Источник
Как работать с перечнем взаимозаменяемых лекарств по 44-ФЗ
Взаимозаменяемость лекарственных средств — это характеристика, которая отражает терапевтическую эквивалентность или биоэквивалентность для референтного лекарства. С 30 июня заработал перечень взаимозаменяемых лекарств. Используйте его в госзакупках.
| Скачать письмо Минздрава №18-2/И/2-8895 от 25.06.2020 о разъяснении порядка применения сведений о взаимозаменяемости лекарств из КонсультантПлюс |
Когда используют взаимозаменяемость лекарств по 44-ФЗ
При подготовке тендерной документации на закупку медикаментов, заказчик указывает:
- международное непатентованное наименование (МНН);
- лекарственную форму с учетом эквивалентов;
- дозировку с учетом взаимозаменяемых медикаментов;
- количество (объем) товара, который подлежит поставке;
- остаточный срок годности.
Минздрав в письме №3175/25-2 от 17.12.2019 об особенностях осуществления закупок лекарственных препаратов разъясняет, что взаимозаменяемость медикаментов устанавливают на основании ст. 27.1 ФЗ №61 «Об обращении лекарственных средств» от 12.04.2010 и правил, которые утверждены ПП №1154 от 28.10.2015.
Новые правила, по которым определяют эквивалентность медикаментов, включены в проект постановления «Об утверждении Правил определения взаимозаменяемости лекарственных препаратов» (№ проекта 01/01/05-20/00101700).
Взаимозаменяемость определяется исходя из ст. 27.1 61-ФЗ:
- эквивалентности качественных и количественных характеристик лекарства;
- формы выпуска;
- сопоставимости вспомогательных веществ, которые входят в состав;
- способа применения;
- соответствия производителя обязательным требованиям.
Поправки в 61-ФЗ, которые вступили в силу 1 марта, обязали Минздрав включить взаимозаменяемые лекарства в сводный перечень на основании заключения экспертной комиссии и разместить документ для всеобщего ознакомления на официальном сайте ГРЛС не позднее 1 июля (475-ФЗ от 27.12.2019 г.).
Также информация о эквивалентах присутствует в справочнике ЕСКЛП.
Где найти перечень взаимозаменяемых лекарств
30 июня Минздрав разместил реестр на сайте Государственного реестра лекарственных средств. Документ включает в себя медикаменты, эквивалентность которых доказана. Рассказываем, как его найти:
Шаг 1. Открыть сайт ГРЛС.
Шаг 2. На главной странице выбрать сообщение о публикации реестра.
Шаг 3. Открыть или скачать документ, который приложен к информационному сообщению.
На сегодняшний день в перечне присутствует более ста медикаментов из нескольких тысяч, которые зарегистрированы и присутствуют на российском рынке. В поправках в 61-ФЗ сказано, что экспертный орган определяет взаимозаменяемость лекарственных форм (если это не сделано ранее) вплоть до 1 января 2021 года (475-ФЗ). Если зарегистрировано новое лекарство — эксперты определяют референтный препарат и вносят данные в реестр.
Как с ним работать
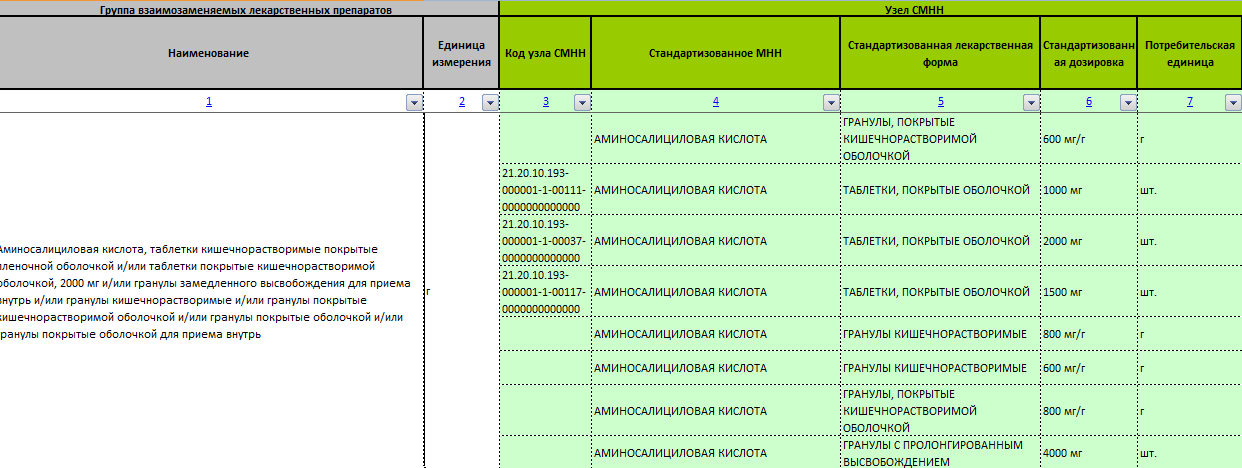
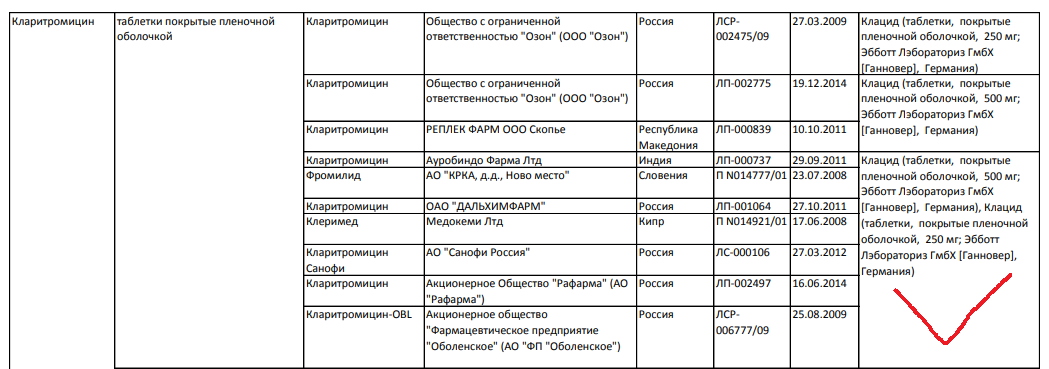
Перечень представляет из себя список медикаментов в виде таблицы, в котором указаны:
- международное непатентованное наименование (МНН);
- лекарственная форма;
- торговое название;
- владелец РУ;
- страна владельца РУ;
- номер регистрационного удостоверения;
- дата регистрации;
- фармацевтическая взаимозаменяемость.
Рассказываем, как работать с реестром:
Шаг 1. Открываем перечень.
Шаг 2. Находим необходимый медикамент.
Шаг 3. В графе «Референтные лекарственные препараты» смотрим название лекарства, которое является эквивалентом.
Шаг 4. Вносим информацию в техническое задание на закупку.
Когда отсутствие ссылки на эквиваленты обосновано
Практика показывает, что в исключительных случаях заказчик вправе не ссылаться в тендерной документации на все возможные эквиваленты. В качестве обоснования послужат выдержки из инструкций медикаментов, необходимость обеспечить безопасность персонала, обеспечение совместимости с оборудованием, которое уже закуплено и взаимозаменяемость ЛС.
Пример №1: заказчик доказал, что закупка препарата «Филграстим» с устройством безопасной иглы, которое защищает медицинский персонал от повреждений, необходима. В обосновании учреждение сослалось на то, что предупредить заражение персонала от пациентов тяжелыми и неизлечимыми вирусами и инфекциями (в том числе и ВИЧ) — неотъемлемая часть работы. ФАС встал на сторону заказчика при том, что учреждение требовало к поставке не все эквиваленты.
Пример №2: заказчик указал в тендерной документации не все эквивалентные формы лекарства. При рассмотрении жалобы в ФАС учреждение доказало, что это решение продиктовано необходимостью — инструкция к той форме, которая не требовалась к поставке, содержала иные показания к использованию.
Пример №3: заказчик закупил препарат в той форме выпуска, которая требовалась для взаимодействия с используемым оборудованием. К обоснованию приложил информацию от производителя. Территориальное управление ФАС поддержало заказчика. Через некоторое время ФАС выпустил письмо № ИА/23540/18 от 05.04.2018, в котором разъяснил, что отличия в форме выпуска не являются определяющими.
Прописывая в техническом задании определенную форму выпуска или препарат, учитывайте, что позиция ФАС меняется. Принятые ранее решения — не гарант того, что закупка обоснована.
Опыт работы в сфере госзаказа более 10 лет (скорая помощь, театр им. Н.П. Акимова, Биржа — торги для Газпрома, Транснефти). Высшее образование по специальности «Финансы и кредит» (Университет при МА ЕВРАЗЭС), дипломированный эксперт по госзакупкам.
Источник
Взаимозаменяемость лекарственных препаратов таблица взаимозаменяемости
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.
Программа разработана совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Постановление Правительства РФ от 5 сентября 2020 г. N 1360 “О порядке определения взаимозаменяемости лекарственных препаратов для медицинского применения”
В соответствии со статьей 27 1 Федерального закона «Об обращении лекарственных средств» Правительство Российской Федерации постановляет:
1. Утвердить прилагаемые:
Правила определения взаимозаменяемости лекарственных препаратов для медицинского применения;
форму заключения комиссии экспертов федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств о взаимозаменяемости лекарственных препаратов для медицинского применения либо о том, что лекарственный препарат для медицинского применения не является взаимозаменяемым.
2. Признать утратившим силу постановление Правительства Российской Федерации от 28 октября 2015 г. N 1154 «О порядке определения взаимозаменяемости лекарственных препаратов для медицинского применения» (Собрание законодательства Российской Федерации, 2015, N 45, ст. 6248).
3. Настоящее постановление вступает в силу со дня его официального опубликования.
| Председатель Правительства Российской Федерации | М. Мишустин |
УТВЕРЖДЕНЫ
постановлением Правительства
Российской Федерации
от 5 сентября 2020 г. N 1360
Правила
определения взаимозаменяемости лекарственных препаратов для медицинского применения
1. Настоящие Правила устанавливают порядок определения взаимозаменяемости лекарственных препаратов для медицинского применения (далее — лекарственные препараты), а также особенности определения взаимозаменяемости отдельных видов лекарственных препаратов.
Настоящие Правила не распространяются на лекарственные растительные препараты и гомеопатические лекарственные препараты.
2. Взаимозаменяемость лекарственного препарата определяется Министерством здравоохранения Российской Федерации (далее — Министерство) на основе заключения комиссии экспертов федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств о взаимозаменяемости лекарственных препаратов для медицинского применения либо о том, что лекарственный препарат для медицинского применения не является взаимозаменяемым (далее соответственно — экспертное учреждение, заключение), представляемого экспертным учреждением по форме, утвержденной постановлением Правительства Российской Федерации от 5 сентября 2020 г. N 1360 «О порядке определения взаимозаменяемости лекарственных препаратов для медицинского применения».
3. Взаимозаменяемость лекарственных препаратов устанавливается на основании следующих критериев (характеристик):
а) эквивалентность (для биоаналоговых (биоподобных) лекарственных препаратов (биоаналогов) — сопоставимость) качественных и количественных характеристик фармацевтических субстанций или сопоставимость антигенного состава вакцин. Использование различных солей, эфиров, комплексов, изомеров, кристаллических форм и других производных одного и того же действующего вещества не является препятствием для определения взаимозаменяемости лекарственных препаратов, если при проведении исследования биоэквивалентности лекарственного препарата или исследования терапевтической эквивалентности лекарственного препарата доказано отсутствие клинически значимых различий фармакокинетики и (или) эффективности и безопасности лекарственного препарата;
б) эквивалентность лекарственной формы. Под эквивалентными лекарственными формами понимаются разные лекарственные формы, имеющие одинаковые способ введения и способ применения, обладающие сопоставимыми фармакокинетическими характеристиками и фармакологическим действием и обеспечивающие также достижение необходимого клинического эффекта. Различия лекарственных форм не являются препятствием для определения взаимозаменяемости лекарственных препаратов, если при проведении исследования биоэквивалентности лекарственного препарата или исследования терапевтической эквивалентности лекарственного препарата доказано отсутствие клинически значимых различий фармакокинетики и (или) эффективности и безопасности лекарственного препарата;
в) эквивалентность или сопоставимость состава вспомогательных веществ лекарственного препарата. Различия составов вспомогательных веществ лекарственного препарата не являются препятствием для определения взаимозаменяемости лекарственных препаратов, если при проведении исследования биоэквивалентности лекарственного препарата или исследования терапевтической эквивалентности лекарственного препарата доказано отсутствие клинически значимых различий фармакокинетики и (или) эффективности и безопасности лекарственного препарата для медицинского применения. При наличии клинически значимых различий фармакокинетики и (или) эффективности и безопасности лекарственного препарата взаимозаменяемость определяется с указанием на исключение отдельных групп пациентов;
г) идентичность способа введения и способа применения;
д) соответствие производителя лекарственного средства требованиям правил надлежащей производственной практики.
4. Определение параметров, предусмотренных подпунктами «а» — «в» пункта 3 настоящих Правил, осуществляется комиссией экспертов экспертного учреждения посредством сравнения нормативной документации на лекарственные препараты, отчетов о проведенных исследованиях биоэквивалентности или терапевтической эквивалентности лекарственных препаратов, а также документов и сведений, указанных в пунктах 1 и 2 части 5 статьи 18 Федерального закона «Об обращении лекарственных средств».
Определение параметра, предусмотренного подпунктом «г» пункта 3 настоящих Правил, осуществляется комиссией экспертов экспертного учреждения посредством сравнения инструкций по медицинскому применению лекарственных препаратов.
Определение параметра, предусмотренного подпунктом «д» пункта 3 настоящих Правил, осуществляется комиссией экспертов экспертного учреждения посредством оценки документов и сведений, предусмотренных пунктами 3 и 4 части 4 статьи 18 Федерального закона «Об обращении лекарственных средств».
5. При определении комиссией экспертов экспертного учреждения взаимозаменяемости биологических лекарственных препаратов устанавливается:
а) идентичность международных непатентованных или группировочных или химических наименований лекарственных препаратов;
б) эквивалентность лекарственных форм лекарственных препаратов;
в) сопоставимость качественных и количественных характеристик фармацевтических субстанций (при наличии), входящих в состав лекарственных препаратов;
г) идентичность имеющихся в инструкциях по медицинскому применению лекарственных препаратов показаний и противопоказаний к медицинскому применению лекарственных препаратов, в том числе особенностей применения лекарственных препаратов у различных возрастных групп пациентов, включая детей;
д) эквивалентность показателей фармакокинетики и (или) фармакодинамики;
е) сопоставимость показателей безопасности, эффективности и иммуногенности по результатам исследований терапевтической эквивалентности.
6. При определении комиссией экспертов экспертного учреждения взаимозаменяемости комбинированных лекарственных препаратов (содержащих комбинацию 2 и более действующих веществ) устанавливается:
а) идентичность группировочных наименований лекарственных препаратов:
б) эквивалентность лекарственных форм лекарственных препаратов;
в) эквивалентность качественных и количественных характеристик фармацевтических субстанций, входящих в состав лекарственных препаратов;
г) идентичность имеющихся в инструкциях по медицинскому применению лекарственных препаратов показаний и противопоказаний к медицинскому применению лекарственных препаратов.
7. Взаимозаменяемые комбинированные лекарственные препараты (содержащие комбинацию 2 и более действующих веществ) должны быть зарегистрированы в Российской Федерации по результатам проведения исследования биоэквивалентности или терапевтической эквивалентности с соответствующим референтным комбинированным препаратом либо соответствующими референтными лекарственными препаратами, имеющими международные непатентованные (химические или группировочные) наименования, входящие в состав соответствующего комбинированного лекарственного препарата.
8. При определении комиссией экспертов экспертного учреждения взаимозаменяемости недозированных лекарственных препаратов устанавливается:
а) идентичность международных непатентованных (группировочных или химических) наименований лекарственных препаратов;
б) эквивалентность лекарственных форм лекарственных препаратов;
в) эквивалентность качественных и количественных характеристик фармацевтических субстанций, входящих в состав лекарственных препаратов;
г) идентичность имеющихся в инструкциях по медицинскому применению лекарственных препаратов показаний и противопоказаний к медицинскому применению лекарственных препаратов.
9. При определении комиссией экспертов экспертного учреждения взаимозаменяемости лекарственных препаратов для парентерального питания устанавливается:
а) идентичность международных непатентованных (группировочных или химических) наименований лекарственных препаратов;
б) эквивалентность лекарственных форм лекарственных препаратов;
в) эквивалентность качественных и количественных характеристик фармацевтических субстанций, входящих в состав лекарственных препаратов;
г) идентичность имеющихся в инструкциях по медицинскому применению лекарственных препаратов показаний и противопоказаний к медицинскому применению лекарственных препаратов.
10. Взаимозаменяемость воспроизведенных лекарственных препаратов, предусмотренных пунктами 1 — 7 части 10 статьи 18 Федерального закона «Об обращении лекарственных средств», устанавливается без необходимости доказательства их биоэквивалентности.
11. Взаимозаменяемость лекарственных препаратов, указанных в пункте 4 части 4 статьи 3 Федерального закона от 27 декабря 2019 г. N 475-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Федеральный закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств», устанавливается без необходимости доказательства их биоэквивалентности.
12. Допускается установление взаимозаменяемости комбинированных лекарственных препаратов (представляющих собой комбинацию 2 и более действующих веществ) и комбинации из отдельных лекарственных препаратов, имеющих международные непатентованные (химические или группировочные) наименования, входящие в состав соответствующих комбинированных лекарственных препаратов.
13. Воспроизведенные лекарственные препараты (биоаналоговые (биоподобные), взаимозаменяемые по отношению к одному референтному лекарственному препарату, взаимозаменяемы между собой.
14. Экспертное учреждение по истечении 10 рабочих дней со дня внесения Министерством информации о зарегистрированном лекарственном препарате в государственный реестр лекарственных средств формирует комиссию экспертов в целях осуществления экспертизы регистрационного досье на лекарственный препарат для определения его взаимозаменяемости.
15. Экспертное учреждение в течение 20 рабочих дней со дня формирования комиссии экспертов проводит экспертизу регистрационного досье на лекарственный препарат, оформляет заключение и направляет его в Министерство.
16. В случае выявления экспертным учреждением отсутствия в регистрационном досье на воспроизведенный (биоаналоговый, биоподобный) лекарственный препарат, взаимозаменяемость которого не установлена в соответствии с частью 4 статьи 3 Федерального закона от 27 декабря 2019 г. N 475-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Федеральный закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и со статьей 27 1 Федерального закона «Об обращении лекарственных средств», результатов исследования биоэквивалентности или терапевтической эквивалентности по отношению к референтному лекарственному препарату экспертное учреждение в течение 3 рабочих дней со дня обнаружения отсутствия указанной информации направляет данные сведения в Министерство.
В указанных сведениях в отношении каждого лекарственного препарата экспертным учреждением устанавливается срок, достаточный для проведения необходимых клинических исследований, но не более чем 3 года.
17. В случае выявления в инструкциях по медицинскому применению взаимозаменяемых лекарственных препаратов различий в показаниях для применения (за исключением показаний для применения, включенных в инструкции на основании результатов соответствующих исследований) и в противопоказаниях для применения экспертное учреждение в течение 3 рабочих дней со дня обнаружения таких различий направляет соответствующие сведения в Министерство.
18. Министерство в течение 3 рабочих дней со дня получения сведений, указанных в пунктах 16 и 17 настоящих Правил, направляет держателю или владельцу регистрационного удостоверения лекарственного препарата (уполномоченному им юридическому лицу) запрос о необходимости представления отчетов о результатах соответствующих клинических исследований лекарственного препарата с учетом установленного экспертным учреждением срока для их проведения или о необходимости приведения показаний для применения и противопоказаний для применения, имеющихся в инструкции по медицинскому применению лекарственного препарата, в соответствие с показаниями для применения и противопоказаниями для применения, имеющимися в инструкции по медицинскому применению референтного лекарственного препарата, в срок, не превышающий 6 месяцев.
Указанный запрос может быть передан уполномоченному представителю держателя или владельца регистрационного удостоверения лекарственного препарата лично под расписку, направлен по почте заказным письмом или передан в электронной форме по телекоммуникационным каналам связи, в том числе посредством личного кабинета.
В случае направления запроса по почте заказным письмом он считается полученным по истечении 6 дней со дня направления заказного письма.
19. Министерством на портале по ведению государственного реестра лекарственных средств в личном кабинете держателя или владельца регистрационного удостоверения (уполномоченного им лица) (далее — личный кабинет заявителя) размещается заключение в течение 3 рабочих дней со дня его поступления от экспертного учреждения.
20. Перечень взаимозаменяемых лекарственных препаратов, размещенный на официальном сайте Министерства в информационно-телекоммуникационной сети «Интернет», обновляется Министерством не реже 1 раза в месяц с учетом установленной взаимозаменяемости на новые зарегистрированные лекарственные препараты и изменений, внесенных в документы, содержащиеся в регистрационных досье на зарегистрированные лекарственные препараты.
21. Заключение может быть обжаловано держателем или владельцем регистрационного удостоверения лекарственного препарата (уполномоченным им лицом) в Министерство в течение 20 рабочих дней со дня размещения заключения в личном кабинете заявителя посредством подачи жалобы через личный кабинет заявителя.
22. Для рассмотрения жалобы и принятия по ней решения Министерство создает комиссию, в которую включаются представители подведомственных Министерству научных организаций и образовательных организаций высшего образования, осуществляющих деятельность в сфере обращения лекарственных средств (далее — комиссия), и истребует у экспертного учреждения документы и сведения, на основании которых оформлено обжалуемое заключение. В состав комиссии не могут быть включены представители экспертного учреждения. Положение о комиссии и ее состав утверждаются Министерством.
23. Рассмотрение жалобы с учетом поступивших из экспертного учреждения документов и сведений осуществляется комиссией в течение 10 рабочих дней со дня ее поступления путем принятия одного из следующих решений:
а) оставить жалобу без удовлетворения;
б) признать жалобу обоснованной полностью или частично и направить в экспертное учреждение предписание об устранении выявленных нарушений с внесением при необходимости по результатам его исполнения изменений в перечень взаимозаменяемых лекарственных препаратов.
24. Мотивированное решение комиссии размещается в личном кабинете заявителя в течение 2 рабочих дней со дня его принятия.
25. Экспертное учреждение в течение 5 рабочих дней со дня получения предписания, указанного в подпункте «б» пункта 23 настоящих Правил, направляет в Министерство соответствующее заключение и вносит изменения в перечень взаимозаменяемых лекарственных препаратов.
УТВЕРЖДЕНА
постановлением Правительства
Российской Федерации
от 5 сентября 2020 г. N 1360
заключения комиссии экспертов федерального государственного
бюджетного учреждения по проведению экспертизы лекарственных средств о
взаимозаменяемости лекарственных препаратов для медицинского применения
либо о том, что лекарственный препарат для медицинского применения не
Министерство здравоохранения Российской Федерации
(наименование федерального государственного бюджетного учреждения)
(руководитель, подпись, печать)
«___» _________ 20__ г.
(наименование федерального государственного бюджетного учреждения)
(взаимозаменяемости лекарственных препаратов для медицинского
применения либо о том, что лекарственный препарат для медицинского
применения не является взаимозаменяемым)
I. Общие сведения о лекарственном препарате, подлежащем определению
взаимозаменяемости, и взаимозаменяемом (референтном) лекарственном
1. Лекарственный препарат, подлежащий определению
1.1. наименование лекарственного препарата:
химическое или группировочное______________________________________;
1.2. дата государственной регистрации лекарственного препарата в
Российской Федерации и номер регистрационного удостоверения______________
1.3. вид лекарственного препарата__________________________________;
биоаналог, комбинированный, для
парентерального питания, другой)
1.4. лекарственная форма___________________________________________;
1.5. фармацевтическая субстанция:
наименование фармацевтической субстанции___________________________;
наименование, или группировочное, или
химическое, а также торговое (при наличии)
номер реестровой записи (при наличии)______________________________;
1.6. способ введения или применения лекарственного препарата
(для приема внутрь, для наружного применения, для местного
применения, для парентерального применения, для ингаляционного
1.7. наличие или отсутствие в регистрационном досье результатов
исследования биоэквивалентности лекарственного препарата или исследования
терапевтической эквивалентности лекарственного препарата
(имеются или отсутствуют)
1.7.1. наименование исследования биоэквивалентности лекарственного
препарата (исследования терапевтической эквивалентности лекарственного
1.7.2. наименование лекарственного препарата сравнения, который
использовался при проведении исследования биоэквивалентности
лекарственного препарата (исследования терапевтической эквивалентности
химическое или группировочное_______________________________________;
1.7.3. доказанные клинически значимые различия фармакокинетики и
(или) эффективности и безопасности лекарственного препарата при
проведении исследования биоэквивалентности лекарственного препарата
(исследования терапевтической эквивалентности лекарственного препарата)
(имеются или отсутствуют)
2. Взаимозаменяемый (референтный) лекарственный препарат для целей
2.1. наименование лекарственного препарата:
химическое или группировочное______________________________________;
2.2. дата государственной регистрации лекарственного препарата в
Российской Федерации и номер регистрационного удостоверения (дата
регистрации в иностранном государстве)__________________________________;
2.3. вид лекарственного препарата__________________________________;
(оригинальный, воспроизведенный, биоаналог)
2.4. лекарственная форма __________________________________________;
2.5. фармацевтическая субстанция:
наименование фармацевтической субстанции___________________________;
наименование, или группировочное, или
химическое, а также торговое (при наличии)
номер реестровой записи (при наличии)______________________________;
2.6. способ введения или применения лекарственного препарата
(для приема внутрь, для наружного применения, для местного
применения, для парентерального применения, для ингаляционного
2.7. референтный лекарственный препарат, который использовался как
препарат сравнения при проведении исследования биоэквивалентности
лекарственного препарата (исследования терапевтической эквивалентности
лекарственного препарата), подлежащего определению взаимозаменяемости
II. Критерии (характеристики), на основании которых устанавливается
взаимозаменяемость лекарственных препаратов
1. Эквивалентность (для биоаналоговых (биоподобных) лекарственных
препаратов (биоаналогов) — сопоставимость) качественных и количественных
характеристик фармацевтических субстанций лекарственного препарата или
сопоставимость антигенного состава вакцин, подлежащих определению
взаимозаменяемости, и взаимозаменяемого (референтного) лекарственного
а) результат оценки критерия (характеристики) — качественные и
количественные характеристики фармацевтических субстанций, входящих в
состав лекарственного препарата, или антигенный состав вакцин
(эквивалентны (для биоаналоговых (биоподобных) лекарственных
препаратов (биоаналогов), вакцин — сопоставимы) взаимозаменяемому
(референтному) лекарственному препарату или не эквивалентны
б) обоснование оценки критерия (характеристики)____________________.
2. Эквивалентность лекарственной формы лекарственного препарата,
подлежащего определению взаимозаменяемости, и взаимозаменяемого
(референтного) лекарственного препарата:
а) результат оценки критерия (характеристики) — лекарственная форма
лекарственного препарата для медицинского применения
(эквивалентна взаимозаменяемому (референтному) лекарственному
препарату или не эквивалентна)
б) обоснование оценки критерия (характеристики)____________________.
3. Эквивалентность или сопоставимость состава вспомогательных
веществ лекарственного препарата, подлежащего определению
взаимозаменяемости, и взаимозаменяемого (референтного) лекарственного
а) состав вспомогательных веществ лекарственного препарата для
(эквивалентен взаимозаменяемому (референтному)
лекарственному препарату или не эквивалентен)
б) обоснование оценки критерия (характеристики)____________________;
в) указание на исключение отдельных групп пациентов (если применимо)
при оценке критерия (характеристики)_____________________________________
4. Идентичность способа введения и способа применения лекарственного
препарата, подлежащего определению взаимозаменяемости, и
взаимозаменяемого (референтного) лекарственного препарата:
а) способ введения и применения лекарственного препарата
(идентичен или не идентичен)
б) обоснование оценки критерия (характеристики)____________________.
5. Соответствие производителя лекарственного средства требованиям
правил надлежащей производственной практики:
а) соответствие производителя лекарственного средства требованиям
правил надлежащей производственной практики______________________________
(подтверждено или не подтверждено заключением)
б) обоснование оценки критерия (характеристики)____________________.
III. Общий вывод по результатам экспертной оценки
по определению взаимозаменяемости
лекарственного препарата для медицинского применения
По результатам оценки критериев (характеристик), на основании
которых определяется взаимозаменяемость лекарственных препаратов,
лекарственный препарат признан___________________________________________
(взаимозаменяемым или не взаимозаменяемым)
(референтным (иным воспроизведенным) лекарственным препаратом)
Взаимозаменяемость определена с указанием на исключение следующих
отдельных групп пациентов:_______________________________________________
Комиссия экспертов в составе:
председатель комиссии экспертов
(должность) (ф.и.о.) (подпись)
(должность) (ф.и.о.) (подпись)
(должность) (ф.и.о.) (подпись)
Дата оформления заключения «___»_______________ 20__ г.
Обзор документа
Правительство установило новые правила определения взаимозаменяемости лекарственных препаратов.
Взаимозаменяемость определяется на основе заключения комиссии экспертов федерального экспертного учреждения. Установлена форма заключения. Прописаны критерии определения взаимозаменяемости, в том числе для отдельных видов препаратов.
Перечень взаимозаменяемых препаратов размещается на сайте Минздрава и ежемесячно обновляется.
Заключение комиссии может быть обжаловано держателем или владельцем регистрационного удостоверения лекарственного препарата.
Постановление вступает в силу со дня его официального опубликования.
© ООО «НПП «ГАРАНТ-СЕРВИС», 2021. Система ГАРАНТ выпускается с 1990 года. Компания «Гарант» и ее партнеры являются участниками Российской ассоциации правовой информации ГАРАНТ.
Все права на материалы сайта ГАРАНТ.РУ принадлежат ООО «НПП «ГАРАНТ-СЕРВИС». Полное или частичное воспроизведение материалов возможно только по письменному разрешению правообладателя. Правила использования портала.
Портал ГАРАНТ.РУ зарегистрирован в качестве сетевого издания Федеральной службой по надзору в сфере связи,
информационных технологий и массовых коммуникаций (Роскомнадзором), Эл № ФС77-58365 от 18 июня 2014 года.
ООО «НПП «ГАРАНТ-СЕРВИС», 119234, г. Москва, ул. Ленинские горы, д. 1, стр. 77, info@garant.ru.
8-800-200-88-88
(бесплатный междугородный звонок)
Редакция: +7 (495) 647-62-38 (доб. 3145), editor@garant.ru
Отдел рекламы: +7 (495) 647-62-38 (доб. 3136), adv@garant.ru. Реклама на портале. Медиакит
Если вы заметили опечатку в тексте,
выделите ее и нажмите Ctrl+Enter
Источник



(1).jpg)



