- Позиция ФАС России о взаимозаменяемости лекарственных средств
- Как работать с перечнем взаимозаменяемых лекарств по 44-ФЗ
- Когда используют взаимозаменяемость лекарств по 44-ФЗ
- Где найти перечень взаимозаменяемых лекарств
- Как с ним работать
- Когда отсутствие ссылки на эквиваленты обосновано
- Взаимозаменяемость лекарственных препаратов: что это и как применять по 44-ФЗ
- Как определяют взаимозаменяемость
- Как используют в закупках
- Как используют специальный перечень
Позиция ФАС России о взаимозаменяемости лекарственных средств
Позиция ФАС России о взаимозаменяемости лекарственных средств
при осуществлении государственных и муниципальных закупок
Управление Федеральной антимонопольной службы по Кемеровской области сообщает о позиции Федеральной антимонопольной службы по вопросу взаимозаменяемости лекарственных препаратов для парентерального введения, имеющих международное непатентованное наименование (далее – МНН) «Интерферон альфа 2b» при осуществлении закупок для обеспечения государственных и муниципальных нужд.
«Согласно пункту 3 статьи 4 Федерального закона от 26.07.2006 № 135-ФЗ «О защите конкуренции» под взаимозаменяемыми товарами понимаются товары, которые могут быть сравнимы по их функциональному назначению, применению, качественным и техническим характеристикам, цене и другим параметрам таким образом, что приобретатель действительно заменяет или готов заменить один товар другим при потреблении.
Оборот лекарственных средств на территории Российской Федерации регулируется Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (далее — Закон об обращении лекарственных средств), согласно части 1 статьи 13 которого лекарственные препараты вводятся в гражданский оборот на территории Российской Федерации, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти. Следовательно, лекарственный препарат, зарегистрированный в соответствии с законодательством Российской Федерации, является товаром в контексте антимонопольного законодательства.
Кроме того, в соответствии со статьей 61 Закона об обращении лекарственных средств аналогичными лекарственными препаратами являются лекарственные препараты с одинаковыми МНН, одинаковыми лекарственными формами и одинаковыми дозировками. Следовательно, лекарственные препараты с одинаковыми МНН, одинаковыми лекарственными формами, одинаковыми дозировками и разными торговыми наименованиями следует относить к аналогичным лекарственным препаратам.
В связи с тем, что фармацевтические свойства лекарственного препарата являются его качественными характеристиками и определяют выбор потребителя, аналогичные по МНН, лекарственной форме и дозировке лекарственные препараты следует относить к взаимозаменяемым лекарственным препаратам.
Вместе с тем согласно пункту 5 статьи 4 Закона об обращении лекарственных средств, под лекарственной формой понимается состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта. Следовательно, различные (по наименованию) лекарственные формы, соответствующие одному способу введения и применения и обеспечивающие достижение необходимого лечебного эффекта, следует относить к взаимозаменяемым лекарственным формам. Так, например, лекарственные препараты для парентерального (внутривенного, внутримышечного, подкожного) введения в лекарственных формах «лиофилизат для приготовления раствора», «порошок для приготовления раствора», «концентрат для приготовления раствора», «раствор», «лиофилизат для приготовления суспензии», «порошок для приготовления суспензии» и «суспензия» взаимозаменяемы. Лиофилизаты, порошки и концентраты требуют предварительного разведения растворителем. Поскольку в организм человека парентеральным путем вводится не лиофилизат (порошок, концентрат), а раствор (суспензия), различия таких лекарственных форм не отражаются на терапевтическом воздействии и способе введения лекарственных препаратов в организм пациента. Требования заказчика о поставке лекарственного препарата в лекарственной форме «раствор» или «суспензия» в связи с необходимостью дополнительного разведения лиофилизата, порошка или концентрата являются необоснованными, поскольку удобство применения лекарственного препарата для медицинского персонала не связано с терапевтической эффективностью препарата. Исключением может быть поставка лекарственных препаратов для парентерального введения в шприц-ручках, шприц-тюбиках, преднаполненных шприцах и аналогичных устройствах введения, используемых непосредственно пациентами вне медицинских организаций.
Различные дозировки лекарственных препаратов также следует считать взаимозаменяемыми, если существует возможность их кратного сопоставления. Например, одну таблетку с дозировкой действующего вещества 100 мг, можно заменить двумя таблетками аналогичного лекарственного препарата с дозировкой по 50 мг.
Таким образом, лекарственные препараты с одинаковыми МНН, взаимозаменяемыми лекарственными формами, взаимозаменяемыми дозировками и разными торговыми наименованиями следует относить к взаимозаменяемым лекарственным препаратам, за исключением случаев индивидуальной непереносимости конкретными пациентами.
Выбор способа введения лекарственного препарата зависит от ожидаемого эффекта и должен определяться лечащим врачом. Форма выпуска лекарственных препаратов для парентерального введения (ампулы, флаконы, шприцы) не влияет на их функциональные и терапевтические свойства.
Способы введения лекарственных препаратов с МНН «Интерферон альфа-2Ь» не влияют на их функциональные и терапевтические свойства, в связи с чем возможна их взаимозаменяемость. Способ упаковки (ампулы, флаконы, шприцы) лекарственных препаратов с МНН «Интерферон альфа-2Ь» также не влияет на функциональные и терапевтические свойства лекарственных препаратов, при условии их применения медперсоналом в лечебно-профилактических учреждениях. Форма выпуска «предварительно заполненные шприцы» может указываться в техническом задании аукционной документации только в случае, когда лекарственный препарат «Интерферон альфа-2Ь» закупается для пациентов, которым по решению врача разрешено самостоятельное подкожное введение препарата для продолжения подобранного режима терапии.
В связи с изложенным ФАС России сообщает, что при осуществлении закупок лекарственных препаратов с МНН «Интерферон альфа 2Ь» установление государственными и муниципальными заказчиками требований:
— к лекарственной форме (например, «раствор для инъекций», «лиофилизат для приготовления раствора») без возможности поставки эквивалента;
— к форме выпуска «предварительно заполненные шприцы», если такое требование не обусловлено закупкой лекарственного препарата для конкретных пациентов, которым по решению врача разрешено самостоятельное подкожное введение препарата;
— к подкожному способу введения,
а также иных требований к техническим характеристикам, которые не влияют на терапевтические свойства лекарственных препаратов (форма и материал упаковки, количество единиц лекарственного препарата в упаковке, объем наполнения флаконов, наличие дополнительных устройств (адаптеров) введения лекарственных препаратов), без возможности поставки эквивалента, может приводить к ограничению конкуренции и необоснованному ограничению числа участников закупок.
Источник
Как работать с перечнем взаимозаменяемых лекарств по 44-ФЗ
Взаимозаменяемость лекарственных средств — это характеристика, которая отражает терапевтическую эквивалентность или биоэквивалентность для референтного лекарства. С 30 июня заработал перечень взаимозаменяемых лекарств. Используйте его в госзакупках.
| Скачать письмо Минздрава №18-2/И/2-8895 от 25.06.2020 о разъяснении порядка применения сведений о взаимозаменяемости лекарств из КонсультантПлюс |
Когда используют взаимозаменяемость лекарств по 44-ФЗ
При подготовке тендерной документации на закупку медикаментов, заказчик указывает:
- международное непатентованное наименование (МНН);
- лекарственную форму с учетом эквивалентов;
- дозировку с учетом взаимозаменяемых медикаментов;
- количество (объем) товара, который подлежит поставке;
- остаточный срок годности.
Минздрав в письме №3175/25-2 от 17.12.2019 об особенностях осуществления закупок лекарственных препаратов разъясняет, что взаимозаменяемость медикаментов устанавливают на основании ст. 27.1 ФЗ №61 «Об обращении лекарственных средств» от 12.04.2010 и правил, которые утверждены ПП №1154 от 28.10.2015.
Новые правила, по которым определяют эквивалентность медикаментов, включены в проект постановления «Об утверждении Правил определения взаимозаменяемости лекарственных препаратов» (№ проекта 01/01/05-20/00101700).
Взаимозаменяемость определяется исходя из ст. 27.1 61-ФЗ:
- эквивалентности качественных и количественных характеристик лекарства;
- формы выпуска;
- сопоставимости вспомогательных веществ, которые входят в состав;
- способа применения;
- соответствия производителя обязательным требованиям.
Поправки в 61-ФЗ, которые вступили в силу 1 марта, обязали Минздрав включить взаимозаменяемые лекарства в сводный перечень на основании заключения экспертной комиссии и разместить документ для всеобщего ознакомления на официальном сайте ГРЛС не позднее 1 июля (475-ФЗ от 27.12.2019 г.).
Также информация о эквивалентах присутствует в справочнике ЕСКЛП.
Где найти перечень взаимозаменяемых лекарств
30 июня Минздрав разместил реестр на сайте Государственного реестра лекарственных средств. Документ включает в себя медикаменты, эквивалентность которых доказана. Рассказываем, как его найти:
Шаг 1. Открыть сайт ГРЛС.
Шаг 2. На главной странице выбрать сообщение о публикации реестра.
Шаг 3. Открыть или скачать документ, который приложен к информационному сообщению.
На сегодняшний день в перечне присутствует более ста медикаментов из нескольких тысяч, которые зарегистрированы и присутствуют на российском рынке. В поправках в 61-ФЗ сказано, что экспертный орган определяет взаимозаменяемость лекарственных форм (если это не сделано ранее) вплоть до 1 января 2021 года (475-ФЗ). Если зарегистрировано новое лекарство — эксперты определяют референтный препарат и вносят данные в реестр.
Как с ним работать
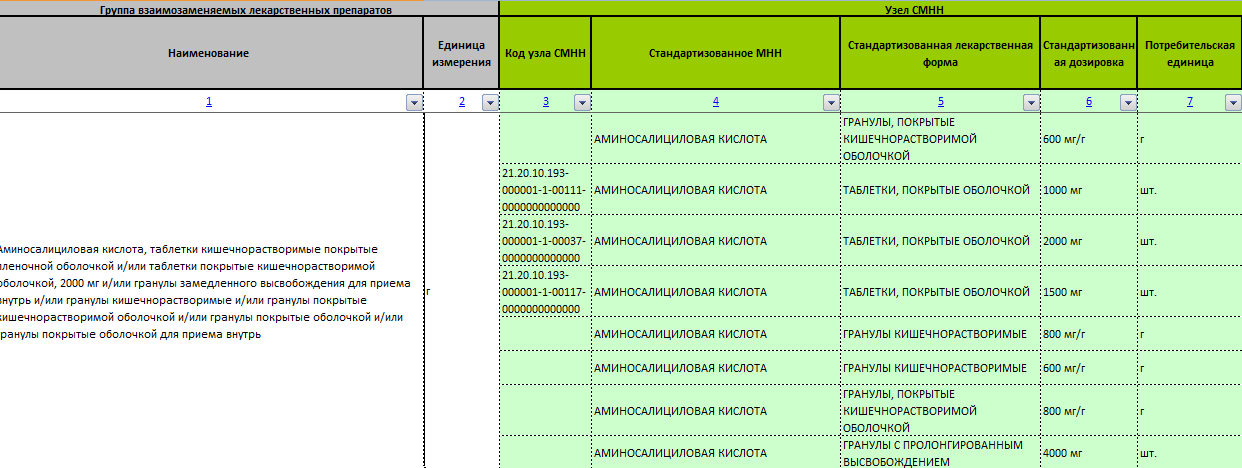
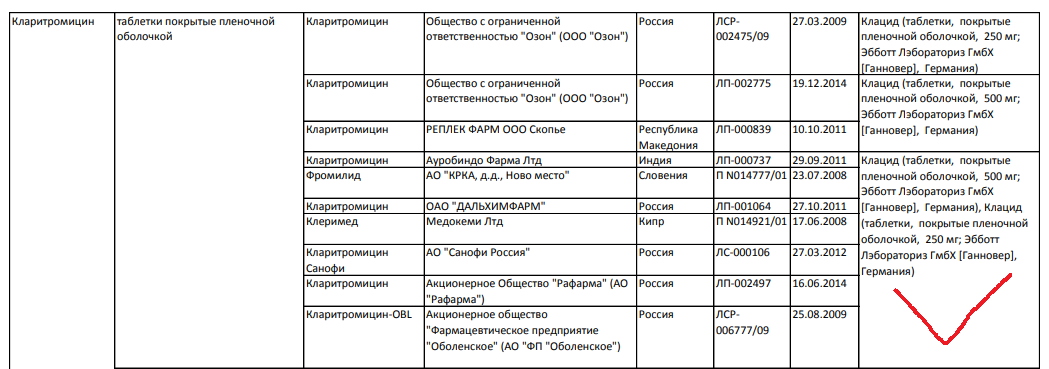
Перечень представляет из себя список медикаментов в виде таблицы, в котором указаны:
- международное непатентованное наименование (МНН);
- лекарственная форма;
- торговое название;
- владелец РУ;
- страна владельца РУ;
- номер регистрационного удостоверения;
- дата регистрации;
- фармацевтическая взаимозаменяемость.
Рассказываем, как работать с реестром:
Шаг 1. Открываем перечень.
Шаг 2. Находим необходимый медикамент.
Шаг 3. В графе «Референтные лекарственные препараты» смотрим название лекарства, которое является эквивалентом.
Шаг 4. Вносим информацию в техническое задание на закупку.
Когда отсутствие ссылки на эквиваленты обосновано
Практика показывает, что в исключительных случаях заказчик вправе не ссылаться в тендерной документации на все возможные эквиваленты. В качестве обоснования послужат выдержки из инструкций медикаментов, необходимость обеспечить безопасность персонала, обеспечение совместимости с оборудованием, которое уже закуплено и взаимозаменяемость ЛС.
Пример №1: заказчик доказал, что закупка препарата «Филграстим» с устройством безопасной иглы, которое защищает медицинский персонал от повреждений, необходима. В обосновании учреждение сослалось на то, что предупредить заражение персонала от пациентов тяжелыми и неизлечимыми вирусами и инфекциями (в том числе и ВИЧ) — неотъемлемая часть работы. ФАС встал на сторону заказчика при том, что учреждение требовало к поставке не все эквиваленты.
Пример №2: заказчик указал в тендерной документации не все эквивалентные формы лекарства. При рассмотрении жалобы в ФАС учреждение доказало, что это решение продиктовано необходимостью — инструкция к той форме, которая не требовалась к поставке, содержала иные показания к использованию.
Пример №3: заказчик закупил препарат в той форме выпуска, которая требовалась для взаимодействия с используемым оборудованием. К обоснованию приложил информацию от производителя. Территориальное управление ФАС поддержало заказчика. Через некоторое время ФАС выпустил письмо № ИА/23540/18 от 05.04.2018, в котором разъяснил, что отличия в форме выпуска не являются определяющими.
Прописывая в техническом задании определенную форму выпуска или препарат, учитывайте, что позиция ФАС меняется. Принятые ранее решения — не гарант того, что закупка обоснована.
Опыт работы в сфере госзаказа более 10 лет (скорая помощь, театр им. Н.П. Акимова, Биржа — торги для Газпрома, Транснефти). Высшее образование по специальности «Финансы и кредит» (Университет при МА ЕВРАЗЭС), дипломированный эксперт по госзакупкам.
Источник
Взаимозаменяемость лекарственных препаратов: что это и как применять по 44-ФЗ
Взаимозаменяемость лекарственных средств — это способность препаратов оказывать одинаковый терапевтических эффект, что позволяет заменять их в клинической практике. Для целей 44-ФЗ заказчик использует его при описании объекта закупки в рамках одного международного непатентованного наименования.
Как определяют взаимозаменяемость
В соответствии с ч. 2 ст. 27.1 закона №61-ФЗ взаимозаменяемость ЛС (лекарственных средств) определяется в процессе их регистрации экспертным советом уполномоченного федерального органа ФГБУ «НЦЭСМП» Минздрава. Эксперты проводят клинические исследования на основании определенных критериев. Критериями являются:
- эквивалентность действующих веществ;
- эквивалентность лекарственной формы;
- сопоставимость вспомогательных веществ;
- идентичность способа введения и применения;
- соответствие производителя требованиям надлежащей производственной практики.
В результате определения взаимозаменяемости лекарственных препаратов экспертная группа выдает заключение. В нем препарату присваивается одна из групп:
- взаимозаменяемый;
- невзаимозаменяемый;
- заменяемость установить невозможно (например, при отсутствии клинических исследований с референтным препаратом);
- взаимозаменяемый, за исключением применения у отдельных групп пациентов;
- не подлежит определению заменяемости.
Как используют в закупках
При описании объекта закупки в соответствии с постановлением правительства №1380 от 15.11.2017 заказчик указывает:
- лекарственную форму лекарства, включая эквивалентные;
- дозировку лекарства с возможностью поставки кратной дозировки и двойного количества.
В соответствии с письмом Минздрава №18-2/И/2-8895 от 25.06.2020 заказчик при подготовке описания средства вправе пользоваться справочником ЕСКЛП. Подробнее: «Инструкция по работе с новым справочником ЕСКЛП от Минздрава».
В каталоге содержится информация о группах лекарств, которые объединяются по принципам эквивалентности форм и кратности дозировок.
Как используют специальный перечень
Группы взаимозаменяемых препаратов формируются в специальный перечень, который размещается на официальном сайте Минздрава до 01.07.2020.
Актуальный на 29.06.2020 перечень находится на главной странице ГРЛС.
В перечне содержится информация о фармацевтической взаимозаменяемости воспроизведенных и референтных препаратов, которую заказчик использует при описании объекта закупки.
Даже если информация об эквивалентности в ЕСКЛП отсутствует, заказчик в рамках конкретного МНН анализирует инструкции по применению различных средств и выбирает эквивалентные формы и дозировки, которые удовлетворяют его потребности.
Источник