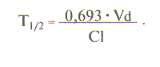- Выведение с желчью
- Выведение с молоком
- Моделирование фармакокинетических процессов
- Холестаз: симптомы и лечение холестатического синдрома
- Распространенность и особенности холестаза
- Причины и виды холестатического синдрома
- Проявления застоя желчи
- Холестаз у беременных женщин и детей
- Диагностика патологии
- Лечение холестаза
Выведение с желчью
Из печени лекарственные вещества в виде метаболитов или в неизмененном виде пассивно или с помощью активных транспортных систем поступают в желчь. В дальнейшем лекарственные препараты или их метаболиты выводятся из организма с калом. Под влиянием ферментов желудочно-кишечного тракта или бактериальной микрофлоры они могут превращаться в другие соединения, которые реабсорбируются и вновь доставляются в печень, где претерпевают новый цикл метаболических превращений. Подобный цикл носит название энтерогепатической циркуляции. На выведение лекарственных средств с желчью влияют молекулярная масса соединений, их химическая природа, состояние гепатоцитов и желчевыводящих путей, интенсивность связывания препаратов с клетками печени.
Печеночный клиренс препаратов можно определить при исследовании дуоденального содержимого, полученного с помощью зонда. Степень выведения лекарственных веществ с желчью особенно важно учитывать при лечении больных с печеночной недостаточностью, а также воспалительными заболеваниями желчных путей.
Выведение с молоком
Многие лекарственные вещества могут выводиться с грудным молоком. Как правило, концентрация лекарственных средств в молоке матери слишком мала для того, чтобы оказать действие на новорожденного. Однако в некоторых случаях количество поглощаемого с молоком лекарственного средства может представлять опасность для ребенка.
Реакция грудного молока несколько более кислая (рН7), чем плазмы крови, поэтому вещества со свойствами слабых оснований, которые становятся более ионизированными при уменьшении рН, могут быть обнаружены в молоке в концентрациях, равных или более высоких, чем в плазме крови. Препараты, не являющиеся электролитами, легко проникают в молоко независимо от рН среды.
Сведений о безопасности для новорожденных многих лекарственных средств не имеется, поэтому фармакотерапию у кормящих женщин следует проводить крайне осторожно.
Моделирование фармакокинетических процессов
При фармакокинетическом изучении лекарственного средства измеряют его концентрацию в биологических средах (кровь, моча, слизь и т.д.) в определенные моменты времени. Частота и продолжительность забора биологических проб зависит от продолжительности пребывания лекарственного вещества или его метаболитов в организме. Концентрацию препаратов определяют с помощью жидкостной или газожидкостной хроматографии, радиоиммунного или ферментно-химического анализа, полярографии, спектрофотометрии и т.д. На основании полученных данных строится график, по оси абсцисс которого откладывают время, а по оси ординат — концентрацию лекарственного вещества в биологической пробе (наиболее часто в плазме крови) в соответствующих единицах. Кривая “концентрация — время” характеризует фармакокинетические процессы, происходящие с исследуемым препаратом
Для математического моделирования фармакокинетических процессов организм представляют в виде одной или нескольких частей (камер), ограниченных проницаемой мембраной, в которых равномерно распределяется лекарственное средство. Понятие “камера” условно, так как за ним не стоит какое-либо анатомически ограниченное пространство; это только единица формализованной фармакокинетической системы.
Наиболее простой фармакокинетической моделью является однокамерная модель, при которой организм представляется в виде единой гомогенной камеры. Эта модель пригодна для анализа концентрации препарата в крови, плазме и сыворотке, а также для анализа концентрации в моче лекарственных средств, которые быстро распределяются между плазмой крови и другими жидкостями и тканями организма. Динамика концентрации лекарственного вещества в крови при использовании однокамерной модели представлена.- Данная модель предполагает, что любые изменения концентрации лекарственного средства в плазме отражают изменения его содержания в тканях. Распределение препаратов в однокамерной модели происходит быстро, вследствие чего вскоре устанавливается стационарное состояние, т.е. устойчивое динамическое равновесие между поступлением препарата в кровь и выходом из нее. Однако многие лекарственные вещества поступают в ткани и выходят из них очень медленно. Кроме того, согласно однокамерной модели скорость выведения препарата из организма постоянна и характеризуется константой выведения, или элиминации (Кel). Эта константа служит для количественной оценки скорости выведения препарата из организма и численно равна тангенсу угла наклона полулогарифмической кривой к оси абсцисс. Скорость снижения концентрации большинства лекарственных средств пропорциональна их концентрации. Поэтому кинетические данные, полученные при математических расчетах однокамерной модели, для многих лекарственных веществ не соответствуют истине.
Более приемлемы двух- и трехкамерные модели. За центральную (обычно меньшую) камеру

В фармакокинетических исследованиях указанные модели используются для оценки изменений концентрации лекарственного средства во времени в специфической камере, где проявляется желаемое терапевтическое действие препарата.
Важным фактором, влияющим на концентрацию лекарственных веществ, является их выведение из организма, или элиминация. Показателем элиминации является клиренс (мл/мин). Общий клиренс — объем плазмы крови, который очищается от препарата за единицу времени за счет выведения почками, печенью и др. Общий клиренс представляет собой сумму почечного и печеночного клиренса. Под печеночным клиренсом подразумевается метаболический клиренс в печени и выведение препарата с желчью. Например, почечный клиренс циметидина составляет около 600 мл/мин, метаболический в печени — 200 мл/мин и желчный — 10 мл/мин, следовательно, общий клиренс равен 810 мл/мин. Другие пути выведения, или внепочечный метаболизм, не имеют существенного значения и при расчете общего клиренса во внимание обычно не принимаются.
Основными физиологическими факторами, определяющими клиренс, являются функциональное состояние печени, объем притока крови, скорость печеночного кровотока и функциональная способность соответствующих ферментов. Например, клиренс лидокаина, который интенсивно метаболизируется ферментами печени, зависит прежде всего от скорости его доставки к печени, т.е. от объема притекающей крови, скорости кровотока. Поэтому при снижении печеночного кровотока в результате застойной сердечной недостаточности клиренс лидокаина снижается.
В то же время клиренс фенотиазинов зависит в основном от функционального состояния ферментов. Поэтому при поражении гепатоцитов клиренс фенотиазинов резко снижается; естественно, их концентрация в крови при этом значительно возрастает.
Для определения клиренса используют формулу:

В клинических условиях клиренс служит для расчета дозы, необходимой для поддержания равновесной концентрации препарата в крови, т.е. поддерживающей дозы: Cl•Css, где Css — равновесная концентрация.
Объем распределения лекарственного вещества (Vd) — гипотетический объем жидкостей организма, необходимый для равномерного распределения всего количества данного вещества в концентрации, равной его концентрации в плазме крови. Объем распределения зависит от физико-химических свойств препарата (молекулярная масса, уровень ионизации и полярности, растворимость в воде и жирах), которые влияют на его прохождение через мембраны, возраста, пола больного, общего количества жиров в организме. Например, у пожилых людей и новорожденных объем распределения снижен. Кроме того, объем распределения изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек, сердечно-сосудистой системы и т.д.
В клинической практике объем распределения служит для расчета нагрузочной дозы препарата, требуемой для достижения его необходимой концентрации в крови: D=Vd•C, где D — доза, Vd — объем распределения и С — необходимая концентрация. Определяется объем распределения по формуле:
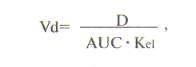
О выведении лекарственных средств из организма судят по периоду полувыведения (Т1/2). За один период из организма выводится 50% лекарственного средства, за два — 75%, за три — 90%. Период полувыведения препарата зависит от объема распределения и клиренса:
Т1/2 не является точным показателем, характеризующим выведение лекарственного средства. Например, при сердечной недостаточности объем распределения лидокаина снижается в результате его плохого проникновения в ткани. Клиренс лидокаина также уменьшается за счет снижения почечного кровотока. В результате Т1/2 изменяется незначительно. Если ориентироваться при дозировании лидокаина на полученное значение, то концентрация препарата в крови окажется токсической. В связи с этим оптимальным показателем выведения лекарственного средства остается клиренс, а Т1/2 служит главным образом для определения промежутка времени, необходимого для достижения равновесной концентрации лекарственного средства в крови (это обычно 3-5 периодов полувыведения препарата).
На практике при расчете интервала времени до создания равновесной концентрации лекарственного вещества в крови следует ориентироваться на Т1/2 этого препарата у данного больного, а не на среднее значение Т1/2. Это связано с тем, что Т1/2 варьирует в широких пределах при различных заболеваниях, а также зависит от возраста. У детей Т1/2 препаратов, как правило, увеличен по сравнению с таковыми у взрослых, поэтому следует увеличить интервал между приемом препарата или уменьшить его дозу.
Равновесная концентрация устанавливается, когда количество абсорбирующегося и количество вводимого препарата равны. В результате концентрация лекарственного средства колеблется в определенных пределах между максимальными и минимальными значениями концентрации препарата 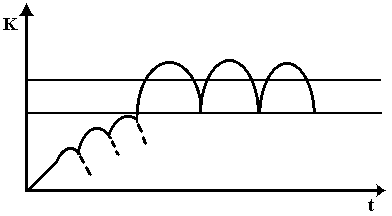
На практике равновесную концентрацию лекарственного средства можно вычислить по концентрации данного препарата после однократного введения:
где t — интервал времени от момента введения препарата до взятия пробы, F — биодоступность препарата. Другие обозначения см. выше.
Если вместо константы элиминации использовать период полувыведения, то уравнение приобретает следующий вид:
Источник
Холестаз: симптомы и лечение холестатического синдрома
Холестаз – клинико-лабораторный синдром, при котором нарушена выработка желчи или полностью либо частично блокирован ее отток в двенадцатиперстную кишку.
Состояние может быть вызвано различными заболеваниями. Оно характеризуется накоплением в крови выводимых с желчью веществ, что сопровождается кожным зудом, слабостью, желтухой и другими проявлениями.
Диагностика патологии основана преимущественно на данных анализов, а также инструментальных методов исследования.
Лечение холестатического синдрома включает прием медикаментов, диету и в ряде случаев хирургическое вмешательство на органах печени и желчевыводящих путей.
Распространенность и особенности холестаза
По данным статистики, этой патологией страдает 1 человек на 10 тысяч населения планеты в год. При этом около 50-70% людей с заболеваниями печени и желчных путей (даже пролеченных ранее) может столкнуться в той или иной степени с холестазом в разные периоды жизни.
Большая часть заболевших мужского пола, в возрасте старше 40 лет. Среди беременных женщин состояние выявляется от 0,2 до 27% среди обследованных, в зависимости от региона и дополнительных заболеваний и состояний.
Проявления синдрома холестаза имеют следующие механизмы:
- попадание компонентов желчи в кровоток;
- отсутствие или недостаточное количество секрета в кишечнике, что нарушает пищеварение (желчь участвует в переваривании пищи);
- застой и обратный ток жидкости по желчевыводящим путям.
Причины и виды холестатического синдрома
Существует две основные формы патологии – внепеченочная и внутрипеченочная. Первая развивается в случае полной или частичной закупорки желчных протоков, чаще всего камнями при желчнокаменной болезни и холедохолитиазе, а также при опухоли органов гепатобилиарной системы, дисфункции сфинктера Одди, описторхоза, врожденных аномалий желчевыводящих путей.
Внутрипеченочный холестаз – следствие заболеваний гепатоцеллюлярной системы, таких как гепатиты вирусного, алкогольного и медикаментозного происхождения, жировая болезнь печени (довольно частая патология современного человека, поражающая до 20% людей и более, в зависимости от возраста и массы тела) и ее аутоиммунные поражения, дефекты внутрипеченочных протоков.
Среди частых причин патологии также врожденные метаболические нарушения (галактоземия, муковисцидоз и другие), саркоидоз, изменения гормонального фона, например, при беременности.
Клинически холестатический синдром может проявляться в безжелтушной и желтушной формах, а также иметь острое или хроническое течение. Существуют три типа нарушений:
- Парциальный холестаз – уменьшена секреция желчи.
- Диссоцианный холестаз – задержка отдельных компонентов желчи.
- Тотальный холестаз – характерны выраженные нарушения поступления желчи в кишечник.
Проявления застоя желчи
Холестаз у беременных женщин и детей
Отдельного внимания заслуживают такие формы патологии, как холестаз во время вынашивания плода и в детском возрасте. В этих случаях механизм развития нарушений и симптомы имеют свои особенности.
Проявления холестаза у беременных наблюдаются в третьем триместре. Кожный зуд может быть ярко выраженным или практически не доставлять дискомфорта. Расчесы чаще отмечаются на руках, голенях, предплечьях. Желтуха встречается лишь у одной из десяти женщин и, как правило, проходит самостоятельно через две недели после родов. Однако при выраженной желтухе и раннем начале (до 25-27-й недели беременности) может повышать риск осложнений в родах.
Детский холестаз может наблюдаться как с первых месяцев жизни, так и появиться в более старшем возрасте. В младенчестве чаще встречаются внутрипеченочный холестатический синдром, вызванный врожденными метаболическими нарушениями, идиопатический неонатальный гепатит и пороки развития желчных протоков. Причинами холестаза могут быть также инфекции, токсические поражения органов, цирроз печени, сердечно-сосудистая недостаточность, опухоли поджелудочной железы, паразитарные поражения, склерозирующий холангит.
Опасность холестаза в том, что он развивается у детей в скрытой форме. Симптоматика зависит от возраста, в котором проявилось заболевание, и особенностей организма.
Диагностика патологии
Диагностику и лечение синдрома холестаза проводит врач-гастроэнтеролог. Некоторые пациенты ошибочно консультируются с дерматологом, акцентируя внимание только на кожном зуде и не принимая во внимание прочие симптомы.
Заподозрить патологию врачу позволяют беседа с больным, внешний осмотр кожи и слизистых пациента. Пальпация и перкуссия часто позволяют выявить увеличение печени в размерах, болезненные области. Нередко холестатический синдром протекает почти бессимптомно, и на его наличие указывают только лабораторные анализы. Они заключаются в определении уровня билирубина, холестерина, щелочной фосфатазы, ферментов и желчных кислот в крови, желчных пигментов в моче.
Для общего анализа крови при холестазе характерны анемия, лейкоцитоз, завышенные значения СОЭ. В биохимическом анализе крови выявляются гипербилирубинемия (за счет прямого (конъюгированного) билирубина), гиперлипидемия, повышение активности ферментов, таких как аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), гаммаглутамилтранспептидаза (ГГТП). Обнаружение антимитохондриальных, антинуклеарных антител и антител к гладкомышечным клеткам позволяет заподозрить аутоиммунное поражение печени как возможную причину холестаза.
Инструментальная диагностика холестаза предполагает ультразвуковое и рентгеновское исследования органов брюшной полости, гастро- и дуоденоскопию, магнитно-резонансную или эндоскопическую ретроградную холангиопанкреатографию, чрескожную чреспеченочную холангиографию. Диагноз может быть установлен на любом этапе, даже просто после выполнения лабораторных анализов и УЗИ, не все вышеперечисленные исследования обязательно потребуются для диагностики.
Если результаты проведенных обследований сомнительны, то прибегают к биопсии печени (которая также может быть назначена на любом этапе диагностического поиска).
Лечение холестаза
Первая мера при выявлении холестаза или подозрении на него – коррекция питания. Особенностью такой диеты является замена животных жиров на растительные. Рекомендуется употреблять больше овощей и фруктов, выбирать нежирные сорта мяса и виды молочных продуктов. Полезны также каши на основе злаковых культур. Нужно ограничить жареные, копченые и острые продукты. Следует полностью отказаться от спиртного, крепкого кофе и чая.
Для лечения холестаза могут быть назначены лекарственные препараты разных групп:
- гепатопротекторы;
- антибиотики;
- цитостатики;
- препараты урсодезоксихолевой кислоты.
При признаках гиповитаминоза рекомендованы также поливитаминные комплексы. В борьбе с кожным зудом препаратами первой линии являются производные желчных кислот, связывающие в просвете желчные кислоты из желчи и препятствующие их транспорту в кровтоток. Доказана эффективность блокаторов опиатных рецепторов ЦНС. В реабилитационном периоде применяют немедикаментозные методы для повышения защитных сил организма – физиопроцедуры, массаж, лечебная физкультура.
Лечение беременных осложняется рисками для плода при применении лекарств, потому для уменьшения симптоматики прибегают в первую очередь к простым и безопасным средствам – маски из овсяных хлопьев, отвар ромашки, использованию детского крема.
Холодная вода и сон в прохладном помещении облегчают кожный зуд. Однако при его усилении врачом могут быть назначены препараты желчных кислот, разрешенные к применению у беременных (в частности – урсодезоксихолевая кислота). Эти препараты определены американской Food and Drug Administration (FDA) на основании проведенных клинических исследований. Препараты, по которым накоплено достаточно данных о применении их у беременных, отнесены данной организацией к соответствующей группе (категории действия на плод).
Для успешного лечения холестаза у детей важно своевременно установить причину данного синдрома. Часто одними лекарствами патологию у этой группы больных не вылечить, тогда проводят хирургическую операцию.
У взрослых также нередко требуется оперативное вмешательство, купирующее причины развития холестаза. Возможно несколько способов хирургического лечения:
- пластика желчевыводящих путей и наложение анастомозов;
- внешнее дренирование желчных протоков;
- удаление камней из полости желчного пузыря или самого органа.
Источник