- Выведение (экскреция) лекарственных веществ из организма
- Как устроена система детоксикации?
- Экскреция (выведение) лекарственных средств
- Содержание
- Экскреция (выведение) лекарственных средств [ править | править код ]
- Выведение с мочой [ править | править код ]
- Выведение с желчью и калом [ править | править код ]
- Другие пути выведения [ править | править код ]
- Пресистемное выведение [ править | править код ]
- ЭКСКРЕЦИЯ ЛЕКАРСТВ [ править | править код ]
- Экскреция через почки [ править | править код ]
- Экскреция через желудочно-кишечный тракт [ править | править код ]
- Экскреция через легкие [ править | править код ]
Выведение (экскреция) лекарственных веществ из организма
Лекарственные вещества и их метаболиты выводятся из организма различными путями :
через печень (с желчными кислотами);
через кишечник с калом;
с молоком матери;
через слюнные, сальные, потовые железы.
Почкиявляются основным органом, выводящим из организма ЛС и их метаболиты. Основными механизмами экскреции ЛС в почках служат :
При клубочковой фильтрациив клубочках почек фильтруется вода и низкомолекулярные ЛС с молекулярной массой ниже 50000. Так как молекулярная масса большинства ЛС не превышает 10000, то из организма выводится подавляющая часть ЛС. Фракции лекарств, связанные в крови с белками, не фильтруются (молекулярная масса белков превышает 65000–70000). Физиологическая основа фильтрации заключается в разности гидростатического давления между сосудами клубочка и полостью капсулы почечного клубочка.
Канальцевая реабсорбцияпроисходит в дистальных участках почечных канальцев по принципу пассивной диффузии, поэтому реабсорбируются только недиссоциированные липидотропные молекулы слабых кислот и оснований. Степень реабсорбции лекарств зависит от рН мочи (в норме колеблется от 4 до 8). Отсюда создается реальная возможность корректировать скорость экскреции лекарств путем изменения рН мочи, что особенно важно при появлении первых признаков передозировки и при отравлениях. Искусственно подщелачивая мочу приемом натрия бикарбоната и других щелочных соединений удается резко увеличить скорость выведения лекарств, являющихся слабыми кислотами. При отравлении лекарствами, являющимися слабыми основаниями, мочу «подкисляют» назначением хлорида аммония, аскорбиновой кислоты.
Канальцевая секрецияпредставляет собой активный энергозависимый процесс переноса веществ против градиента концентрации, осуществляемый специальными трансмембранными транспортными системами в проксимальном отделе почечных канальцев. ЛС, экскретируемые таким путем, представляют собой слабые органические кислоты (антибиотики группы пенициллина, мочегонные средства, аминокислоты) и слабые органические основания (гистамин, дофамин и др.).
Выведение лекарственных веществ и их метаболитов резко страдает у больных с недостаточностью функции почек. В подобных условиях лекарства накапливаются в организме и при обычных дозах приводят к передозировке со всеми нежелательными эффектами.
ЛС, метаболизирующиеся печенью, могут выделяться с желчью в кишечник. При этом часть ЛС элиминирует с каловыми массами, а часть реабсорбируется. Этот феномен получил названиепеченочно-кишечнойилиэнтерогепатической циркуляции. Способность печени экскретировать ЛС с желчью можно использовать и с терапевтической целью. Например, при воспалительных заболеваниях желчевыводящих путей назначают антибиотики, экскретируемые печенью в неизмененном виде (тетрациклин, эритромицин), что приводит к резкому увеличению их концентрации в желчи и реализации местного антимикробного действия.
Выведение лекарств кишечникомне имеет практического значения. Таким путем выводятся, в основном, препараты, плохо всасывающиеся в ЖКТ (некоторые антибиотики и др.). Они используются преимущественно для воздействия на микрофлору кишечника.
Через легкиеиз организма экскретируются в основном газообразные ЛС (средства для ингаляционного наркоза) и этиловый спирт.
Особое место занимает экскреция ЛС с молокомкормящей матери. Это обусловлено тем, что находящиеся в молоке ЛС, попав в организм новорожденного, могут оказать на него самое разнообразное, в том числе, и повреждающее действие.
Через слюнныежелезы экскретируются йодиды. С секретомпотовых железвыводятся противолепрозные препараты.
Биотрансформация и экскреция лекарственных веществ объединяются термином «элиминация». Наиболее значащей величиной, характеризующей элиминацию лекарства, является системный, или общий, клиренслекарственного вещества (Cl).Клиренс— это объем плазмы, полностью освобождающийся от вещества в единицу времени. Является главным параметром для управления режимом дозирования, определяется по формуле :

где Vd — объем распределения;
Kel — константа элиминации.
Для большинства лекарств клиренс — величина постоянная и его можно найти в справочниках. Он имеет большое значение для правильного дозирования, т. е. поддержания терапевтической равновесной концентрациивещества (Css) в крови. Равновесная концентрация представляет собой рассчитываемый параметр, исходя из кратности введения. Рассчитанную равновесную концентрацию сравнивают с известнымиminиmaxтерапевтическими концентрациями.
Например, при введении суточной дозы препарата в 1 прием Cssmax превышает max терапевтическую концентрацию, что неприемлемо, так как возникает опасность передозировки. Если же суточную дозу препарата разделить на 6 введений, то рассчитанная Cssmin будет находится в диапазоне между min и max терапевтическими, поэтому такой вариант введения препарата будет оптимальным.
Таким образом, данный параметр необходим для определения кратности введения препарата в сутки.
Важным параметром также является период полуэлиминации(t1/2) — это время, за которое концентрация лекарственного вещества в плазме крови уменьшается на 50%.
Фармакодинамика — это раздел общей фармакологии, изучающий особенности действия ЛС на организм. А именно фармакодинамика изучает :
механизмы действия лекарственных веществ;
конечные фармакологические эффекты;
зависимость действия ЛС от различных условий;
Источник
Как устроена система детоксикации?
Токсины, которые присутствуют в нашем организме, имеют различное происхождение. Одни поступают извне, другие образуются в ходе нормального метаболизма в организме. Основными экзогенными источниками являются воздух, которым дышит человек, потребляемая пища и вода, лекарственные препараты. По статистике более 75 000 синтетических химических веществ, среди которых — лекарственные препараты, канцерогенные вещества химической природы, пестициды и гербициды, выхлопные газы и прочее, воздействуют на организм современного человека, и все они проходят через систему детоксикации.
Продукты, которые образуются в результате пищеварения, энергетического обмена, регенерации тканей и превращений гормонов, побочные продукты жизнедеятельности микроорганизмов — составляют эндогенный пул токсинов. До 90 % веществ, образующихся внутри организма, требуют детоксикации. Это нейромедиаторы и гормоны, эйкозаноиды, жирные кислоты и ретиноиды.
В процессе филогенеза сформировалась система, которая отвечает за процесс преобразования и удаления потенциально вредных продуктов, тем самым, обеспечивая химическую резистентность и постоянство внутренней среды организма.
Система детоксикации — это слаженная работа нескольких систем сразу:
- иммунная система крови: белки и форменные элементы;
- очищающая система печени;
- система экскреторных органов: желудочно-кишечный тракт, почки, легкие, кожа.
В процессе работы происходит обезвреживание токсических веществ экзогенного и эндогенного происхождения (ксенобиотиков). На процесс преобразования или биотрансформации веществ влияет не только тип токсикантов, но и индивидуальные особенности человека. Они включают возраст, пол, наличие сопутствующих заболеваний и дефицитных состояний, генетическую предрасположенность, диетические предпочтения, факторы окружающей среды (домашняя среда и профессиональные факторы), принимаемые лекарства.
Ферменты реакций биотрансформации встречаются во многих тканях тела, но сосредоточены в печени, являющейся основным детоксицирующим органом. Другие ткани включают почки, легкие, кишечник и кожа.
Обезвреживание и выведение ксенобиотиков в организме проходит в несколько стадий:
1 стадия — обезвреживание ксенобиотика и перевод его в форму, удобную для выведения из организма.
Для этого печень переводит ксенобиотики в водорастворимые соединения, обладающие меньшей молекулярной массой. Эти вещества легче, чем исходное вещество, выводятся из организма экскреторными органами.
Метаболизм в печени протекает в две фазы с участием ферментов:
- 1 фаза. Гидроксилирование
Ферменты фазы I нейтрализуют химические вещества, преобразовывают в промежуточные соединения, которые затем обрабатываются ферментами Фазы II.
Ферментная система фазы I в основном состоит из супергенного семейства цитохрома P450 (CYP или CYP450). «P» обозначает пигмент и «450» — длина волны поглощения света. Фаза I представлена группой ферментов, представленной 50–100 ферментами цитохрома. Столь большое разнообразие обусловлено тем, что организм сталкивается с большим количеством токсинов. В дополнение к детоксикации, цитохромы принимают участие в процессах синтеза стероидов, холестерина и витамина D.
Фаза I добавляет или раскрывает реакционноспособную группу токсина, делая его более полярным, однако не полностью растворимым в воде. Образующиеся промежуточные токсины, могут быть химически активными (реактивные промежуточные метаболиты и/или активные формы кислорода) и, следовательно, более токсичными. Фаза I реакции состоит из окисления, восстановления, дегалогенирования и гидролиза. Во всех реакциях участвует кислород.
Активность цитохромных ферментов может отличаться из-за генетических полиморфизмов. С клинической точки зрения, различия могут иметь серьезные последствия при назначении фармацевтических препаратов, биологических и пищевых добавок.
Большинство токсинов должны пройти вторую фазу, чтобы их структура стала доступной для выведения вместе с мочой или желчью.
- 2 фаза. Реакция конъюгации и синтеза
Фаза детоксикации II включает 6 видов реакций:
- конъюгация с участием глютатиона;
- конъюгация с участием аминокислот;
- метилирование;
- сульфатирование;
- ацетилирование;
- глюкуронизация.
Все эти реакции требуют энергии АТФ и кофакторов для нормального протекания.
2 стадия — выведение токсина из организма через почки, печень, желудок, кишечник, легкие, потовые железы, сальные железы.
Активность ферментов, участвующих в детоксикации, либо индуцируется, либо ингибируется рядом факторов, которые включают генетику, диету, токсины окружающей среды, лекарства и состояние питания.
Некоторые вещества могут вызывать повышенную регуляцию ферментов фазы I без соответствующей повышенной активации ферментов фазы II. Если ферменты фазы I активируются или индуцируются без увеличения активности фазы II, результатом будет увеличение окислительного стресса из-за того, что промежуточные метаболиты могут быть более токсичными, чем исходное соединение, которое активировало ферменты фазы I. Примером этого являются полициклические углеводороды из сигаретного дыма, которые индуцируют CYP1A2. Другим примером является препарат фенобарбитал, который индуцирует CYP2B6.
Вещества, которые индуцируют фазу I:
- лекарственные препараты: фенобарбитал, стероиды, сульфаниламиды; никотин, алкоголь;
- продукты питания: капуста брокколи, высокобелковая диета,
- экологические токсины: выхлопные газы, пары краски, диоксиды, пестициды; мясо, приготовленное на углях;
- питательные вещества: см. список ниже.
Вещества, которые индуцируют фазу II(специфические питательные вещества для фазы II (индукторы и ингибиторы)):
- Конъюгация глутатиона — глутатион, витамин B6, ацетилцистеин. Семейство индукторов — брассика, укроп, тмин;
- Аминокислотная конъюгация — глицин. Индукторы — глицин;
- Метилирование — S-аденозил-метионин. Индукторы — липотропные питательные вещества — холин, метионин, бетаин, фолиевая кислота, витамин В12;
- Сульфатирование — цистеин, метионин, молибден. Индукторы — цистеин, метионин, таурин;
- Ацетилирование — ацетил-КоА, витамин В5;
- Глюкуронидация — глюкуроновая кислота (индукторы — рыбий жир).
Семейство Брассика (брокколи, обычная и брюссельская капуста) стимулируют фазу I и фазу II одновременно.
Ингибиторы детоксикации
Ферментные системы Фазы I и Фазы II могут быть ингибированы несколькими механизмами, которые включают лекарства, продукты питания, дефицит питательных веществ и растительные препараты. Примером пищи, вызывающей угнетение детоксикации, является грейпфрут, который подавляет CYP3A4.
Вещества, которые ингибируют Фазу I:
- лекарственные препараты: бензодиазепины левомицетин, тетурам, силибор, антигистаминные препараты, блокаторы секреции желудочного сока;
- продукты питания: грейпфрут (нарингенин), куркумин (также стимулирует фазу II);
- дисбиоз кишечника.
Вещества, которые ингибируют Фазу II:
- Конъюгация глутатиона. Ингибиторы — дефицит селена, витамина B12, цинка и глутатиона;
- Аминокислотная конъюгация. Ингибиторы — низкобелковая диета;
- Метилирование — S-аденозил-метионин. Ингибиторы — дефицит витамина B12 или фолиевой кислоты;
- Сульфатирование. Ингибиторы — НПВП, дефицит молибдена, тартразин (желтый пищевой краситель);
- Ацетилирование. Ингибиторы — дефицит витаминов В2, В5 или С;
- Глюкуронидация. Ингибиторы — пробеницид, аспирин.
Процесс детоксикации чрезвычайно сложен. Взаимодействие между Фазой I и Фазой II, а также биохимическая уникальность человека является наиболее значимыми факторами при оценке способности к детоксикации. Оптимальное здоровье требует баланса между всеми фазами процесса, а также должной работы желудочно-кишечного тракта.
Источник
Экскреция (выведение) лекарственных средств
Содержание
Экскреция (выведение) лекарственных средств [ править | править код ]
Лекарственные средства выводятся из организма в неизмененном виде или в виде метаболитов. Полярные соединения экскретируются легче, чем неполярные, жирорастворимые (исключение составляет выведение через легкие), поэтому жирорастворимые препараты сначала превращаются в более полярные метаболиты.
Основной орган, отвечающий за выведение лекарственных средств и их метаболитов, — почки. С калом выводятся невсосавшиеся в кишечнике вещества, а также препараты (и их метаболиты), которые секретируются в желчь или непосредственно в ЖКТ и затем не подвергаются повторному всасыванию. Лекарственные средства, которые выводятся с грудным молоком, могут оказать неблагоприятное действие на ребенка. Легкими выводятся в основном газообразные и летучие соединения и, в очень незначительном количестве, некоторые другие лекарственные средства и их метаболиты.
Выведение с мочой [ править | править код ]
Лекарственные средства могут фильтроваться в почечных клубочках, секретироваться в просвет канальцев и реабсорбироваться из канальцев обратно в плазму. Возрастные изменения функции почек обычно затрагивают эти физиологические процессы в равной степени. У новорожденных функция почек снижена; в течение первых месяцев жизни происходит ее быстрое становление. У пожилых функция почек может быть существенно нарушена, так как в течение жизни она постепенно снижается со скоростью примерно 1% в год.
Количество профильтровавшегося в клубочках лекарственного средства зависит от СКФ и степени связывания препарата с белками плазмы (фильтруется только свободный препарат). В проксимальных почечных канальцах лекарственные средства могут дополнительно секретироваться путем активного транспорта. В роли переносчика амфифильных анионов выступает Р-гликопротеид, а конъюгированных метаболитов (продукты конъюгации с глюкуроновой кислотой, сульфатом и глутатионом) — белок MRP2 (белок полирезистентности-2). Эти переносчики локализуются в мембране щеточной каемки апикальной поверхности эпителиальных клеток.
Сходные системы транспорта органических катионов секретируют препараты, представляющие собой органические основания. Реабсорбируются лекарственные средства главным образом путем неионной диффузии, хотя существуют и системы активного транспорта из просвета канальцев в плазму (эти системы локализуются в основном в дистальных почечных канальцах).
В неионизированной форме слабые кислоты и основания пассивно реабсорбируются в проксимальных и дистальных канальцах по концентрационному градиенту, возникающему благодаря реабсорбции воды. Ионизированные формы слабых электролитов хуже проникают через мембрану эпителиальных клеток канальцев. Таким образом, пассивная реабсорбция слабых электролитов зависит от pH мочи. При ощелачивании мочи слабые кислоты присутствуют в ней преимущественно в ионизированной форме и потому хуже реабсорбируются и в большей степени экскретируются. При закислении мочи, напротив, экскреция слабых кислот снижается. Для слабых оснований ситуация обратная. Ощелачивание и закисление мочи используют при отравлениях некоторыми лекарственными средствами для усиления их почечной экскреции. Степень влияния pH мочи на экскрецию лекарственного средства зависит от выраженности и стойкости изменения pH, а также от того, какой вклад вносит пассивная реабсорбция путем неионной диффузии (см. выше) в элиминацию препарата. Наиболее ощутимо pH мочи влияет на экскрецию слабых кислот и оснований, наполовину диссоциированных при pH от 5 до 8 (то есть в диапазоне колебаний pH мочи). Вместе с тем экскреция и относительно сильных кислот, например салицилатов, возрастает в 4—6 раз при ощелачивании мочи с pH от 6,4 до 8. Доля неионизированных салицилатов при этом уменьшается с 1 до 0,04%.
Выведение с желчью и калом [ править | править код ]
Аналогичные транспортные системы в мембране гепатоцитов активно секретируют лекарственные средства и их метаболиты в желчь. Р-гликопротеид транспортирует амфифильные и жирорастворимые препараты, а белок MRP2 — в основном конъюгированные метаболиты (продукты конъюгации с глутатионом и глюкуроновой кислотой, некоторые сульфаты). Белок MRP2 участвует также в транспорте эндогенных соединений. Врожденное отсутствие этого белка приводит к синдрому Дубина—Джонсона. Органические катионы секретируются в желчь также путем активного транспорта. В кишечник лекарственные средства и их метаболиты попадают с желчью или непосредственно из крови, так как в апикальной мембране энтероцитов тоже присутствуют белки-переносчики, транспортирующие эти вещества в просвет кишечника (например, Р-гликопротеид). Из кишечника препараты и их метаболиты могут вновь всасываться в кровь (конъюгированные метаболиты, например глюкурониды, предварительно гидролизуются кишечной микрофлорой) и возвращаться в печень. При значительном кишечно-печеночном кругообороте время действия препарата существенно увеличивается.
Другие пути выведения [ править | править код ]
Довольно большое количество лекарственного средства может выводиться с потом, со слюной и слезами. Таким путем выводятся в основном неионизированные жирорастворимые препараты, которые проходят через эпителиальные клетки потовых, слюнных и слезных желез путем диффузии. Экскреция слабых электролитов зависит от градиента pH. Лекарственные средства, которые выводятся со слюной, попадают в полость рта и обычно проглатываются. Концентрации некоторых препаратов в слюне и в сыворотке изменяются параллельно друг другу, поэтому в тех случаях, когда получить пробу крови трудно, можно ориентироваться на концентрацию лекарственного средства в слюне. То же самое справедливо и в отношении молока. Поскольку pH молока ниже, чем крови, концентрация основных веществ в молоке может быть чуть выше, чем в крови, а концентрация кислых — наоборот. Неэлектролиты (этанол, мочевина) легко проникают в молоко независимо от pH и достигают в нем той же концентрации, что и в сыворотке. Накопление лекарственных средств в волосах и коже имеет значение для судебно-медицинских исследований.
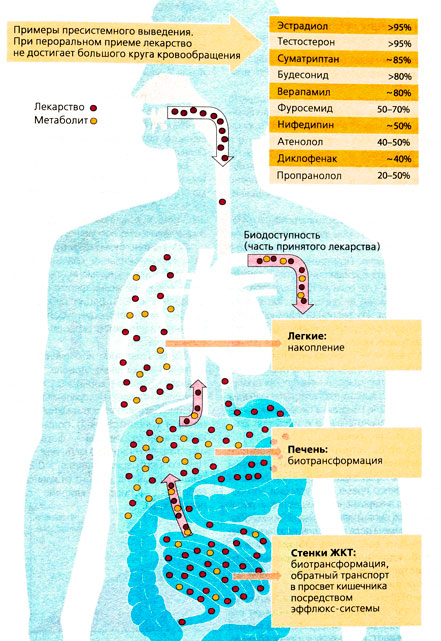
Пресистемное выведение [ править | править код ]
В зависимости от своих физико-химических свойств лекарства по-разному действуют на поверхности и внутри клеток, а также участвуют в бактериальном обмене веществ. Всегда, когда необходима системная терапия и нельзя использовать местные лекарственные средства, при обсуждении фармакокинетики надо учитывать влияние дополнительных факторов. Рассмотрим пероральный прием лекарства. Проследим «судьбу» лекарства до достижения им большого круга кровообращения.
1) Вещество проходит барьер кишечного эпителия и попадает в клетки слизистой оболочки (энтероциты), но Р-гликопротеины транспортируют его обратно. Тем самым в действительности происходит всасывание лишь небольшого количества лекарства. Прием одного и того же препарата может иметь неодинаковые последствия, так как у разных пациентов процесс всасывания протекает по-разному и зависит от приема других лекарств.
2) Действие вещества на пути от кишечника до большого круга кровообращения может быть ослаблено из-за взаимодействия с ферментами, например с цитохром оксид азой.
а) Лекарство способно разрушаться уже в кишечном эпителии. Активность цитохромоксидазы может усиливаться или блокироваться другими веществами. Например, грейпфрутовый сок тормозит действие СУРЗА4-оксидазы в кишечной стенке; в результате концентрация принимаемого препарата может возрасти и достичь токсического уровня.
б) Большую роль играет обмен веществ в печени, где происходит обезвреживание ядов. Ферменты печени так видоизменяют химически родственные и чужеродные организму вещества, что они затем могут выводиться. Количество вещества, достигшее венозной крови, зависит от того, сколько лекарства получено из печени и метаболизировано. Важно, что синтез ферментов (увеличение объема гладкого эндоплазматического ретикулума) может индуцироваться другими лекарствами.
Этот путь лекарства в организме называют «пресистемным выведением».
3) При парентеральном приеме лекарства пресистемное выведение исключается. Лекарство после инъекции в вену попадает через полую вену в правое предсердие, затем в легкие, левое предсердие, наконец, пройдя большой круг кровообращения, в коронарную систему. Легкие, богатые липидами и имеющие большую поверхность, принимают значительную часть амфифильных и липофильных лекарственных веществ, а при падении концентрации лекарства в крови легкие медленно возвращают его обратно. При быстром введении лекарства путем внутривенных инъекций легкие действуют как буфер, защищая сердце от высоких концентраций вещества.
В определенных ситуациях высокий уровень пресистемного выведения может быть желательным. Важный пример — применение глюкокортикоидов при астме, когда основное количество введенного путем ингаляции лекарства проглатывается, и благодаря пресистемному выведению нагрузка на организм весьма незначительна. Примером положительной роли пресистемного выведения являются превращения ацетилсалициловой кислоты, которую назначают в целях снижения тромбообразования.
ЭКСКРЕЦИЯ ЛЕКАРСТВ [ править | править код ]
Лекарства экскретируются из организма различными путями: через почки (моча), кишечный тракт (желчь и фекалии), легкие (выдыхаемый воздух), материнское молоко и пот. Экскреция с мочой и фекалиями — наиболее важные пути элиминации лекарств.
- Почечная и фекальная экскреция — наиболее важные пути элиминации лекарств
- Некоторые лекарственные конъюгаты гидролизуются в нижнем отделе ЖКТ с образованием исходного лекарства, которое реабсорбируется (процесс энтерогепатической циркуляции), тем самым увеличивая продолжительность действия лекарства
- Часть введенной дозы некоторых лекарств, экскретируемая почками в неизмененном виде, зависит от pH мочи
- Клиренс креатинина может быть использован для определения поражения почек и как показатель необходимости снижения дозы, если экскреция почками играет существенную роль в элиминации лекарства больным раком и с недостаточностью экспрессии изоформы UGTIA1 глюкуронозилтрансферазы следует снизить дозу иринотекана, ингибитора топоизомеразы I, чтобы уменьшить вероятность возникновения миелосупрессии и диареи.
Экскреция через почки [ править | править код ]
Экскреция через почки осуществляется путем фильтрации и секреции. Фильтрация происходит в клубочках почек, секреция — по ходу нефрона. При заболеваниях почек процесс экскреции некоторых лекарств нарушается. Почечная экскреция многих лекарств коррелирует со способностью почек экскретировать креатинин. Если трудно или невозможно определить функцию почек непосредственно, измеряя 24-часовой клиренс креатинина, почечную функцию можно определить, используя общепринятый алгоритм Кокрофта и Голта. Эти исследователи установили соотношение между возрастом пациента, массой его тела и концентрацией креатинина в сыворотке (Cs cr), из которого можно вычислить клиренс креатинина (С1сг) почками у пациентов мужского пола:
Сlсr (мл/мин) = [(140 — возраст) X идеальная МТ (кг)] / [0,8145 X Cscr (мкмоль/л)]
Для женщин величину клиренса креатинина нужно умножить на 0,85.
Экскреция креатинина почками осуществляется за счет фильтрации и секреции, но по мере снижения функции почек возрастает величина секретируемой фракции. Возможно, что это соотношение применимо ко всем лекарствам, которые фильтруются и секретируются почками.
Различные способы повышения экскреции лекарств почками
На основании соотношения между рКа и pH мочи определяют долю ионизированного лекарства и, соответственно, его количество после фильтрации, не способное реабсорбироваться путем диффузии через люминальную поверхность нефрона. Так, салициловая кислота, относящаяся к слабым кислотам (рКа 3,0), в основном метаболизируется до экскреции с мочой. Однако по мере повышения pH мочи все большая часть дозы теряется с мочой. И действительно, для лечения интоксикации, вызванной салицилатами, может быть использовано подщелачивание мочи с помощью перорального или парентерального введения бикарбонатов с целью повышения элиминации салициловой кислоты почками. Этот способ также может быть полезен в случае передозировки фенобарбитала.
Повышение оттока мочи увеличивает элиминацию некоторых лекарств почками, поскольку при этом сокращается время контакта вещества с люминальной поверхностью и тем самым уменьшается время для реабсорбции неионизированных молекул.
Экскреция через желудочно-кишечный тракт [ править | править код ]
Удаление лекарств из ЖКТ можно ускорить применением лаважного электролитного раствора полиэтиленгликоля. Большие объемы этого раствора можно либо принять внутрь, либо ввести в ЖКТ через назогастральную трубку, чтобы усилить кишечную перистальтику и ускорить экскрецию неабсорбированного лекарства через прямую кишку. Уменьшение времени прохождения через ЖКТ связано с индукцией диареи и снижением абсорбции питательных веществ, однако в острой ситуации это не имеет клинического значения.
Энтерогепатическая циркуляция удлиняет фармакологический эффект некоторых лекарств
Некоторые конъюгаты лекарств, экскретируемые в желчь, гидролизуются в нижнем отделе тонкой кишки, высвобождая исходное лекарство, которое реабсорбируется в кровоток, благодаря чему действие лекарства удлиняется. Этот процесс рециклирования называют энтерогепатической циркуляцией. Например, клиническое значение имеют следующие процессы:
- энтерогепатическая циркуляция седативного снотворного лекарства лоразепама включает гидролиз его глюкуронидного конъюгата в нижнем отделе тонкой кишки;
- предполагается, что отсутствие эффекта оральной контрацепции может быть обусловлено ингибированием энтерогепатической циркуляции после антибиотикотерапии, в результате которой удаляются кишечные бактерии, гидролизующие стероидный конъюгат, поэтому клиренс стероидов усиливается, и становится более вероятным исчезновение контрацептивного эффекта.
Экскреция через легкие [ править | править код ]
Летучие лекарства экскретируются через легкие. Такой путь имеет основное значение для анестетиков общего действия газо- или парообразной форме. Эти анестетики вводятся и выводятся через легкие, давая возможность легко контролировать анестезию с помощью коррекции концентрации анестетика во вдыхаемой газовой смеси. Экскреция через легкие позволяет осуществлять мониторинг концентрации выдыхаемого анестетика в конце спокойного выдоха, что может служить суррогатным показателем уровня анестезии. Этанол экскретируется через легкие в небольших количествах. Этот путь элиминации для этанола количественно незначим, однако он стал основой неинвазивного метода определения концентрации этанола в крови для юридических целей.
Источник


