- Болезнь Паркинсона: как с ней справляться
- Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо отправить к специалисту? С каких препаратов начать лекарственную терапию? Каким образом устранить побочное действие специфической терапии?
- Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
- Все лекарственные препараты для лечения паркинсонизма
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
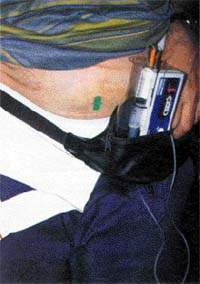 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
- Прочие виды симптоматического лечения
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.
Источник
Все лекарственные препараты для лечения паркинсонизма
Для выполнения произвольных движений нервный импульс проходит от двигательных отделов коры головного мозга через спинной мозг в соответствующие мышцы. Одновременно движение координируется импульсами, проходящими через различные отделы головного мозга обратно в двигательные центры коры головного мозга.
Один из этих путей осуществляется через мозжечок, другой — через базальные ганглии. Поражение базальных ганглиев приводит к развитию болезни Паркинсона (дрожательный паралич). Как правило, заболевание начинается в среднем возрасте и характеризуется тремором в покое, ригидностью мышц, скудостью движений (акинезией) и прогрессирующим снижением качества жизни.
Первопричиной заболевания являются дегенеративные процессы в клетках дофаминергических ганглиев, расположенных в черном веществе (substantia nigra), отростки этих клеток образуют нигростриарный путь, идущий к полосатому телу (скорлупа и хвостатое ядро); нейроны черного вещества оказывают тормозящее действие на полосатое тело. В полосатом теле также заканчиваются холинергические нейроны, стимулирующие функции этой структуры.
Фармакотерапия направлена на компенсацию дефицита дофамина и подавление холинергической активности:
а) L-ДОФА. Сам дофамин не проникает через ГЭБ, однако его природный предшественник L-дигидроксифенилаланин (леводопа) эффективно восстанавливает уровень дофамина в полосатом теле, т. к. транспортируется через ГЭБ переносчиком аминокислот, а затем декарбоксилируется ДОФА-декарбоксилазой, присутствующей в полосатом теле.
Декарбоксилирование также происходит в периферических органах, где дофамин нежелателен и часто вызывает побочные эффекты (рвота, гипотензия). Экстрацеребральную продукцию дофамина можно предотвратить с помощью ингибиторов ДОФА-декарбоксилазы (карбидопа, бенсеразид), которые не проникают через ГЭБ и не влияют на внутрицеребральное декарбоксилирование дофамина.
Избыточный уровень дофамина в головном мозге может вызывать нежелательные реакции, например непроизвольные движения (дискинезии) и психические нарушения.
б) Агонисты дофаминовых рецепторов. Дефицит дофамина в ЦНС компенсируется производными лизергиновой кислоты: бромокриптином, лизуридом, перголидом и каберголином. Эти препараты могут вызывать повреждение клапанного аппарата сердца, нарушая его функцию. Другие агонисты дофамина, не являющиеся производными лизергино-вой кислоты, — прамипексол, ропинирол, ротиготин. Последний применяется чрескожно.
в) Ингибиторы МАОВ. Активность МАОВ контролируют препараты селегилин и разагилнн. Они не влияют на разрушение биогенных аминов в периферических органах, т. к. не действуют на МАОА.
г) Ингибиторы КОМТ. Не проникающий в ЦНС энтакапон тормозит разрушение L-ДОФЫ в периферических органах и таким образом усиливает проникновение L-ДОФЫ в головной мозг. Толкапон — препарат резерва, проникающий в ЦНС.
д) М-холиноблокаторы. Блокаторы М-холинорецепторов центрального действия — бензатропин и бипериден — подавляют относительное преобладание холинергической активности, в особенности тремор. В настоящее время их редко назначают из-за характерных атропиноподобных побочных эффектов, ограничивающих переносимую дозу.
е) Амантадин. Ранние и легкие проявления паркинсонизма можно временно облегчить назначением амантадина. Предположительно механизм действия заключается в блокаде NMDA-рецепторов и в снижении высвобождения АХ.
ж) В лечении поздней стадии болезни Паркинсона используется комбинация всех перечисленных выше препаратов с целью ослабить симптомы этого тяжелого заболевания. Как правило, по мере прогрессирования заболевания появляются дополнительные симптомы дегенерации ЦНС.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «фармакология»
Источник