Воспроизведенные лекарственные средства генерики
Автор: К.С.ДАВЫДОВА, филиал «Клиническая фармакология» НЦ БМТ РАМН
Большая часть лекарственных средств ( ЛС ) на современном фармрынке являются воспроизведенными (генерическими) препаратами. Согласно данным розничного аудита (IMS Health и DSM Group) доля дженериков в настоящее время составляет от 77 до 88% в натуральном выражении [5] (существуют данные и про долю в 95% [9], однако ее достоверность вызывает сомнения), при этом согласно прогнозам эта доля будет неуклонно расти. По объему генерического сектора Россия занимает 3 место в мире после Китая и Индии [2,3]. В то же время структура рынка стран большой семерки формируется следующим образом: в США — 12% дженериков, в Японии — 30%, в Германии — 35%, во Франции — 50%, в Англии — 55%, в Италии — 60%, в Канаде — 64% (рис. 1) [8].
Среди препаратов, которые ежегодно регистрируются в России, отмечается значительно большее количество дженериков, чем оригинальных препаратов. Отдельные оригинальные препараты имеют значительное количество воспроизведенных ЛС. Так, оригинальное лекарственное средство Вольтарен (действующее вещество – диклофенак натрия) сегодня имеет 207 дженериков, зарегистрированных к медицинскому применению. Также в РФ зарегистрировано около 150 генерических ЛС эналаприла, около 100 — нифедипина, атенолола, ципрофлоксацина и порядка 50 – нитроглицерина, аспирина и парацетамола (причем количество комбинированных генерических последних двух ЛС превышает 300) [1,4]. В ряде стран с развитой системой контроля качества, эффективности и безопасности ЛС, число дженериков инновационного препарата в большинстве случаев не превышает 4-5 [10,19].
Генерические ЛС выводятся на рынок после истечения срока патентной защиты. Они должны полностью соответствовать оригинальному продукту по составу действующих веществ (вспомогательные вещества могут быть иными) и лекарственной форме, соответствовать фармакопейным требованиям, быть произведенными в условиях GMP. В Федеральном законе о лекарственных средствах №86-ФЗ от 1998 г. дается определение воспроизведенных ЛС: «воспроизведенные лекарственные средства — лекарственные средства, поступившие в обращение после истечения срока действия исключительных патентных прав на оригинальные лекарственные средства». Однако такое определение не характеризует дженерик как копию или аналог инновационного препарата. В новом Федеральном законе «Об обращении лекарственных средств» №61-ФЗ от 2010 г. смысл термина раскрывается более полно, согласно современным международным рекомендациям: «воспроизведенное лекарственное средство — лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства».
Воспроизведенные ЛС имеют ряд равнозначных общеупотребляемых синонимов – «генерики», «дженерики», «генерические лекарственные средства», «многоисточниковые (мультиисточниковые) лекарственные средства» [8,9], однако согласно Федеральному закону № 61-ФЗ именно термин «воспроизведенные лекарственные средства» должен применяться в первую очередь. В то же время Всемирная организация здравоохранения в качестве основного понятия таких ЛС рекомендует употреблять термин «многоисточниковые лекарственные средства» (multisource drugs) [20]. Оригинальное (инновационное) лекарственное средство – это ЛС, которое было впервые зарегистрировано на основе полной документации в отношении его качества, безопасности и эффективности, защищенное патентом на срок до 20 лет [11].
Основными характеристиками оригинального ЛС являются: длительность разработки (10-15 лет) на основании отбора действующего вещества из значительного количества молекул; фармакологический эффект, токсичность, мутагенность и тератогенность которого проверены в доклинических исследованиях на животных; прохождение всех фаз клинических исследований в соответствии со стандартами GСP.
Несмотря на то что инновационное и воспроизведенное ЛС содержат одно и то же действующее вещество в одинаковой дозировке и лекарственной форме, эффективность и безопасность генерических препаратов может существенно различаться. Основными причинами таких различий могут быть фармацевтическая технология производства лекарственного препарата, вспомогательные вещества (неактивные ингредиенты, наполнители, консерванты, красители и др.), их природа и количество, полиморфизм, солевая форма, упаковка препарата, условия его хранения и транспортировки. Из-за этих отличий эффективность генерических препаратов и выраженность их побочных эффектов может сильно варьировать.
При этом следует отметить, что стоимость воспроизведенного ЛС ниже, чем оригинального, что определяется рядом причин. Для этого необходимо рассмотреть, из чего складывается стоимость оригинальных ЛС и дженериков. 80% стоимости оригинального ЛС составляет стоимость исследований эффективности и безопасности препарата, а 20% стоимости – это стоимость синтеза лекарственного вещества. Процесс создания оригинального ЛС является очень длительным и дорогостоящим. Сначала создается молекула, потом она оценивается в исследованиях на клетках и тканях, затем на животных. После этого следуют три этапа клинических исследований на здоровых добровольцах и пациентах. После завершения клинических исследований ЛС проходит регистрацию. Исследование оригинального ЛС продолжается и после регистрации. С соблюдением правил GCP проводятся и пострегистрационные исследования [23].
Известно, что только 1 из 5 000 молекул доходит до рынка в виде ЛС. Этот путь продолжается 12-15 лет, его стоимость составляет от 800 млн. до 1 млрд. долл. Прибыльными являются только 1-2 из вновь созданных ЛС [8]. Объяснением более низкой стоимости генерических ЛС являются: отсутствие клинических исследований; отсутствие масштабных доклинических исследований фармакологической активности, поисковых исследований; отсутствие изучения полного профиля безопасности.
Несмотря на широкое использование понятия эквивалентность, «эквивалентности» дженериков как термина не существует. Всемирная организация здравоохранения предлагает применять термин «взаимозаменяемость» (interchangeability) воспроизведенных лекарственных препаратов [23]. Взаимозаменяемое генерическое ЛС – это терапевтически эквивалентное генерическое ЛС, которым можно заменить препарат сравнения в клинической практике [22]. Видов «эквивалентности» воспроизведенных ЛС выделяют несколько – терапевтическая, фармацевтическая, биологическая, а также т.н. «эквивалентность in vitro» (in vitro equivalence), введенная в употребление в документе «WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations (2006). Annex 7. Multisource (generic) pharmaceutical products: guidelines on registration requirements to establish interchangeability» [23].
Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями инструкции по применению [7,22]. Терапевтическая эквивалентность означает, что два препарата обеспечивают одинаковый терапевтический эффект и безопасность. Терапевтически эквивалентные лекарственные препараты должны отвечать следующим требованиям: иметь доказанную эффективность и безопасность; быть фармацевтически эквивалентными; быть биоэквивалентными; иметь сходные инструкции по применению; производиться в условиях стандарта GMP [6]. Доказанную клиническую эффективность и безопасность устанавливают на основании клинических исследований.
ЛС считаются фармацевтически эквивалентными, если они содержат одни и те же действующие вещества в одинаковом количестве и в одинаковой лекарственной форме и отвечают требованиям одних и тех же или сходных стандартов [1]. То есть фармацевтическая эквивалентность – это полное соответствие состава и лекарственной формы препаратов. Для некоторых лекарственных форм фармацевтическая эквивалентность будет обеспечивать терапевтическую эквивалентность и, соответственно, взаимозаменяемость двух препаратов (препараты для местного применения, порошки для изготовления растворов, инъекционные растворы и некоторые другие) [23].
Отдельно стоит выделить фармацевтическую альтернативность ЛС. Лекарственные средства являются фармацевтически альтернативными, если они содержат одинаковое количество одной и той же активной субстанции (субстанций), но различаются по лекарственной форме (например, таблетки и капсулы) и/или по химической форме (различные соли, эфиры) [1].
Оценка биоэквивалентности ЛС является основным видом медико-биологического контроля воспроизведенных (генерических) ЛС, не отличающихся лекарственной формой и содержанием действующих веществ от соответствующих оригинальных ЛС. Биоэквивалентность ЛС обозначает их одинаковую биодоступность. Под биодоступностью понимают количество неизмененного действующего вещества, достигающего системного кровотока (степень всасывания) относительно исходной дозы ЛС. Исследования биоэквивалентности позволяют сделать обоснованные заключения о качестве сравниваемых препаратов по относительно меньшему объему первичной информации и в более сжатые сроки, чем при проведении клинических исследований [17,18,21].
В некоторых международных руководствах введено понятие регуляторной процедуры «биовейвер», в соответствии с которой определение взаимозаменяемости генерических ЛС проводится на основании оценки их биофармацевтических свойств и эквивалентности in vitro (изучение сравнительной кинетики растворения) либо другими методами in vitro в качестве альтернативы исследованиям биоэквивалентности in vivo при их государственной регистрации [16].
Самое главное, к чему надо стремиться, — дженерики, как и инновационные (оригинальные) препараты, должны отвечать требованиям, предъявляемым в рамках Общего (или единого) технического документа (CTD): эффективность, безопасность, качество 15, поэтому весь объем исследований должен быть достаточным для подтверждения данных требований.
Литература
1. Арзамасцев А.П., Дорофеев В.Л. Эквивалентность воспроизведенных лекарственных средств: фармацевтические аспекты. // Ведомости НЦЭСМП. – М., 2007. – №1. – С. 27-35.
2. Баула О.Ю. Современные регуляторные требования к исследованиям и регистрации генерических лекарственных средств. – М., «Фармсодружество», 2007.
3. Белоусов Ю.Б. Дженерики – мифы и реалии. «Ремедиум». – 2003. — № 7–8. — С. 4–9.
4. Верткин А.Л., О.Б.Талибов. Генерики и эквивалентность – что стоит за терминами. Неотложная терапия. — 2004; — № 1–2. – С.16–17.
5. Новикова Н.Н. // Фармацевтический Вестник. – М., 2008. – №4. – С. 4.
6. Рудык Ю.С. К вопросу о терапевтической эквивалентности лекарственных средств // Рациональная фармакотерапия. – Киев, 2007. — №2. – С. 40-48.
7. Семинар-тренинг ВОЗ по проведению теста растворения, взаимозаменяемости лекарственных средств и системе биофармацевтической классификации. // Аптека, — Киев, 2007. – № 31. – С. 10-17.
8. Талибов О.Б. Генерики и эквивалентность лекарственных препаратов. // Медицинская газета «Здоровье Украины». – Киев, 2008. – №5. – С. 12-16.
9. Тарловская Е.И. Генерики и оригинальные препараты: взгляд практического врача. // Российский Медицинский Журнал. – М., 2008, – т. 16. – №5. – С. 30 – 35.
10. Чумак В.Т. Оборот лекарственных средств в Украине. Проблемы и перспективы. Материалы І Международной конференции «Клинические испытания лекарственных средств в Украине». — Киев, 2006.
11. Directive 2004/27/EC of the European Parliament and of the Council, Art. 10.1. – 2004.
12. ICH Harmonised Tripartite Guideline: The Common Technical Document for the Registration of Pharmaceuticals for Human Use: Quality M4Q (R1). – Geneva: ICH, 2002.
13. ICH Harmonised Tripartite Guideline: The Common Technical Document for the Registration of Pharmaceuticals for Human Use: Safety. M4S (R2). – Geneva: ICH, 2002.
14. ICH Harmonised Tripartite Guideline: The Common Technical Document for the Registration of Pharmaceuticals for Human Use: Efficacy. M4E (R1). – Geneva: ICH, 2002.
15. Interchangeability of multisource drug products containing highly variable drugs. WHO/FIP Training Workshop on Dissolution, Pharmaceutical Product Interchangeability and Biopharmaceuticals Classification System (BCS) — Kiev, 2007.
16. Yu G., Amidon J. Polli. Biopharmaceutics Classification System: The Scientific Basis for Biowaiver Extensions. // Pharmaceutical Research. – 2002. – Vol. 19, №. 7.
17. Chen M., Lesko L. Individual bioequivalence revisited. // Clin Pharmacokinet – 2001. – № 40: – pp. 701-706.
18. Chen M., Shah V., Patnaik R. Bioavailability and Bioequivalence: An FDA Regulatory Overview. // Pharmaceutical Research. – 2001. – Vol. 18, №. 12.
19. Laroche M., Merle L. Generic and brand-name drugs. Are different criteria sufficiently taken into account before granting market authorisation? // Acta Clin Belg Suppl. – 2006. – № 1: – pp. 48-50.
20. Multisource (Generic) Pharmaceutical Products: Guidelines on Registration Requirements to Establish Interchangeability. — WHO Technical Report Series, № 937. – WHO, 2006.
21. Quality of bioequivalence data. WHO workshop on assessment of bioequivalence data submitted to regulatory authorities – Kiev, 2009.
22. WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations. – WHO, 2006.
23. WHO Technical Report Series 937, annex 7 « Multisource (generic) pharmaceutical products: guidelines on registration requirements to establish interchangeability». WHO Expert Committee on Specifications for Pharmaceutical Preparations. – WHO, 2006.
Рисунок — в приложении
Файл: Загрузить (85 кбайт)
Источник
Генерики и оригинальные препараты: взгляд практического врача
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Всемирная Организация Здравоохранения (ВОЗ) в 2004 г. приняла резолюцию, провозгласившую радикальное увеличение безопасности лечения приоритетной задачей ВОЗ [1]. В этой резолюции особый акцент сделан на право больного знать все о своем заболевании, методах его лечения и на необходимости получения информированного согласия больного на лечение. В связи с этим следует учитывать, что информированное согласие предполагает заведомое разъяснение пациенту различий между «аналогами» лекарственных средств (ЛС). Однако только 60% врачей обнаруживают знакомство с такой постановкой вопроса [2].
Проблема генерических препаратов чрезвычайно актуальна для России. Во–первых, потому что в РФ – самая большая доля генериков на фармацевтическом рынке (78–95%) (рис. 1). Некоторые оригинальные ЛС имеют огромное количество генериков. Так, у Вольтарена – 120 генерических «копий», что само по себе противоречит международной практике. Обычно же на фармацевтическом рынке присутствует 4–5 генериков, качество которых скрупулезно проверено при регистрации препаратов.
Во–вторых, потому что генерики, производимые в РФ, в большинстве своем – низкого качества. Так, Сергей Иванов, первый заместитель Председателя Правительства РФ на встрече с членами Общественной палаты заявил: «Я не могу не упомянуть проблему фармакологической промышленности. Наряду с лесной и рыбной отраслями, я их отношу к самым криминализированным в экономике России. Ведь там и контрафакта полно, а даже если это не контрафакт, то качество все равно низкое. Здесь давно пора навести порядок» [3].
Так чем же генерический препарат отличается от оригинального?
Оригинальный лекарственный препарат – это впервые синтезированное, прошедшее полный цикл доклинических и клинических исследований ЛС, защищенное патентом на срок до 20 лет. Только по истечении срока действия патента возможно воспроизведение ЛС любой фармацевтической компанией: создается генерик. Таким образом, генерик должен появляться значительно позже оригинального препарата. Однако уже на этом этапе в РФ имеют место нарушения. Например, патент на оригинальный азитромицин истек только в 2007 г.(!!), а в РФ уже зарегистрировано не менее 14 генериков [4].
Термин «генерик» возник в 70–е годы XX века, когда считалось, что препараты–аналоги надо называть родовым (генерическим) именем, в отличие от оригинального ЛС, которое продавалось под специальным торговым наименованием. Смысл этого правила заключался в том, что оно облегчало распознавание оригинального ЛС среди препаратов–аналогов. В настоящее время генерики часто имеют собственные названия, что не позволяет различать генерики и оригинал. Например, оригинальный препарат диклофенака называется Вольтарен (Новартис), а генерики, которые теоретически должны называться родовым (генерическим) именем диклофенак, имеют самые разнообразные наименования.
В целом основными признаками генерика должны являться:
• отсутствие патентной защиты;
• сравнительно низкая цена;
• назначение и продажа под непатентованным наименованием (МНН);
• почти полное соответствие оригинальному продукту по составу (вспомогательные вещества могут быть иными);
• соответствие фармакопейным требованиям;
• производство в условиях GMP (надлежащая производственная практика).
Однако в РФ генерики сегодня это:
• сравнительно низкая цена – не всегда;
• назначение и продажа под непатентованным наименованием (МНН) – далеко не всегда;
• почти полное соответствие оригинальному продукту по составу (вспомогательные вещества могут быть иными) – большие проблемы;
• соответствие фармакопейным требованиям – не всегда;
• производство в условиях GMP – не всегда.
В законе РФ «О лекарственных средствах» (1998) введено определение понятия «воспроизведенные лекарственные средства», однако в нем упущен центральный элемент: не указано, что они являются копиями или аналогами оригинальных препаратов [1].
Согласно международному стандарту генерик – это лекарственный продукт с доказанной фармацевтической, биологической и терапевтической эквивалентностью с оригиналом.
Фармацевтическая эквивалентность
Фармацевтическая эквивалентность предполагает содержание одних и тех же активных субстанций в одинаковом количестве и в одинаковой лекарственной форме; соответствие требованиям одних и тех же или сходных стандартов [5]. «Фармацевтически альтернативными являются лекарства, содержащие одинаковый терапевтический компонент, представленный в виде различных солей, эфиров или комплексов, либо в различных дозах» [6].
К сожалению, в РФ отменен аналитический контроль генерических препаратов на этапе регистрации, он проводится только для новых отечественных ЛС [7].
Биологическая эквивалентность
«Биоэквивалентные лекарственные препараты – это фармацевтически эквивалентные или фармацевтически альтернативные препараты, обладающие сопоставимой биодоступностью, изученной в сходных экспериментальных условиях. Под биодоступностью понимается скорость и доля всасывания активного ингредиента или активного компонента лекарства, которое начинает действовать в точке приложения» [6].
В сущности, биоэквивалентность – это эквивалентность скорости и степени всасывания оригинала и генерика в одинаковых дозах по концентрации в жидкостях и тканях организма. Тест проводится с участием 18–24 здоровых добровольцев, которые однократно принимают 1 дозу изучаемого генерика (для пролонгированного препарата – 5 суток приема), затем после нескольких периодов полувыведения принимают аналогичную дозу оригинального препарата. При сравнении двух графиков фармакокинетики различия не должны превышать 20% (рис. 2). Исследование на биоэквивалентность обязательно проводится для всех генерических препаратов. Естественно, биоэквивалентность – это не гарантия, а предположение терапевтической эквивалентности и безопасности препарата [8].
Если генерик разрешен к применению в других странах, он регистрируется в РФ по упрощенной схеме (без определения биоэквивалентности). Только генерики новых производителей исследуются на биоэквивалентность. Из 1256 зарегистрированных в 2001 г. зарубежных препаратов только 22 прошли экспертизу на биоэквивалентность при регистрации в РФ. Таким образом, при регистрации зарубежных генериков в РФ мы полностью доверяем досье, представляемым фармацевтическими компаниями [2]. Такая «доверчивость» дорого обходится пациентам. Так, по мнению директора Государственного фармакологического центра МЗ Украины В.Т. Чумака – «…ни один из 150 имеющихся на рынке Украины препаратов диклофенака по своим фармакокинетическим свойствам не соответствует Вольтарену» [9].
Хорошо известен пример контрольной проверки биоэквивалентности генериков оригинальному кларитромицину. Работа C.N. Nightingale была представлена в 2000 г. на 5–й Конференции по макролидам, азалидам, стрептограминам, кетолидам и оксазолидинонам в Севилье [10]. Автор сравнил оригинальный препарат кларитромицина с 40 копиями в отношении биоэквивалентности, применив стандарты Американской фармакопеи. Исследование показало, что 70% генериков растворяются значительно медленнее оригинального препарата, что критично для их усвоения. 80% генериков отличаются от оригинала по количеству действующего начала в одной единице продукта. Количество примесей, не имеющих отношения к действующему началу, в большинстве образцов больше, чем в оригинале. В «лучшем» генерике их было 2%, в «худшем» – 32%.
Терапевтическая эквивалентность
«Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при введении пациентам в соответствии с указаниями в инструкции» [6].
Генерик терапевтически эквивалентен другому препарату, если он содержит ту же активную субстанцию и, по результатам клинических исследований, обладает такой же эффективностью и безопасностью, как и препарат сравнения, чья эффективность и безопасность установлены.
Надо отметить, что сравнительное исследование должно проводиться по определенным правилам (GCP – надлежащая клиническая практика) и должно быть:
• независимым;
• многоцентровым;
• рандомизированным;
• контролируемым;
• длительным (средняя продолжительность приема ЛС);
• с жесткими конечными точками (смерть, инфаркт, инсульт).
Такого рода исследования выполнены только для единичных генериков, применяемых в РФ. К сожалению, данные клинических исследований при регистрации в РФ обязательны только для новых оригинальных препаратов, эффективность и безопасность генериков остается без внимания [7].
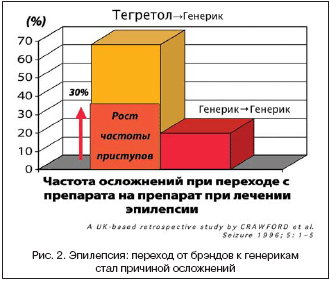
Отсутствие исследований на терапевтическую эквивалентность при регистрации генериков имеет многочисленные негативные последствия. Так, в хорошо известном исследовании противоэпилептических препаратов было показано, что переход с оригинального ЛС Тегретола на генерик приводил в 70% случаев к негативным последствиям, а в 30% случаев к значимому повышению частоты приступов [11].
По мнению профессора В.А. Насоновой, «…распространение в РФ огромного количества генериков диклофенака, не всегда обладающих основными качествами оригинального ЛС, стали заметно влиять на авторитет Вольтарена» [12].
Примером отсутствия терапевтической эквивалентности являются результаты сравнительного изучения антигипертензивной эффективности генериков эналаприла и оригинального ЛС – Ренитека. Продемонстрировано, что дозе Ренитека 12 мг, необходимой для достижения целевого АД, были эквивалентны различные дозы генериков [13].
Таким образом, особенностями генериков в РФ являются:
• появление многих генериков в России раньше соответствующих оригинальных ЛС;
• отсутствие данных о терапевтической эквивалентности с оригинальным ЛС;
• относительно высокие цены генериков;
• самая высокая доля генериков на фармацевтическом рынке.
Интересными являются сведения о том, из чего складывается стоимость оригинальных ЛС и генериков. 80% стоимости оригинального ЛС составляет стоимость исследований эффективности и безопасности препарата, а 20% стоимости – это стоимость синтеза лекарственного вещества. Вообще процесс создания оригинального ЛС очень длительный и дорогостоящий. Сначала создается молекула, потом она оценивается в исследованиях на клетках и тканях, затем на животных. После этого следуют три этапа клинических исследований на здоровых добровольцах и пациентах. После завершения клинических исследований ЛС проходит регистрацию.
Исследование оригинального ЛС продолжается и после регистрации. Проводятся с соблюдением правил GCP так называемые пострегистрационные исследования.
Известно, что только 1 из 5 000 молекул доходит до рынка в виде ЛС. Этот путь продолжается 12–15 лет и «стоит» от 800 млн. до 1 млрд. $. Прибыльными являются только 1–2 из вновь созданных ЛС.
Таким образом, преимуществами оригинальных ЛС являются:
• доказанная эффективность;
• доказанная безопасность;
• инновационность;
• воспроизводимость эффекта;
• жесткий контроль качества.
Процесс создания генерика происходит совершенно иначе. Отсутствуют три этапа клинических исследований, перед регистрацией проводится только исследование биоэквивалентности. 50% себестоимости составляет стоимость активной субстанции. Для того чтобы снизить стоимость, фармацевтические компании либо изменяют методы синтеза, либо ищут возможность приобретения наиболее дешевых субстанций. В целом приобретение активной субстанции у компаний, специализирующихся на ее производстве, является общепринятой практикой. Зачастую активная субстанция приобретается в странах, мало доступных для контроля: Китай, Индия, Вьетнам. Поставки субстанций происходят через большое количество посредников, сведения о месте производства обычно не публикуются и готовый продукт рекламируется, как изготовленный в высокоразвитой стране [1].
Качество наполнителей тоже имеет большое значение: любое изменение в составе вспомогательных веществ или оболочки могут существенно изменить качество препарата, его биодоступность, привести к токсическим или аллергическим явлениям. В том, что генерики отличаются от оригинала составом вспомогательных веществ, можно легко убедиться, изучив данные фармацевтических справочников.
Таким образом, источниками низкой стоимости генерических ЛС являются:
• отсутствие клинических исследований;
• отсутствие сравнительных исследований с оригиналом;
• отсутствие изучения профиля безопасности.
Могут ли генерики низкого качества повлиять на здоровье нации? Да, могут. Например, применение генерических антибиотиков приводит к хронизации заболеваний, резистентности бактерий, вирусов и грибов к антимикробным препаратам, росту инвалидизации и смертности [14].
Несоблюдение международных требований к генерикам в РФ влечет за собой огромные потери от «выгодной» цены вследствие затрат на повторные госпитализации, большие дозы ЛС и лечение побочных эффектов.
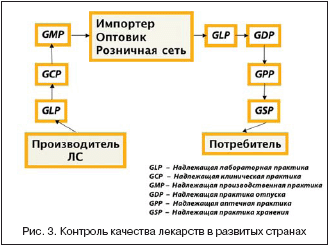
Как решается проблема генерических препаратов в развитых странах? Прежде всего это жесткий контроль качества на каждом этапе пути ЛС от производителя к пациенту (рис. 3). Кроме того, в развитых странах имеет место отрицательное отношение к биоэквивалентности, как к единственному способу оценки равнозначности лекарств. Для того чтобы считать генерик качественным, необходимо проведение клинических исследований на терапевтическую эквивалентность.
Очень важно то, что врач имеет полноценную информацию о том, какое ЛС является оригинальным препаратом, а также о качестве генерических препаратов. В США генерики разделены на группы «А» и «В». Код «А» присваивается генерикам, прошедшим клинические исследования на терапевтическую эквивалентность и имеющим отличия биоэквивалентности от оригинального ЛС не более 3–4%. Генерики с кодом «А» могут являться заменой оригинальному препарату по финансовым соображениям. Код «В» присваивается генерикам, не прошедшим клинические испытания на терапевтическую эквивалентность. Генерик с кодом «В» не может быть автоматической заменой оригинальному препарату или другому генерику с кодом «А». Сведения о статусе лекарственных препаратов – общедоступны и содержатся в справочнике «Orange Book». В аптеке провизор может отпустить больному препарат только с тем торговым названием, которое выписал врач [1,2,6].
Как решить проблему генериков в России? Конечно, наиболее кардинальным является изменение законодательства, приведение его в соответствие с законодательством цивилизованных стран. Пока этого не произошло, возможно оценивать качество генериков по некоторым весьма существенным критериям.
Во–первых, по мнению экспертов качество генерика вполне удовлетворительно, если ЛС зарегистрировано в странах с развитой контрольно–разрешительной системой, к которым относятся члены PIC–PI C/S – «Конвенции и схемы сотрудничества по фармацевтическим инспекциям» (старые члены Евросоюза, США, Япония, Канада, Австралия, Австрия, Швейцария, Норвегия, Венгрия, Чехия, Словакия, Сингапур) [1]. Важно именно место регистрации, а не производства ЛС.
Во–вторых, генерик имеет достойное качество, если компания–производитель доказала терапевтическую эквивалентность генерика оригинальному препарату в пострегистрационных рандомизированных контролируемых исследованиях [15].
В–третьих, должна быть уверенность, что при производстве генерика соблюдаются правила GMP [16].
Что делать врачу в России, если он хочет качественно лечить пациента? Скорее всего, назначать оригинальный препарат при наличии такой возможности или выбрать качественный генерик при невозможности назначить оригинальный препарат по финансовым соображениям.
Может ли практический врач в РФ заниматься оценкой качества генериков? Конечно нет, хотя многие врачи пытаются это делать. Однако это не входит в задачи практического врача, который просто должен иметь на рабочем столе источник достоверной информации о ЛС, в том числе о том, какой препарат является оригинальным, а какой генерическим, какой генерик относится к группе «А» и является качественным, а какой к группе «В» и не может быть заменой оригинальному ЛС и более качественному генерику. Тогда практический врач будет спокойно назначать то ЛС, которое считает нужным для данного больного. Кроме того, в этом случае врач должен иметь гарантию, что пациент в аптеке получит именно то ЛС (с тем торговым наименованием), которое выписано в рецепте. В нашей стране, к сожалению, нельзя допускать выписку рецептов по МНН, так как на фармацевтическом рынке присутствует огромное количество генерических ЛС очень различного качества. Врач же, как лицо юридически отвечающее за качество лечения пациента, должен быть уверен, что пациент получит именно то ЛС, которое он больному назначил.
Что делать пациенту в РФ? Начать задавать правильные вопросы врачу и государству, а также перестать экономить на здоровье. Хорошо известно, что население нашей страны на биологические добавки тратит в 10 раз больше средств, чем на лекарства [17].
Но, наверное, больше всего вопросов по поводу того, почему врач не имеет информации о том, какое торговое наименование соответствует оригинальному препарату, а какое генерическому. Почему в РФ отсутствует справочник ЛС, где это было бы указано? Ответственность за недостаточную информированность врача несет государство, которое должно обеспечивать все категории населения непредвзятой и доказательной информацией в отношении ЛС [18]. Полноценное лекарственное средство – это лекарственный продукт плюс полноценная информация о нем. Безусловно, наиболее простым решением проблемы с точки зрения практического врача был бы допуск на фармацевтический рынок РФ только качественных генерических ЛС.
Литература
1. Мешковский А.П. Место дженериков в лекарственном обеспечении. Фарматека. 2003; 3: 103–4.
2. Белоусов Ю.Б. Дженерики – мифы и реалии. Remedium. 2003;7–8: 4–9.
3. Иванов С. Выступление на встрече с членами Общественной палаты. Заседание, посвященное промышленности и инновациям. МГТУ имени Баумана. 2007; 18.05.
4. Панюшин Р. Оригинальные и дженериковые препараты: единство или борьба противопо¬ложностей? Фарм. вестник. 2003; 16: 23–25.
5. ЕМЕА, The rules governing medicinal products in the European Union Investigation of Bioavailability and Bioequivalence.1998; 3C: 231–244.
6. FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 23th Edition, 2003.
7. Материалы семинара «Совершенствование процесса регистрации и контроль качества лекарственных средств». Казахст. //Фармацевтический вестник. 16.10.2005.
8. Верткин А.Л., О.Б.Талибов О.Б. Генерики и эквивалентность – что стоит за терминами. Неотложная терапия. 2004; 1–2: 16–17.
9. Чумак В. Т. Оборот лекарственных средств в Украине. Проблемы и перспективы. Материалы І Международной конференции «Клинические испытания лекарственных средств в Украине». Киев, 2006, ноябрь.
10. Nightingale CH. A survey of the Quility of Generic Clarithromydn Product from 13 Countries. Clin Drug Invest 2000; 19: 293–05.
11. A UK–based retrospective study by CRAWFORD et al Seizure. 1996; 5: 1–5.
12. Насонова В.А. Особенности применения различных форм диклофенака натрия при болезнях мягких тканей плечевого пояса и боли в нижней части спины. Consilium medicum. 2006; 2 (8): 45–48.
13. Недогода С.В., Марченко И.В., Чаляби Т.А. Сравнительная антигипертензивная эффективность генериков ангиотензинпревращающего фермента эналаприла (ренитека, энапа, эднита, инворила, энваса и энама) и стоимость лечения у больных гипертонической болезнью. Артериальная гипертония. 2000; 1: 52–5.
14. Сущук Е.А. Симпозиум «Исследования по биоэквивалентности препаратов как основа для рационального использования генериков». Конгресс «Человек и лекарство», 3 апреля 2006 г.
15. The rules governing medicinal products in the European Union. Investigation of Bioavailability and Bioequivalence.1998; 3C: 231–244.
16. Марцевич С.Ю., Кутишенко Н.П., Дмитриева Н.А., Белолипецкая В.Г. Выбор лекарственного препарата в кардиологии: на что должен ориентироваться практический врач? Кардиоваскул. тер. и профилактика. 2004; 4: 77–82.
17. Гарматина Ю. Реклама против закона. //АиФ–Здоровье. 2004; 11, март: 2.
18. Рабочее совещание ВОЗ: Политика в области информации о ЛС в странах Европы и в Новых Независимых Государствах. Хиллеред. 1996; 27.03–2.04
Источник