Во что идут лекарственные травы
НИИ фармации ММА им. И.М. Сеченова, Москва
Лекарственные сборы — смеси нескольких видов измельченного, реже – цельного, растительного сырья. В состав сборов входят различные части растений: корни, кора, трава, листья, цветки, плоды, семена. Многокомпонентные лекарственные растительные сборы давно используются в медицинской практике, что объясняется эффективностью и мягкостью их действия, отсутствием, как правило, нежелательных побочных явлений при длительном применении, а также удобством приготовления. В России имеются достаточная сырьевая база по многим видам лекарственных растений, опыт их производства и клинического применения. Лекарственные растительные сборы являются наиболее популярной и широко используемой формой переработки лекарственного растительного сырья.
Композиции из лекарственного растительного сырья, иногда с добавлением минеральных веществ, с глубокой древности применялись в медицине всего мира. Особенно популярны сборы в восточной медицине: китайской, тибетской и др. Прописи этих сборов отличаются сложностью состава, большим числом компонентов, относящихся к различным морфологическим группам сырья. В народной медицине России сборы применялись менее широко, т. к. предпочтение отдавалось индивидуальным лекарственным растениям.
Многокомпонентные смеси из лекарственного растительного сырья обладают ценными преимуществами перед другими фитопрепаратами: возможность обеспечить основной фармакологический эффект в сочетании с комплексным воздействием на организм больного в целом, мягкость действия и отсутствие, как правило, нежелательных побочных явлений. Они достаточно просты в промышленном производстве и относительно дешевы.
Лечение многокомпонентными лекарственными растительными сборами обычно более эффективно, чем одиночными растениями. При составлении сбора необходимо учитывать индивидуальные особенности больного и наличие сопутствующих заболеваний. При выборе сбора нужно знать показатели артериального давления и учитывать основную тенденцию его изменения. Например, при выборе сбора для больного холециститом с артериальной гипертензией необходимо, чтобы в сбор входили растения не только с желчегонным, но и с гипотензивным действием, иначе лечение может спровоцировать гипертонический криз, ухудшить общее состояние. Кроме того, следует учитывать склонность к запорам либо поносам; соответственно, эффект должен быть слабительного или вяжущего характера. Действие лекарственного растительного сырья во многом зависит от доз. Корень ревеня, например, в больших дозах применяется как слабительное средство, а в малых, наоборот, оказывает закрепляющее действие. Различные дозы пряно-горького сырья стимулируют или угнетают выделение желудочного сока. Некоторые растения действуют на мускулатуру матки и могут быть опасными при беременности. Растительные сборы и средства не рекомендуется принимать во время менструаций. Лекарственное растительное сырье обладает разносторонним действием. Этим объясняется тот факт, что в прописях, разных по назначению, часто встречаются одинаковые компоненты, но в разных количествах и различных сочетаниях. Предусмотреть нежелательное побочное действие лекарственных растений может только врач после всестороннего обследования больного.
В зависимости от входящих в состав сбора видов сырья на его основе готовят настои или отвары. Если в состав сбора входят пахучие эфирномасличные растения, то из них, как правило, готовят настой. Кипячение при этом не допускается, т. к. эфирные масла являются летучими веществами, испаряющимися вместе с водой. Лекарственные сборы содержат различные биологически активные соединения, которые одновременно с лечением основного заболевания дополнительно обогащают организм различными витаминами, минеральными соединениями и другими компонентами растений, способствующими повышению сопротивляемости организма, благотворно влияющими на центральную нервную систему, улучшающими процессы кроветворения, нейтрализующими шлаки и ускоряющими выведение их из организма. Воздействие на физиологические процессы осуществляется в этом случае природными, более приемлемыми для организма органическими веществами. Аллергические осложнения при лечении лекарственными растительными сборами наблюдаются гораздо реже, чем при применении других медикаментов (например, химического происхождения). Разностороннее воздействие биологически активных веществ растений часто достигает цели. Так, при назначении сложного сбора при заболеваниях печени вещества бессмертника усиливают секрецию желчи, желудочного и панкреатического сока, повышают тонус желчного пузыря, изменяют химический состав желчи. Вещества, содержащиеся в кукурузных рыльцах, благотворно влияют на обмен веществ, улучшают желчеотделение. Вещества барбариса уменьшают и снимают боли, что связано с присутствием алкалоида берберина, обладающего спазмолитическим действием. С той же целью часто в такой сбор вводят и лист мяты перечной.
Кроме органических веществ сборы содержат макро- и микроэлементы, которые участвуют в обмене веществ, находятся в функциональном взаимодействии с ферментами, витаминами, гормонами и другими биологически активными веществами. Марганец, медь, цинк, кобальт в микродозах стимулируют выработку антител, повышают сопротивляемость организма. Медь, железо, цинк, кобальт уменьшают проницаемость биологических мембран. При лечении больного многокомпонентными лекарственными сборами в организм вводятся белки, аминокислоты, углеводы, липиды, ферменты, витамины, органические кислоты, спирты, альдегиды и кетоны, сложные эфиры фосфорной кислоты и других кислот, фитостерины, смолистые и дубильные вещества, гликозиды, терпеноиды, кумарины, амиды и амины, бетаины, холин и холиновые сложные эфиры, пурины и пиримидины, алкалоиды, горькие вещества и многие другие.
Наиболее популярны следующие лекарственные растительные сборы: антимикробный, желудочно-кишечный, урологический, грудной, успокоительный, желчегонный, противосклеротический, спазмолитический, ветрогонный, мочегонный, противоастматический.
Заболевания желудочно-кишечного тракта довольно широко распространены, на их долю приходится 35–37 % общей заболеваемости населения. Наиболее распространенными среди них являются гастриты, язвенная болезнь, энтероколиты. Терапия воспалительных и деструктивных заболеваний желудочно-кишечного тракта направлена на коррекцию нарушений желудочной секреции, моторной функции желудка и кишечника, кишечного пищеварения, а также предусматривает воздействие на измененную слизистую оболочку желудка и кишечника. Применение синтетических лекарственных препаратов не всегда оказывает должное воздействие при указанной патологии; кроме того, возможно развитие побочных реакций и осложнений. В таких случаях, а также для профилактики обострений хронических заболеваний желудочно-кишечного тракта весьма перспективны растительные сборы. Желудочно-кишечный сбор – это комбинированный препарат растительного происхождения, содержащий пять видов растительного лекарственного сырья. Настой сбора обладает спазмолитическим, противовоспалительным, желчегонным седативным, регенерирующим действием. Эффект обусловливают содержащиеся в цветках ромашки эфирное масло, полисахариды, флавоноиды; эфирное масло из листьев мяты, основными компонентами которого является ментол, флавоноиды, витамины; эфирное масло из плодов укропа.
Воспалительные заболевания бронхов в настоящее время широко распространены и являются одной из наиболее частых причин потери работоспособности. Антибиотикотерапия, применяемая для их лечения, нередко приводит к развитию аллергии, формированию резистентности микроорганизмов с потерей чувствительности к антибиотикам при последующих курсах лечения, развитию дисбактериоза и росту числа грибковых заболеваний. Опыт клинического применения грудного сбора демонстрирует его эффективность и целесообразность использования при инфекционно-воспалительных процессах в бронхах в качестве вспомогательного или альтернативного лекарственного средства, свободного от нежелательных побочных явлений. Лечебный эффект сбора обусловлен антибактериальным эффектом цветков ромашки, побегов багульника, цветков календулы, отхаркивающим и обволакивающим действием корней солодки, травы фиалки и побегов багульника, противовоспалительными и спазмолитическими эффектами корней солодки, цветков ромашки, календулы и листьев мяты.
В последнее время наблюдается значительный рост распространенности состояний, вызванных повышенной физической или умственной нагрузкой, воздействием неблагоприятных факторов окружающей среды, растущими информационными нагрузками, стрессами. В таких условиях развивается хроническое переутомление, которое приводит к развитию бессонницы, повышенной нервной возбудимости, раздражительности, неврастении, сердечно-сосудистых неврозов, тахикардии, истерии, мигрени, вегетососудистой дистонии, климактерических расстройств, артериальной гипертензии. Лекарственных растений, обладающих успокоительным действием, достаточно много. Седативное, спазмолитическое, гипотензивное действие успокоительного сбора обусловлено входящими в него лекарственными травами. Эффект определяют содержащиеся в траве пустырника эфирные масла, сапонины, дубильные вещества, алкалоиды; в листьях мяты перечной – ментол; в корневищах с корнями валерианы – сложный эфир борнеола и изовалериановой кислоты, свободная валериановая и другие органические кислоты, алкалоиды (валерин и хатинин), дубильные вещества, сахара; в корнях солодки – ликуразид, тритерпены, глицирризиновая кислота и флавоноиды; в траве чабреца – эфирное масло, дубильные и горькие вещества; в траве душицы – тимол, флавоноиды, дубильные вещества; в шишках хмеля – эфирное масло, органические кислоты, алкалоиды, флавоноиды, лупулин; в траве донника – кумарины, мелилотозид, полисахариды.
Приготовление из сборов лекарственных растений настоев и отваров принципиально не отличается от получения этих препаратов из сырья отдельных лекарственных растений. В конкретных указаниях по приготовлению из сборов настоев и отваров обычно приводится такое соотношение: 1–2 столовая ложка смеси на 200 мл воды.
Во всех случаях для полного извлечения действующих веществ воды берут гораздо больше, чем при приготовлении аналогичных лекарств в условиях аптеки. Поэтому принимают изготовленное лекарство чаще всего не ложками, а по 1/3–1/2 стакана. Если настой или отвар готовят ежедневно, он не подвергается микробной контаминации и может храниться при комнатной температуре в течение дня. При большем количестве его следует хранить в холодильнике, но не более двух суток.
Обычно при лечении лекарственными растениями улучшение наступает через несколько дней, но стойкого эффекта удается достичь лишь при длительном и регулярном применении лекарственных трав. Отсутствие положительного эффекта в течение 2–3 недель, как правило, является основанием для замены сбора. Курс лечения сборами должен определять лечащий врач при постоянном наблюдении за здоровьем больного.
При лечении хронических больных сборами растений их принимают длительное время. Во избежание привыкания к ним и снижения эффективности лечебного воздействия рекомендуют после каждого курса лечения (1,0–1,5 месяца) делать перерыв на 1–2 недели. По тем же соображениям желательно после 2–3 курсов лечения одним из сборов перейти на лечение другим, обладающим аналогичным действием.
Информация об авторах:
Самылина Ирина Александровна – доктор фармацевтических наук, профессор, член-корреспондент РАМН,
директор НИИ фармации; заведующая кафедрой фармакогнозии ММА им. И.М. Сеченова.
Тел. 8 (499) 128-57-88;
Сорокина Алла Анатольевна – доктор фармацевтических наук,
профессор кафедры фармакогнозии ММА им. И.М. Сеченова.
Тел. 8 (495) 120-20-20;
Пятигорская Наталья Валерьевна – кандидат фармацевтических наук, доцент,
заместитель директора НИИ фармации по научной работе.
Тел. 8 (499) 128-57-55
Источник
Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
Батюшин М.М. 1 , Садовничая Н.А. 1 , Руденко Л.И. 1 , Повилайтите П.Э. 2
1 Кафедра внутренних болезней с основами физиотерапии №2, Нефрологическое отделение ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Ростовское областное патологоанатомическое бюро Министерства здравоохранения Ростовской области, г.Ростов-на-Дону
Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014423 Эл.почта: batjushin-m@rambler.ru, sadovnichaya@list.ru, nephr-roon@rambler.ru
За прошедшее десятилетие отмечен значительный рост популярности «нетрадиционной медицины». Это объясняется такими факторами, как неудовлетворенность методами и эффективностью ранее проводимого лечения, бесконтрольным использованием информации о неблагоприятных побочных действиях фармацевтических препаратов, ростом цен на фармакопейные лекарственные средства и низким уровнем общей культуры населения. В отношении использования сбора лекарственных растений в литературе имеются указания на ограничения их применения, так как их прием при определенных заболеваниях может вызывать нежелательные побочные эффекты. В Европе, США и Канаде постоянно увеличивается доля населения, регулярно использующего фитотерапевтические средства и биологически активные добавки, в странах Азии и Африки более 30% всех случаев острого почечного повреждения развивается как осложнение лечения растительными препаратами [1, 2]. По данным исследования импортированных патентованных азиатских аюрведических растительных продуктов в Калифорнии, было установлено, что 32% из них содержали не декларированные фармацевтические средства и тяжелые металлы (свинец, ртуть, кадмий, мышьяк). Среди не декларированных веществ наиболее часто встречаются: эфедрин, хлорфениламин, колхицин, метилтестостерон, глюкокортикостероиды, нестероидные противовоспалительные препараты [3, 4, 5, 6, 7, 8]. Сегодня в Европе зарегистрировано более 100 препаратов, содержащих растительные флавоноиды. Они обладают антиоксидантной активностью и применяются в основном в лечении нарушений периферического кровообращения.
Потенциальное значение этой проблемы чрезвычайно велико, в частности остается неясной степень взаимодействия фармацевтического препарата с травами и растительными продуктами [9, 10]. Неконтролируемый прием лекарственных трав может превышать потенциальный положительный эффект, особенно среди лиц с заболеваниями почек [11, 12, 13, 14], что связано с непосредственным воздействием растительных препаратов на клетки канальцев и их активной реабсорбцией с достижением высокой концентрации в мозговом слое. Результатом такого воздействия на почки является острое канальцевое повреждение, папиллярный некроз, острый и хронический интерстициальный нефрит, синдром Фанкони, нефролитиаз, артериальная гипертензия, рабдомиолиз [15, 16].
К фитотоксинам, обладающим прямым нефротропным действием относят аристохолиевую кислоту, сапонины, метилсалицилат, флавоноиды, ореллаин, алкалоиды эфедры, охратоксин [17]. На территории России наиболее часто с целью лечения и профилактики заболеваний почек применяются такие лекарственные травы как: пижма, барбарис, берѐза, бессмертник песчаный, брусника, бузина, календула, кукуруза (рыльца), можжевельник, толокнянка, хвощ, шиповник, репешок обыкновенный (Argimonia Eupatoria), а также марена красильная грузинская (Rubia tinctorum var. iberica), дикорастущая трава.
Репешок обыкновенный (Argimonia Eupatoria) – многолетнее травянистое растение, широко распространенное в европейской части России, на территории Западной и Восточной Сибири, Дальнего Востока [18]. В народной и традиционной медицине все части растения применяются при широком спектре заболеваний в качестве желчегонного, противовоспалительного, антиаритмического, гипогликемического, антигельминтного, анальгетического, гемостатического, антигипертонического, антитоксического и антиканцерогенного средства. В европейских странах некоторые виды Agrimonia являются официальными лекарственными растениями и используются в практической медицине как вяжущее, противовоспалительное средство [19]. При проведении биохимического анализа структуры растения в надземной части A.Eupatoria обнаружены вещества фенольной природы (филавоноиды, дубильные вещества, кумарины, изокумарины, оксикоричные кислоты), тритерпеноиды, эфирное масло, полисахариды и др., а в подземных органах растения обнаружены медь, цинк, железо, ванадий, никель, хром, титан, марганец, стронций, цирконий, серебро [20].
Токсические эффекты А. Eupatoria в большей степени связаны не со специфическими токсикантами, а с наличием в нем большого количества гликозидов кумарина и его метаболитами. В 1994 г. на основании углубленного анализа токсикологических исследований экспертами Европейского Совета сделаны рекомендации о снижении допустимого уровня содержания кумарина в продуктах питания до 0,5 мг/кг вследствие его канцерогенного и мутагенного действия.
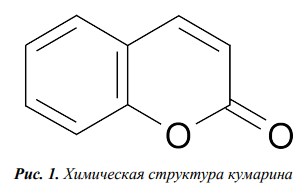
КУМАРИН (2-хроменон) имеет молекулярную массу 146,14 и представляет собой бесцветные кристаллы с запахом свежего сена и горьким вкусом (рисунок 1).
Рис. 1. Химическая структура кумарина
Сообщения о гепатотоксических эффектах для человека, развивающихся вследствие приема кумарин-содержащих лекарственных препаратов, часто противоречивые, вызвали значительный интерес исследователей к изучению его метаболизма и механизма токсического действия [20, 21].
Современные представления о метаболизме кумарина предполагают наличие двух основных путей трансформации данного соединения в организме млекопитающих. Первый этап трансформации кумарина реализуется по двум направлениям: в результате 7-гидроксилирования кумарина образуется малотоксичный 7-гидроксикумарин, элиминирующийся из организма млекопитающих с мочой; в процессе 3-гидроксилирования образуется 3-гидроксикумарин, промежуточным метаболитом в данном процессе является токсичный 3,4-эпоксид, подвергающийся дальнейшей трансформации с образованием о-гидроксифенилальдегида, окисляющегося до о-гидроксиэтанола и о-гидроксифенилуксусной кислоты. Рядом авторов было показано, что доминирование одного из двух направлений метаболизма кумарина в организме обусловливает межвидовые различия в проявлении гепатотоксических свойств данного соединения [22, 23]. Риск осложнений при приеме кумарина возрастает при сочетанном приеме НПВС, антикоагулянтов прямого и непрямого действия.
В экспериментальных работах [24, 25] установлено, что кумарин при однократном введении в больших дозах крысам вызывает центрилобуллярный некроз гепатоцитов. Это свидетельствует о том, что метаболизм кумарина [3-l4C] в данном случае проходил с образованием более токсичных метаболитов. Исследования in vitro показали, что химически активные [3-l4C]-кумариновые метаболиты, образующиеся при участии цитохром P450-зависимых энзимов, способны ковалентно связывать микросомальные протеины [26]. Было сделано предположение, что токсическим метаболитом в данном случае может выступать 3,4-эпоксид.
Нами представлен случай нефротоксического действия алкалоидов кумарина и его метаболитов при употреблении отваров и настоев Репешка обыкновенного.
Пациентка А. 43 лет, поступила в нефрологическое отделение клиники РостГМУ с жалобами на легкую ноющую боль в поясничной области с обеих сторон, усиливающуюся при физической нагрузке, пастозность голеней и стоп, периодически повышающееся артериальное давление до 220/140 мм рт. ст., не связанное с психоэмоциональными и/или физическими нагрузками, сопровождающееся головной болью и головокружением. Из анамнеза известно, что в 1990 году в течение всего периода первой беременности выявлялась протеинурия до 3,3 г/л, не сопровождающаяся отечным синдромом и артериальной гипертензией, в течение 5 лет после родов протеинурия сохранялась на уровне 0,5-1,0 г/л. В 1995 г. впервые зарегистрирован высокий уровень артериального давления (АД) – 150/100 мм рт. ст. Антигипертензивную терапию не получала, однако с 1999 г. артериальная гипертензия приобрела злокачественный характер, с повышением уровня системного АД до 200/120 мм рт. ст., по поводу чего в 2000 году проходила обследование в стационаре, где был поставлен диагноз гипертонической болезни II стадии, 3 степени, риск 3 (высокий), тогда же была подобрана антигипертензивная терапия, позволявшая контролировать АД на уровне 130-150/80-90 мм рт. ст., но пациентка данные рекомендации не соблюдала, а самостоятельно приобрела фитопрепарат (Репешок обыкновенный), отвар и настои которого, принимала более полугода непрерывно по несколько раз в сутки. В 2001 году, во время прохождения планового медицинского осмотра выявлен нефросклероз справа, дальнейшего наблюдения и лечения не проходила. В 2008 году при выполнении ультразвукового исследования почек выявлен конкремент правой сморщенной почки, по данным реносцинтиграфии функция правой почки отсутствует.
Помимо приема фитопрепаратов постоянно использует дипиридамол в дозе 75 мг/сутки, эналаприл 10 мг/сутки с 2001 года, в 2011 году уровень протеинурии составил 0,044 г/л, уровень артериального давления до 240/140 мм ртутного столба.
По данным клинико-лабораторного обследования в нефрологическом отделении клиники РостГМУ со стороны ОАК на себя обращали внимание ускорение СОЭ до 32 мм/час, признаки анемии легкой степени тяжести (эритроцитов 2,52х1012/л, гемоглобин 100 г/л), снижение количества тромбоцитов (75х103 /л), со стороны свертывающей системы крови по данным коагулограммы выявлены признаки гипокогуляции, характеризующиеся снижением АПТВ до 20 сек., протромбиновое время 10 сек., МНО 0,5, тромбиновое время 6 сек., фибриноген 1,98 г/л, со стороны биохимических показателей крови отмечалась гиперхолестеринемия до 10,79 мМ/л, гиперазотемия (креатинин крови 129 мкМ/л, мочевина 14,9 мМ/л), уровень АСТ достигал 68 Ед/л, АЛТ – 51 Ед/л. В ОАМ – протеинурия, характерная для нефритического синдрома (до 0,4 г/л). Снижение концентрационной функции почек, проявляющееся снижением СКФ до 45,5 мл/мин (по формуле MDRD), изостенурией (по данным пробы Фольгарда). Суточная протеинурия не превышала 0,495 г/сутки, по данным суточной экскреции солей с мочой отмечается высокая экскреция кальция до 9,73 мМ/сутки, и мочевой кислоты до 9,13 мМ/сутки. За все время наблюдения состояние пациентки оставалось стабильным, уровень АД в пределах 130-140/70-80 мм рт. ст., суточный диурез около 1500-1700 мл. По данным УЗИ почек отмечаются диффузные изменения паренхимы почек, уменьшение размеров, микролит правой почки.
Таким образом, клиническая картина болезни соответствовала аутоиммунному заболеванию почек, на что указывали наличие протеинурии, мочевой синдром, характеризующийся микрогематурией, снижением азотвыделительной функции почек, наличием артериальной гипертензии, тем не менее, нельзя было исключить наличие хронического повреждения канальцевого эпителия, преимущественно в проксимальных отделах, с нарушением реабсорбции, без формирования клиники острого канальцевого некроза, что позволило заподозрить наличие специфического патологического процесса, связанного с токсическим влиянием метаболита кумарина на канальцевый эпителий почек. Следует также учесть наличие процесса нефросклероза в правой почке, вероятно, обусловленного мочекаменной болезнью в анамнезе.
Пациентке была выполнена пункционная нефробиопсия левой почки с последующим морфологическим исследованием биоптата с целью верификации патологического процесса и определения тактики терапии. В результате получены следующие данные.
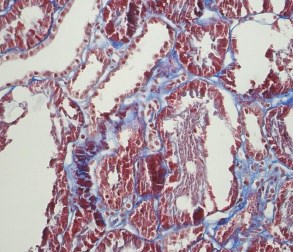
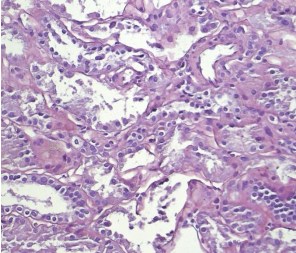
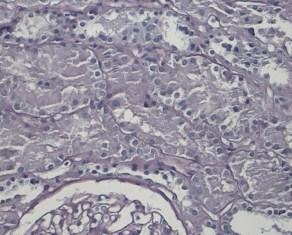
Светооптически 1 из 9 клубочков склерозирован полностью, остальные гипертрофированы. В одном клубочке выраженная интракапиллярная гиперклеточность и пролиферация базальных мембран. Остальные клубочки не имеют признаков выраженных пролиферативных изменений, за исключением сегментарного расширения парамезангиальных зон. Сегментарного склероза капиллярных пучков не наблюдается. В интерстиции слабый диффузный и мелкоочаговый фиброз. Резко выраженная гидропическая дистрофия эпителия канальцев вплоть до вакуолизации (рисунки 2, 3, 4).
Рис. 2. Х20 массон1 – резко выраженные дистрофические изменения эпителия канальцев, его слущивание
Рис. 3. Х20 ШИК – резко выраженные повреждения эпителия канальцев – слущивание фрагментов цитоплазмы и целых клеток в просвет канальцев
Рис. 4. Х20 ШИК – расширение и гиперклеточность мезангиальных зон
Окраска на амилоид отрицательна. Иммуноморфологически: IgA в клубочках: отрицательно, в канальцах: отрицательно, IgG в клубочках: отрицательно, в канальцах: отрицательно, IgM в клубочках: единичное редкое пунктирное, в канальцах: единичные цилиндры, C3 комплимент: единичные зерна в клубочках и в капсуле, а также зернистое в стенках артериол, C1q комплимент: отрицательно. Каппа: отрицательно в клубочках, единичные очаги в интерстиции. Лямбда: отрицательно в клубочках, единичные очаги в интерстиции. Электронномикроскопически: толщина и структура базальных мембран в пределах нормы, депозитов не обнаружено. Имеются протяженные очаги распластывания малых отростков подоцитов, пролиферация мезангиальных клеток отсутствует. Результаты были интерпретированы как очаговое распластывание малых отростков подоцитов, а также тубулопатия неясного генеза. Особое внимание в клинической картине на себя обращало постепенное нарастание протеинурии, артериальной гипертензии на фоне снижения фильтрационной функции почек и канальцевой дисфункции. Подобная двойственность клинических проявлений препятствовала пониманию сути патологического процесса в почках, и не позволяла в полной мере проводить медикаментозную терапию, отвечающую патогенетическим и этиологическим принципам. Указание в анамнезе на длительный прием фитопрепаратов позволило предположить токсическое воздействие метаболитов кумарина на функциональное состояние почек, однако в доступной литературе нет прямых указаний на прямое нефротоксическое действие кумарина. Исследователи ограничивают область токсических влияний кумарина и его метаболитов на функцию печени и гемостаза. Действительно, в рассматриваемом клиническом примере отмечаются как нарушения гемостаза, характеризующиеся гипокоагуляцией, так и печеночная дисфункция. Однако по данным нефробиопсии отмечаются признаки токсического процесса на уровне канальцев почки, характеризующегося резко выраженной гидропической дистрофией эпителия канальцев вплоть до вакуолизации, слабым диффузным и мелкоочаговым фиброзом интерстиция. Эти изменения соотносятся с изменениями клубочков, характеризующимися выраженной интракапиллярной гиперклеточностью и пролиферацией базальных мембран, сегментарным расширением парамезангиальных зон, наличием очагов распластывания малых отростков подоцитов.
Таким образом, впервые в литературе описан случай прямого нефротоксического воздействия кумарина и его метаболитов. Повреждение канальцевого эпителия почек метаболитами кумарина обуславливается во многом изначальным повреждением гломерулярной базальной мембраны, а также дисморфизмом подоцитов, что обуславливает повышенную готовность канальцевого эпителия к повреждению на фоне усиления процессов реабсорбции в связи с дефектами гломерулярной базальной мембраны и подоцитов. В свою очередь, низкая молекулярная масса кумарина и его метаболитов позволяет свободно проникать через гломерулярный фильтр, что, в условиях повреждения базальной мембраны и подоцитов, приводит к критическому повышению его в первичной моче и обуславливает токсическое действие на уровне канальцев почки.
Литература
1. Ермоленко, В.М. Острая почечная недостаточность / В.М. Ермоленко, А.Ю. Николаев – М.: Гэотар-Медиа, 2010. – 400 с.
2. Angell, M. Alternative medicine – the risks of untested and unregulated remedies / M. Angell, J.P. Kassirer // N. Engl. J. Med. – 1998. – V.339. – P.839-841.
3. Fugh-Berman, A. Herb-drug interactions / A. Fugh-Berman // Lancet. – 2000. – V.355. – P.134-138.
4. Recent patterns of medication use in the ambulatory adult population of the United States: the Spone survey / D.W. Kaufman, J.P. Kelly, L. Rosenberg et al. // JAMA. – 2002. –V.287. – P.337-344.
5. Screening methods for drugs and heavy metals in Chinese patent medicines / A. Au, R. Ko, F. Boo et al. // Bull. Environ. Contam. Toxicol. – 2000. – V.5. – P.112-119.
6. Chopra, A. Ayurvedic medicine: core concept, therapeutic principles, and current relevance/ A. Chopra, V. Doiphode. // Med. Clin. North. Am. – 2002. – V.86. – P.75-89.
7. Ernst, E. Heavy metals in traditional Indian remedies / E. Ernst // Eur. J. Clin. Pharmacol. – 2002. – V.57. – P.891-896.
8. The use and safety of non-allopathic Indian medicines / N. Gogtay, H. Bhatt, S. Dalvi, N. Kshirsagar // Drug Saf. – 2002. – V.25. – P.1005-1019.
9. Indian herbal remedies for diabetes as a cause of lead poisoning / R.W. Keen, A.C. Deacon, H.T. Delves et al. // Postgraduate Medical Journal. – 1994. – V.70. – P.113-114.
10. Ko, R.J. Adulterants in Asian patent medicines / R.J. Ko // N. Engl. J. Med. – 1998. – V.339. – P.847.
11. Arlt, V. Aristolochic acid as a probable human cancer hazard in herbal remedies: a review / V. Arlt, M. Stiborova, H. Schmeiser // Mutagenesis. – 2002. – V.17. – P.265-277.
12. Trends in alternative medicine use in the United States, 1990-1997: results of a follow-up national survey / D.M. Eisenberg, R.B. Davis, S.L. Ettner et al. // JAMA. – 1998. – V.280. – P.1569-1575.
13. Ernst, E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review / E. Ernst // J. Intern. Med. – 2002. – V.252. – P.107-113.
14. Foote, J. Medicinal herb use and the renal patient / J. Foote, B. Cohen // J. of Renal Nutrition. – 1998. – V.8. – P.40-42.
15. International Agency for Research on Cancer (IARC). Some traditional herbal medicines, some mycotoxins, nafhtalene and styrene. In IARC Monographs on the Evaluation of Carcinogenic Risks of Chemicals to Humans. Lyon. France: IARC, 2002. – Р.82.
16. Herbs and the kidney/ C. Isnard Bagnis, G. Deray, A. Baumelou et al. // Am. J. Kidney Dis. – 2004. – V.44. – №1. – P.1-11.
17. Morris L. Side-effects of coumarin / L. Morris, P.D. Welsby // Postgrad. Med. J. – 1995. – №71. – P.701-702.
18. British Herbal Pharmacopoeia. – 1996. – 212 p.
19. Advances in research on chemical constituents and pharmacological activities of Agrimonia pilosa / G. Hong, Y.H. Dai, P.X. Liu et al.// Pharm. Care and Research. – 2008. – V.8. – № 5. – P.362-366.
20. Карташова, Г.С. Содержание дубильных веществ в Agrimonia pilosa Ledeb. / Г.С. Карташова, И.В. Гравель, Е.Г. Таран // Растительные ресурсы. – 1991. – Т.27. – №1. – С.139-143.
21. Wei, Y. Isolation of hyperoside and luteolin-glucoside from agrimonia pilosa ledeb using stepwise elution by high-speed countercurrent chromatography / Y. Wei, Y. Ito // J. of Liquid Chromatography and Related Technologies. – 2007. – V.30. – №9-10. – P.1465–1473.
22. Separation and determination of flavonoids in Agrimonia pilosa Ledeb. by capillary electrophoresis with electrochemical detection / X. Xu, X. Qi, W. Wang, G. Chen // J. of Separation Science. – 2005. – V.28. – №7. – P.647-652.
23. Analysis of the volatile components of Agrimonla Pilosa Ledeb by gas chromatography-mass spectrometry / Y.W. Li, L.F. Huang, C. Liang et al. // J. of Central South University (Science and Technology). – 2007. – V.38. – №3. – P. 502-506.
24. Фитохимическое исследование растений флоры Сибири / Д.Л. Макарова, В.В. Величко, Н.Е. Ким и др.// Фармация. – 2008. – №3. – С.19-22.
25. 500 важнейших лекарственных растений / В.К. Лавренов, Г.В. Лавренова. – М., 2003. – 510 с. 26. Comparative metabolism and kinetics of coumarin in mice and rats / S.L. Born, A.M. Api, R.A. Ford et al. // Food Chem. Toxicol. – 2003. – №41. – P.247-258.
Статья опубликована в журнале «Вестник урологии». Номер №3/2013 стр. 30-39
Источник