Виды лекарственных препаратов растительного происхождения
В соответствии с Федеральным законом от 22.12.2014 № 429-ФЗ «О внесении изменений в Федеральный закон № 61-ФЗ «Об обращении лекарственных средств» введено понятие группировочного наименования, используемого в целях объединения лекарственных препаратов, не имеющих международного непатентованного наименования: «группировочное наименование лекарственного препарата — наименование лекарственного препарата, не имеющего международного непатентованного наименования, или комбинации лекарственных препаратов, используемое в целях объединения их в группу под единым наименованием исходя из одинакового состава действующих веществ» [9]. Для препаратов, получаемых из лекарственного растительного сырья (ЛРС) нами предложены принципы формирования группировочных наименований. Группировочное наименование должно составляться на основе родового и видового наименований производящего растения и названия морфологической группы растения и должны указываться на русском языке. Для многокомпонентных препаратов растительного происхождения группировочное наименование составляется из группировочных наименований отдельных компонентов, расположенных по алфавиту, с символом «+» [6]. Нормативно-правовые акты Евразийского экономического союза также предусматривают использование группировочных наименований при отсутствии международного непатентованного наименования (МНН) («Требования к маркировке лекарственных средств», «Правила регистрации лекарственных средств для медицинского применения» и т.д.) [12, 13]. В Российской Федерации для многих лекарственных препаратов растительного происхождения присвоены группировочные наименования [1]. Вместе с тем имеется целый ряд включенных в государственный реестр лекарственных средств, для которых группировочные наименования отсутствуют или сформулированы не совсем корректно. Например, для лекарственного препарата «Ротокан» в государственном реестре лекарственных средств указано следующее группировочное наименование: «календулы лекарственной цветков экстракт+ромашки аптечной цветков экстракт+тысячелистника обыкновенного травы экстракт». Такая редакция свидетельствует о том, что лекарственный препарат произведен из экстрактов, полученных из различных производящих трех видов растений. Согласно технологии производства, ЛП представляет собой водно-спиртовой экстракт, получаемый из смеси/сбора лекарственного растительного сырья: ромашки аптечной цветков, ноготков цветков, тысячелистника травы, поэтому группировочное наименование должно быть составлено с учетом состава и технологии получения данного лекарственного препарата: «[календулы лекарственной цветков+ромашки аптечной+тысячелистника обыкновенного травы] экстракт». Другим примером служит ЛП Эваменол, мазь назальная. В государственном реестре лекарственных средств в качестве группировочного наименования указано «эвкалипта прутовидного листьев масло+[рацементол]». Согласно материалам регистрационного досье для производства фармацевтической субстанции Эвкалипта листьев масла фирмы «Дестилационес Бордас Чинчурета С.А.», Испания, используется только один вид ЛРС, богатый 1,8-цинеолом — эвкалипта шарикового листья (Eucalyptus globulus Labill), что соответствует требованиям монографии «Эвкалипта масло» Европейской фармакопеи, согласно которой для производства эвкалипта масла должны использоваться такие высокоцинеольные виды эвкалипта как Eucalyptus globulus Labill., Eucalyptus polybractea R.T. Baker и Eucalyptus smithii R.T. Baker [11]. Для другого компонента группировочное наименование «[рацементол]» не соответствует фармацевтической субстанции l-ментол, используемой для производства лекарственного препарата.
Таким образом, необходима проверка правильности группировочных наименований уже составленных ранее в соответствии с разработанными правилами и с учетом используемых видов ЛРС, состава ЛП и технологии его получения.
Федеральный закон № 61-ФЗ «Об обращении лекарственных средств» не предусматривает регистрацию ЛРС, как это было до его введения. Анализ материалов регистрационного досье на ЛРП и ЛП растительного происхождения показал, что производители снижают требования к ЛРС, что приводит к ненадлежащему качеству ЛП. Так, например, в ЛП Чистотела трава в лекарственной форме трава измельченная, поступившем на экспертизу с целью регистрации, выявлено несоответствие качества образцов по показателю «Внешние признаки»: в препарате обнаружены амбарные вредители. Наличие амбарных вредителей в ЛРС и ЛРП способствует размножению бактерий и плесневых грибков, вследствие чего меняется цвет, повышается температура и влажность, появляется затхлый запах, а результатом является снижение лекарственных и технологических свойств. Кроме того, амбарные вредители являются источником аллергенов. В случае с ЛП Тысячелистника трава, в лекарственной форме «трава измельченная», поступившем на экспертизу с целью регистрации, в проекте нормативной документации на препарат были включены нормы по заниженному содержанию эфирного масла «не менее 0,08 %» (вместо нормы в ГФ ХI «не менее 0,10 %»), увеличено допустимое количество органической примеси – «не более 1,5 %» (вместо «не более 0,5 %») [4]. Согласно классификации ЛРС, тысячелистника трава относится к эфирномасличному сырью, содержащему хамазулен; камфору, туйон, борнеол, цинеол, что и обуславливает специфическое фармакологическое действие препарата. Количество эфирного масла свидетельствует о правильности фазы заготовки, условий сушки и хранения, сроков годности сырья. Следовательно заниженное содержание эфирного масла приводит к ухудшению качества лекарственного средства. Наличие органической примеси в три раза превышающей норму по сравнению с нормой, указанной в ГФ ХI [4] может свидетельствовать о наличии других видов растений, что снижает содержание биологически активных веществ, характерных для данного ЛРС. Таким образом, снижение требований к числовым показателям не позволяет обеспечить качество ЛРП.
Настойки, как и экстракты жидкие, относящиеся к лекарственным средствам растительного происхождения, содержат в своем составе различные группы биологически активных веществ, включая действующие и соэкстрагируемые компоненты. В технологии производства настоек и экстрактов жидких особое значение имеет стадия очистки путем отстаивания полученного извлечения при температуре не выше + 10 С в течение не менее 2 суток до получения прозрачной жидкости. В процессе отстаивания коагулируют и выпадают в осадок многие высокомолекулярные соединения, различные механические включения и соэкстрагируемые компоненты. Отстоявшиеся извлечения сливают и фильтруют. ГФ ХIII, государственные фармакопеи Республики Беларусь и Республики Казахстан, а также ведущие зарубежные фармакопеи (Европейская, Британская) [2, 3, 5, 10, 11], характеризуют настойки обычно как прозрачные жидкости. Образование осадка может быть обусловлено используемой морфологической группой лекарственного растительного сырья, в частности — подземными органами (корни, корневища). Так, например, Пиона уклоняющегося настойку производят методом дробной мацерации спиртом этиловым 40 % сырья двух разных морфологических групп одного и того же производящего лекарственного растения: пиона уклоняющегося травы и пиона уклоняющегося корневищ и корней. В производстве лекарственного препарата Элеутероккока экстракта жидкого в качестве исходного сырья используются подземные органы элеутероккока колючего – корневища и корни. Для этих лекарственных препаратов допускается возможность образования осадка, так как крахмал, локализующийся в подземных органах (корнях и корневищах), обуславливает образование осадка. Возможность образования осадка в процессе хранения рассматривается как исключение из общего правила при условии отсутствия в осадке той группы биологически активных веществ, которые обуславливают фармакологический эффект лекарственного препарата. Для ряда препаратов, присутствующих на отечественном рынке в течение многих десятилетий и ранее выпускавшихся по фармакопейным статьям, в которых образование осадка не предусматривалось, заявители включают в нормативную документацию возможность образования осадка ( «Перца водяного экстракт жидкий», «Календулы настойка» и др). В этом случае причиной образования осадка может быть использование лекарственного растительного сырья с низкой степенью измельченности, нарушение технологии производства (например, способа экстракции, температурного режима отстаивания, фильтрующих материалов), условий хранения.
Особое значение в технологии производства ЛРП в форме выпуска измельченные и порошок уделяется обеспечению необходимой степени измельчения. Требуемая степень измельчения лекарственных растительных препаратов должна облегчить проникновение экстрагента в клеточную структуру для извлечения биологически активных веществ. Извлечение биологически активных веществ из ЛРП представляет собой сложный процесс, включающий диффузию, десорбцию, растворение, диализ и вымывание, происходящих самопроизвольно и одновременно. Для различных видов сырья (ромашки цветков, мяты перечной листьев, донника травы) существует определенное оптимальное измельчение, ниже которого измельчать материал нежелательно, так как в противном случае в водное извлечение переходит много мелких обрывков тканей и других нерастворимых веществ, делающих извлечение мутным, способствующим быстрой его порче. Кроме того, завышенное содержание мелких частиц увеличивает возможность содержания пыли. Балластные вещества, содержащиеся в пыли, в воде набухают, масса может склеиваться, обволакиваться воздухом и плохо смачиваться, что создаст препятствия для проникновения экстрагента в клетку. Не должно быть и крупных частиц выше установленных норм, так как в различных частях растений (например, листья, стебли) содержится различное количество действующих веществ. Одновременное содержание крупных и мелких частиц приводит к разнородности распределения частиц в упаковке, соответственно к неоднородности дозирования упаковки и неравномерному экстрагированию биологически активных веществ. Так, в случае с лекарственным препаратом Мяты перечной листья в форме выпуска «листья измельченные», для показателя «Частиц, проходящих сквозь сито с отверстиями размером 5 мм приведены нормы «не более 10 %» вместо «не более 5 %», установленных в ГФ.
При подготовке фармакопейной статьи (ФС) на препарат «Корвалол» (ФС 42-2277-94) [8], по которой отечественными производителями производился анализ данных всех выпускаемых ЛП, их стабильности, обоснованности, фармацевтической разработки состава препарата. В ФС 42-2277-94 «Корвалол» был установлен срок годности ЛП 1,5 года. С 2001 года для выпуска ЛП производители используют собственную нормативную документацию. Так как 1,5 года – небольшой срок годности и неудобен для реализации продукции, то производители стремятся его увеличить. Однако при этом препарат не выдерживает хранении и наблюдается снижение содержания этилового эфира альфа-бромизовалериановой кислоты (0,015 г/мл и 0,016 г/мл при норме «от 0,019 до 0,21 г/мл»). Одной из причин заниженного содержания этилового эфира альфа-бромизовалериановой кислоты может быть его гидролиз в щелочной среде водного раствора (рН 8,3 — 10,0). С целью стабилизации некоторые производители лекарственного препарата «Корвалол» снизили значение рН до 5,5 – 8,5, добавляя меньшее количество натрия гидроксида (с 0,315 г на 100 мл препарата до 0,022 г). Это позволило обеспечить качество ЛП «Корвалол» при увеличении срока годности с 1,5 до 3-4 лет.
Таким образом, в связи с введением в ФЗ-61 требованияпонятия группировочного наименования для лекарственных средств, не имеющих МНН, необходимо утверждение правил составления группировочных наименований для ЛП растительного происхождения и пересмотр приведенных в государственном реестре лекарственных средств группировочных наименований для некоторых препаратов.
В ГФ ХIII в ОФС 1.5.1.0001.15 «Лекарственное растительное сырье. Фармацевтические субстанции растительного происхождения» [5] введено понятие «фармацевтической субстанции растительного происхождения». Определение статуса «фармацевтическая субстанция растительного происхождения» позволит повысить требования к качеству используемого ЛРС, а соответственно гарантировать высокое качество ЛП растительного происхождения, поскольку в РФ ЛП могут производиться только из фармацевтических субстанций, включенных в государственный реестр лекарственных средств, но при этом необходимо ввести понятие «фармацевтическая субстанция растительного происхождения» в ФЗ-61, так как в настоящее время в законе дано определение только ЛРС.
До введения в действие ОСТ 91500.05.001-00 «Стандарты качества лекарственных средств. Основные положения» [7] все отечественные производители выпускали ЛП по ФС. Каждая статья проходила согласование у производителей данного ЛП, поэтому всесторонне учитывались все особенности технологии получения, состава и стабильности ЛП. Пересмотр отдельными производителями показателей качества, методов анализа и сроков годности, которые заявлялись в фармакопейных статьях, требуют всестороннего изучения и тщательного обоснования.
Источник
Виды лекарственных препаратов растительного происхождения
На протяжении всей своей истории человечество соприкасалось с царством растений, используя последние для удовлетворения своих хозяйственных, пищевых и лекарственных целей. Поэтому неудивительно, что даже современные лекарственные препараты разработаны на основе природных соединений. Среди них наиболее известны витамин С, аспирин, хинин, морфин и кодеин. В последние десятилетия большое внимание уделяется изучению свойств таксола, арглабина, винбластина и некоторых других соединений, полученных на основе растительных препаратов.
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии, инфекционных заболеваний, онкологии и метаболических заболеваний остается активной частью фармацевтических исследований [15]. В последние годы на рынке появилось более 40 новых препаратов природного происхождения, прошедших полный путь от исследования до клинических испытаний [2]. Такое внимание исследователей к природным соединениям обусловлено в первую очередь меньшей токсичностью растительных препаратов и более широким спектром действия. Некоторые лекарственные соединения растительного происхождения обнаружили способность эффективно блокировать развитие различных вирусов, включая вирус простого герпеса, гриппа, вирус иммунодефицита человека, вирусы гепатита С и В и многие другие [4, 8, 17, 19,].
Целью данного сообщения является систематизация данных по действию различных соединений растительного происхождения, способных ингибировать репродукцию вирусов.
Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Весь процесс репродукции вирусов может быть условно разделен на три фазы [15]. Первая фаза охватывает события, которые ведут к адсорбции и проникновению вируса в клетку, освобождению его внутренних структурных компонентов и модификации его таким образом, что он способен вызвать инфекцию. Вторая фаза репродукции связана со сложными процессами, в течение которых происходит экспрессия вирусного генома. Заключительной стадией репродукции является выход вирусного потомства из клетки путем почкования или за счет лизиса, причем в последнем случае клетка погибает [12]. Имеющийся на сегодняшний день арсенал противовирусных средств способен оказывать воздействие на любой из этапов репродукции вируса.
Адсорбция и проникновение вируса в клетку
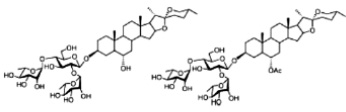
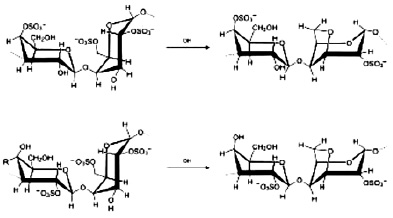
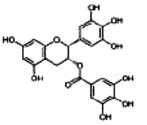
Взаимодействие вируса с клеткой начинается с процесса адсорбции, т.е. прикрепления вирусных частиц к клеточной поверхности. Этот процесс протекает при наличии соответствующих рецепторов на поверхности клетки и «узнающих» их субстанций на поверхности вируса. Прикрепление вируса к клетке происходит в два этапа, один из которых неспецифический, другой ‒ специфический. Поэтому химиотерапия этого этапа инфекции может быть также разделена на специфическую и неспецифическую. Неспецифическая стадия блокирования адсорбции вируса в первую очередь связана с электростатическими взаимодействиями между вирусом и клеткой, поэтому использование полисахаридов и некоторых пептидов, выделенных из растений и несущих большой отрицательный заряд, эффективно ингибирует адсорбцию вирусов. В подобных препаратах необходимы, как минимум, две сульфатные группы на один моносахарид. При этом противовирусная активность возрастает с возрастанием молекулярной массы в интервале от 1 до 10 kD. При меньших, а также больших массах полисахаридов противовирусная активность резко снижена. Не менее интересной группой химических соединений, подавляющих адсорбцию вирусов, можно назвать тритерпеновые сапонины, которые в силу своих структурных особенностей, связываясь с холестерином мембраны, способны изменять пространственную структуру мембраны клетки [13]. Установлено, что наличие у подобных препаратов трех сахарных остатков 3-O-β-хакотриозила увеличивает противовирусную активность соединений. Другой группой препаратов, блокирующих репликацию вирусов, являются полифенольные соединения, не только изменяющие заряд поверхности клетки, но и препятствующие специфической сорбции вируса на рецепторы (рис. 1).
Рис. 1. Соединения, блокирующие стадию адсорбции вируса [4, 8, 13]
Освобождение внутреннего компонента вируса
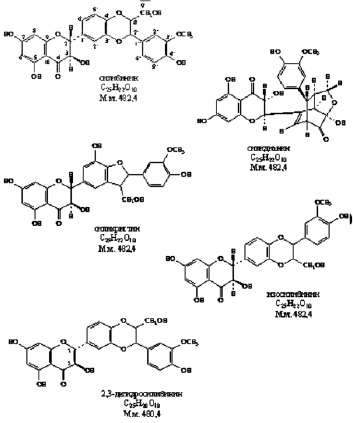
После проникновения вириона в клетку происходит целый комплекс превращений вируса, смысл которых заключается в удалении вирусных защитных оболочек, препятствующих экспрессии вирусного генома. Этот процесс сопровождается рядом характерных особенностей: исчезает инфекционность вируса, появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител. Основной группой растительных соединений, способных подавлять репродукцию вирусов на этой стадии, являются аналоги силимарина, лютеолина и кверцетина (рис. 2) [4, 20, 21].
Рис. 2. Соединения, блокирующие освобождение внутреннего компонента вируса
Экспрессия вирусного генома и сборка вирусных частиц
Экспрессия вирусного генома и сборка вирионов являются самыми сложными этапами, включающими транскрипцию нуклеиновых кислот, трансляцию белков, посттрансляционные модификации вирусных белков, репликацию нуклеиновых кислот, сборку вирусных частиц. Этот этап репродукции вирусов успешно блокируется 2 основными группами растительных соединений: ингибиторами РНК полимераз и ингибиторами посттрансляционных модификаций белков. К таким препаратам относятся алпизарин, госсипол, эпиген и др (рис. 3).
Механизм действия подобных препаратов связан с образованием ацил-ферментных производных и основан на блокировании одной из трех основных областей, критичных для активности аспарагиновой протеазы вируса: каталитическое ядро фермента, содержащее пару Asp-Thr/Ser-Gly триад, мобильная flap-область и домен димеризации на N- и С-концах протеазы [1, 10, 14].
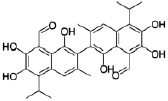
Рис. 3. Соединения, блокирующие экспрессию вирусного генома
Выход вирусного потомства
Завершающим этапом репродукции вируса является выход вирионов из инфицированной клетки. Этот процесс может протекать с помощью почкования вируса и лизиса клетки. Лизис клетки, как правило, сопровождается гибелью клетки. Блокировать такой механизм выхода вируса практически невозможно.
Выход из клетки путем почкования осуществляют вирусы с липопротеиновой оболочкой. При этом способе клетка может длительное время сохранять жизнеспособность и продуцировать вирусное потомство, пока не произойдет полное истощение ее ресурсов. Одним из механизмов блокирования этого этапа репродукции вируса является использование ингибиторов ферментативной активности вируса, участвующей в почковании вируса. Разработка препаратов группы ингибиторов фермента вируса гриппа – нейраминидазы (NA) ‒ является успешным достижением современной вирусологической науки последних лет – так называемого «рационального лекарственного дизайна», поскольку при синтезе данного препарата были использованы современные знания третичной структуры NA как антигена и фермента [3, 6].
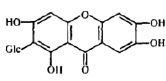
Препараты с антинейраминидазным действием «имитируют» структуру натуральных субстратов каталитического сайта NA (рис. 4), что «привлекает» вирус к большему взаимодействию с ними [5, 18]. К подобным соединениям относятся коричные и оксикоричные кислоты, галлаты и др.
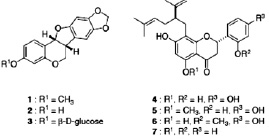
Рис. 4. Структура ингибиторов нейраминидазы [7, 9, 16]
На сегодняшний день практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой стадии процесса. Однако, несмотря на определенные успехи, достигнутые в вирусной химиотерапии, клиническая практика сталкивается с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам.
Изучение растительных препаратов, обладающих антивирусными свойствами (алпизарин, эпиген, протефлазид, госсипол), показало, что за счет разных механизмов действия препаратов (противовирусное и иммуностимулирующее) появление вирусов, устойчивых к данным препаратам, не наблюдается. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе, резистентные к существующим коммерческим химиопрепаратам. Подобные препараты, сочетающие в себе свойства иммуностимулирующих и противовирусных соединений, можно рекомендовать для лечения и профилактики инфекционных заболеваний, ассоциированных с иммунодефицитным состоянием, в том числе таких, как грипп, ВИЧ, гепатит С и др. [11, 17].
Рецензенты:
Саятов М.Х., д.б.н., академик НАН РК, профессор, главный научный сотрудник, РГП «Институт микробиологии и вирусологии» КН МОН РК, г. Алматы;
Жуматов К.Х., д.б.н., профессор, главный научный сотрудник, РГП «Институт микробиологии и вирусологии» КН МОН РК, г. Алматы.
Источник