Валидированная система разделяющая зоны хранения лекарственных препаратов что это
Статья, подготовленная специалистами Тэсто Рус, отвечает на следующие, очень распространённые вопросы относительно процесса валидации:
Что такое валидация фармацевтического склада?

На практике, валидация заключается в проверке способности определённого инженерного оборудования склада (системы вентиляции, холодильных агрегатов, и т.п.) выполнять свои функции так, чтобы поддерживать условия хранения в допустимых пределах.
Результатом валидационных мероприятий является документация, подтверждающая вышеизложенное.
Почему необходимо проводить валидацию?

Несмотря на то, что GMP в России на законодательном уровне введено пока только для производителей, в Европе и Америке также существуют дополнительные нормы надлежащих практик, затрагивающие всю цепочку поставки от производителя до конечного потребителя (например, GDP/GSP – надлежащая практика дистрибьюции/хранения) а также иные процессы, прямо или косвенно оказывающие влияние на качество (GLP/GEP/GAMP – надлежащая лабораторная практика/проектирование/автоматизация).
Необходимо подчеркнуть, что все надлежащие практики нацелены не на исправление каких-либо негативных факторов, а на предотвращение их возникновения в принципе.
В целом, контроль за соблюдением норм GxP ложится на производителя. Иными словами, производителю желательно иметь подтверждение от всех контрагентов, занятых в цепочке поставок от заводского склада готовой продукции до точек реализации, в том, что они также придерживаются надлежащих практик. Это снижает риски негативного влияния на готовую продукцию. Конечно, с одной стороны они не могут обязывать дистрибьютора следовать тем или иным рекомендациям, но с другой стороны, они также вправе не заключать контракт с контрагентом, не следующим нормам GxP.
Какие работы могут выполняться при валидации?
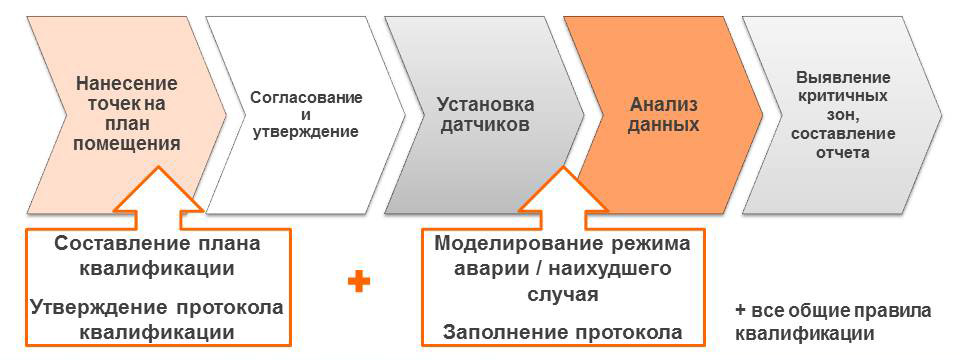
Базовым видом работ по валидации фармацевтического склада является температурное картирование (temperature mapping).
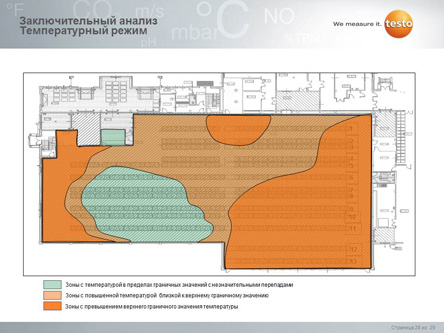
По результатам мэппинга можно сделать вывод о соответствии склада его назначению и принять корректирующие меры (после чего опять сделать мэппинг и подтвердить, что меры возымели эффект). Отдельно необходимо подчеркнуть, что мэппинг целесообразно проводить 1 раз в сезон (итого 4 раза в год), так как, в зависимости от сезона, могут изменяться зоны температурной неоднородности. В случае, если на складе были сделаны существенные изменения (например, установлены или модернизированы системы вентиляции/кондиционирования и отопления, перемещены стеллажи и т.д.) необходимо провести мэппинг повторно.
Также целесообразно один раз в определенный срок (например, раз в три года, при условии, что на складе не были сделаны существенные изменения) проводить контрольный мэппинг, подтверждающий, что условия хранения не изменились.
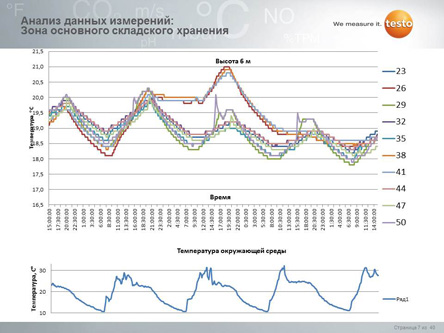
Что дальше?
Однако валидацией дело обычно не заканчивается. Так, правилами GxP прямо предписано проводить регулярный мониторинг всех факторов, оказывающих влияние на качество. Таким образом, касательно режимов хранения необходимо проводить мониторинг и документирование параметров хранения (температура/влажность).
Лучшим решением этой проблемы являются автоматизированные системы мониторинга параметров микроклимата.
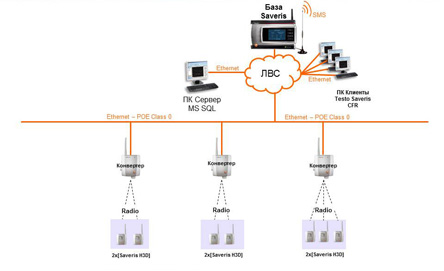
Важнейшим преимуществом использования testo Saveris является то, что измеренные значения собираются автоматически и защищены от потери или искажения в процессе обработки. Кроме того, нет необходимости загружать персонал измерениями и записью данных в журнал вручную, поскольку к подобной документации инспектора относятся крайне скептически из-за высокого влияния человеческого фактора на точность и достоверность данных.

Хотя это и не отменяет необходимость проводить валидацию системы мониторинга (SAT/IQ/OQ/PQ), однако существенно снижает объем работ по валидации (валидация алгоритмов ПО – один из самых затратных разделов)
Источник
Хранение лекарственных препаратов в аптеке: температурный режим и влажность.
Чтобы обеспечить качество, безопасность и эффективность лекарственных препаратов (ЛП) для наших покупателей, необходимо сохранить исходные свойства ЛС, для этого важно четко соблюдать температурный режим и следить за влажностью.
На твердой почве
Основные документы, которые регламентируют нормы хранения – это:
- Общая фармакопейная статья ОФС 1.1.0010.18 «Хранение лекарственных средств» Государственная Фармакопея (ГФ) XIV издания Том I. В ней мы можем найти общую информацию по хранению ЛС, требования к помещениям, оборудованию, контролю, а также по режимам хранения для различных групп лекарственных средств.
- Приказ Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. N 706н «Об утверждении правил хранения лекарственных средств» . Устанавливает требования к помещениям для хранения ЛС и регламентирует условия хранения ЛС.
- Приказ Министерства здравоохранения РФ от 31 августа 2016 г. N 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения». Приказом утверждены требования к условиям хранения и перевозки ЛП, в том числе минимизирующие риск проникновения фальсифицированных, недоброкачественных, контрафактных лекарственных препаратов в гражданский оборот.
- Постановление Роспотребнадзора от 17 февраля 2016 года N 19 Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов » .
Где смотреть условия хранения и почему это важно?
Для каждого ЛС производитель устанавливает условия хранения, которые включаются в (1) соответствующую фармакопейную статью, (2) нормативную документацию, (3) инструкцию по медицинскому применению (для ЛП) и (4) отображаются в маркировке ЛС. Каждый день в аптеку поступает большое количество ЛП. И каждый препарат необходимо расположить в соответствии с его условиями хранения. На практике, в процессе приемки и распределения по местам хранения, информацию по условиям хранения того или иного ЛП фармацевтические работники всегда могут проверить в инструкции и на упаковке ЛП. В идеальном мире каждый фармацевтический работник осознает свою ответственность за надлежащее хранение ЛП, ведь на кону стоит здоровье человека.
Следует отметить также, что соблюдение правил хранения ЛП является одним из лицензионных требований для аптечных организаций и очень серьезно проверяется контролирующими органами. Поэтому каждый лично и аптека, в целом, заинтересованы в том, чтобы хранение ЛП в аптеке соответствовало всем правилам, в т.ч. по части режимов хранения.
Какие температурные интервалы существуют?
В Государственной Фармакопее XIV приводится таблица соответствия режима хранения, указанного на упаковке и температурного интервала, в пределах которого возможно хранение ЛС.
Таблица 1. — Определения, характеризующие режимы хранения лекарственных средств
Режим хранения
Температурный интервал, °С
Хранить при температуре не выше 30 °С
Хранить при температуре не выше 25 °С
Хранить при температуре не выше 15 °С
Хранить при температуре не выше 8 °С
Хранить при температуре не ниже 8 °С
Хранить при температуре от 15 до 25 °С
Хранить при температуре от 8 до 15 °С
Хранить при температуре от -5 до -18 °С
Хранить при температуре ниже -18 °С
Не требует специальных условий хранения
без требований к свето- и влагозащитной упаковке
Не ниже +2 °С, если иное
не указано в фармакопейной статье или нормативной документации
Фармакопея XIV также дает соответствие температурного интервала обозначениям на упаковке.
Таблица 2. — Соответствие температуры хранения обозначению на упаковке.
не допуская замораживания
от 15 до 25 °С или, в зависимости от климатических условий, до 30 °С.
для наших климатических условий это до 25 °С
Что делать, если условия хранения ЛС не указаны?
Для большинства препаратов в нормативной документации не указаны специальные условия хранения. Это означает, что ЛС следует хранить при температуре от 15 до 25°С. При этом, в соответствии с требованиями общей фармакопейной статьи ОФС.1.1.0010.18 «Хранение лекарственных средств» ГФ XIV , относительная влажность должна поддерживаться на уровне 60 ±5% в зависимости от соответствующей климатической зоны (I, II, III, IVA, IVБ).
I – умеренный климат,
II – субтропический или средиземноморский климат,
III – жаркий и сухой климат,
IVA – жаркий и влажный климат,
IVБ – жаркий и очень влажный климат.
На территории России есть только I и II зоны.
Раньше влажность могла быть меньше 55%. А теперь нет?
Действительно, в ГФ XIII в статье ОФС.1.1.0010.15 «Хранение лекарственных средств» требование влажности для ЛС с неуказанными специальными условиями, было прописано как « не более 60 ± 5% в зависимости от соответствующей климатической зоны (I, II, III, IVA, IVB), если специальные условия хранения не указаны в нормативной документации ». То есть, минимальное значение не было задано. Учитывая, что для зоны I среднее значение относительной влажности – 45%, а для зоны II – 60%, то соблюдение условий не было сложной задачей. В случае влажности выше 65%, достаточно было просто открыть форточку, либо включить кондиционер, которым сейчас оборудована почти любая аптека. Поддерживать же влажность в узких пределах от 55 до 65% , как прописано в ГФ XIV, уже сложнее, учитывая тот факт, что повышенная влажность не характерна для наших климатических зон, а в зимний период центрального отопления воздух в помещениях дополнительно осушается. Значит, необходимо дополнительное оборудование в виде увлажнителей для небольших аптек либо специальные системы контроля микроклимата для крупных.
Сейчас влажность зависит от зоны?
На фоне нового требования вводят в тупик сохранившееся уточнение « в зависимости от соответствующей климатической зоны» . В какой именно зависимости – не разъясняется. Вразумительного и четкого ответа, как интерпретировать данные требования, пока нет. Часть фармацевтического сообщества сочла замену « не более » на « на уровне » в ГФ XIV упущением и случайной ошибкой и, в связи с этим, направляют в Минздрав запросы об исправлении ОФС 1.1.0011.15. Аргументом «за» опечатку является тот факт, что в фармакопейной статье по хранению лекарственного растительного сырья и лекарственных растительных препаратов требования к влажности остались как « не более 60 ±5% » Как бы то ни было, новая ОФС уже начала действовать и все, что мы можем из нее уяснить касаемо влажности – это то, что она не должна выходить из пределов 60 ±5% как в меньшую, так и в большую сторону.
UPD : В период подготовки статьи произошли долгожданные изменения в законодательстве.
В общей фармакопейной статье ОФС.1.1.00.10.18 «Хранение лекарственных средств» изменена формулировка по влажности, вызывавшая множество вопросов и недоумений.
Было: Хранение лекарственных средств осуществляется при относительной влажности 60±5% в зависимости от соответствующей климатической зоны (I, II, III, IVА, IVБ), если специальные условия хранения не указаны в нормативной документации.
Стало: Хранение лекарственных средств осуществляется при относительной влажности не более 65 % в зависимости от соответствующей климатической зоны (I, II, III, IVА, IVБ), если специальные условия хранения не указаны в нормативной документации.
Как видим, по сути, возвращена прежняя более логичная норма с небольшим отличием: убран диапазон ±5%.
Как и ожидалось фармсообществом, ошибка, упущение или недочет (что это было, мы можем только предполагать) Минздравом был исправлен, вопросы о том, зачем это было и как это реализовать отпали и аптеки могут вздохнуть с облегчением.
Эта загадочная «сухая зона» – для чего она нужна?
ГФ XIV говорит нам, что есть влагочувствительные и гигроскопичные ЛС, требующие влажности ниже, прописанной для большинства препаратов. Влагочувствительные и гигроскопичные ЛС требуют поддержания влажности на уровне не более 50% . Как правило, они имеют маркировку «хранить в сухом месте».
К влагочувствительным относятся ЛС, способные при контакте с водой выделять газы и т.п. Например: натрия гидрокарбонат, ацетилсалициловая кислота, димедрол, сухие экстракты, растительное лекарственное сырье, антибиотики, ферменты, сухие органопрепараты.
Гигроскопичные ЛС способны поглощать влагу из воздуха. Например: этанол, глицерин, концентрированный раствор гидроксида натрия, безводный хлорид кальция. Требование «сухого места» больше актуально для фармацевтических субстанций. При этом, Приказ Минздрава по хранению ЛС (Приказ от 23 августа 2010 г. N 706н «Об утверждении правил хранения лекарственных средств») в п. 27 дополнительно требует хранить фармацевтические субстанции, требующие защиты от влаги при температуре не выше 15 °С.
Что же касается ЛП, ситуация здесь немного другая. ЛП – это лекарственное вещество, облеченное производителем в стабильную лекарственную форму. Для обеспечения общих условий хранения, учитывая вышеупомянутые свойства действующих веществ, производитель заключает ЛП в первичную и вторичную влагонепроницаемые упаковки.
Тем не менее, на практике встречается маркировка на готовых ЛП «хранить в сухом месте». Это чаще всего означает, что его упаковка не обеспечивает должной защиты от влаги. Например, такое требование можно встретить на ЛП «Аскорбиновая кислота с глюкозой», «Цитрамон», «Ацетилсалициловая кислота», «Парацетамол» в бумажных блистерах по 10 таблеток разных производителей. Но вот чем обоснована такая маркировка на других ЛП, например, на сиропе «Нурофен», сказать трудно. Это может быть связано с процессом маркировки. При регистрации ЛС национальные уполномоченные органы (экспертные организации) стран бывшего СССР упорно требуют наличие «сухой» метки для каждого ЛП.
Какой мы можем сделать из этого вывод в плане организации хранения? Поскольку фактически на части ЛП существует маркировка «хранить в сухом месте», это значит, что при хранении таких ЛП необходимо создать условия, чтобы относительная влажность воздуха не превышала 50% при комнатной температуре (при нормальных условиях хранения).
Существуют ли «сухие места» в реальных аптечных организациях?
Этот вопрос тесно связан с другим: «А существует ли идеальная аптека?». Ничего идеального не бывает, но стремиться соответствовать надо, тем более если есть законные требования, пусть не всегда обьяснимые для конкретного ЛП. Из шести аптек, в которых я работала, ни в одной не было разделения на зоны с разной влажностью. Теоретически, если в аптечный ассортимент поступают препараты с такой маркировкой, оно должно быть, а это дополнительные затраты и, вероятно, неудобства. Как же аптеки решают данную проблему?
Большинство аптек поступают просто. При общих требованиях влажности «не более 65%» и требовании до 50% для сухого места поддерживают влажность до 50% во всех помещениях хранения не разделяя на зоны. Формально этого достаточно для выполнения фармакопейных условий и менее затратно. Для тех же аптек, которые все-таки решили выделить отдельную зону для влагочувствительных препаратов, можно дать следующие рекомендации. Разделение зон лучше производить с учетом температурного картирования (изучения распределения температуры в данном помещении). Для влагочувствительных препаратов лучше выбирать места ближе к радиаторам отопления подальше от окон. В зависимости от результатов картирования, аптеку следует оборудовать увлажнителем, осушителем, либо и тем и другим.
До 01.12.2018, а именно до выхода ГФ XIV аптекам было проще. При общих требованиях влажности «не более 60 ±5%» и требовании до 50% для сухого места достаточно было поддерживать влажность до 50% во всех помещениях хранения не разделяя на зоны. Сейчас же вопрос разделения на зоны стоит неотвратимо, поскольку совместить два непересекающихся режима «в пределах 60 ±5%» и «не более 50%» попросту невозможно. Для исполнения новых требований аптекам понадобится произвести зонирование и, скорее всего, приобрести дополнительное оборудование в виде увлажнителя и/или осушителя. Разделение зон лучше производить с учетом температурного картирования (изучения распределения температуры в данном помещении). Для влагочувствительных препаратов лучше выбирать места ближе к радиаторам отопления подальше от окон. В целом, большинство аптек пока стоят на пороге неизбежных перемен.
Какие ЛП хранятся в холодильниках?
Термочувствительные (термолабильные) ЛС , т.е. ЛС, которые могут изменять свои свойства под воздействием комнатной и более высокой температуры или под воздействием пониженной температуры, в том числе при замораживании, как правило, хранятся в холодильниках. В холодильниках должна быть установлена температура, соответствующая температурному режиму хранения находящихся в них ЛС. На практике это холодильники с режимами от 2 до 8 °С и от 8 до 15 °С.
Особое внимание следует уделить ЛП, требующим защиты от замораживания. На их упаковке и в инструкции будет дополнительно прописано требование «не замораживать» . В основном, это касается иммунобиологических лекарственных препаратов (ИЛП), для которых температурный режим должен соблюдаться особо строго.
Не допускается замораживать препараты инсулина, адсорбированные иммунобиологические препараты (вакцины), а также растворители для вакцин при их транспортировании и хранении (Постановление от 17 февраля 2016 года N 19 Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов » ).
Не допускается подвергать замораживанию ЛС, помещенные в упаковку, способную разрушаться при замораживании, например, лекарственные препараты в ампулах, стеклянных флаконах и др.
Что такое ИЛП и почему выделены отдельно?
Согласно п. 7 понятийной ст. 4 Федерального закона «Об обращении лекарственных средств» (№ 61‑ФЗ от 12.04.2010), под этим понятием имеются в виду ЛП, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. ИЛП требуют особо строгого соблюдения требований обращения. Для ИЛП отдельно разработан документ СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов». ИЛП очень лабильны, например, нарушение правил и условий хранения вакцин является одной из основных причин развития поствакцинальных осложнений. Уже одно это говорит о важности надлежащего обращения с этой группой препаратов на всех этапах «холодовой цепи». Транспортирование и хранение большинства ИЛП, в том числе содержащих в упаковке растворитель, осуществляется при температуре в пределах от +2°С до +8°С включительно.
Можно ли хранить ИЛП в общем холодильнике с температурой от +2°С до +8°С?
Нет. Совместное хранение в холодильнике иммунобиологических лекарственных препаратов с другими лекарственными средствами не допускается. А это значит, что для ИЛП необходим отдельный холодильник. Подробнее о хранении ИЛП мы расскажем следующих публикациях.
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Чтобы оставить комментарий к статье, вам нужно зарегистрироваться или войт
Источник