Как и когда используют гемостатики
В норме в организме человека имеются две сбалансированные системы: свертывающая и противосвертывающая. Первая препятствует длительному обильному кровотечению, вторая — предупреждает образование тромбов. Способность крови свертываться — важный защитный механизм, предохраняющий от гибели в результате потери крови. Но он не всегда справляется с задачей. В хирургии, травматологии, медицине катастроф, при гемофилии без гемостатиков просто не обойтись.
Из истории гемостатических средств
Не одно столетие известны лекарственные травы, обладающие кровоостанавливающим действием. Пастушья сумка, тысячелистник, листья крапивы использовались древними лекарями в качестве гемостатиков. Давно известны кровоостанавливающие действия настойки горца перечного, отвара коры калины обыкновенной, листьев подорожника. С испокон веков к открытой ране прикладывали сухой мох. Но травы проблему почти не решали, смертность от кровопотери оставалась высокой. Требовались более действенные средства, а дело продвигалось не быстро.
Только в 1883 г научные исследования привели французского биолога G. Hayem к открытию тромбоцита. В 1890 г была доказана роль кальция в свертывании крови. В 1916 г был открыт, а в 1918 — описан гепарин — вещество, препятствующее коагуляции крови. В 1931 г канадский ветеринар случайно открыл варфарин — антикоагулянт непрямого действия. Основной физиологический антикоагулянт — протеин С — открыт и описан в 1976 г. Когда враг выявлен, с ним легче бороться. Последовательное открытие и описание действия трех антикоагулянтов позволило ученым начать разработку новых гемостатических средств. С конца 60-х годов прошлого века постепенно началось производство эффективных кровоостанавливающих препаратов. Сегодня медицина располагает широким разнообразием современных гемостатиков.
Виды гемостатиков
Кровоостанавливающие средства делят на средства резорбтивного и местного действия. Гемостатический эффект кровоостанавливающих средств
- резорбтивного действия наступает при введении препаратов данной группы в кровь, а
- местногодействия — при их непосредственном контакте с кровоточащими тканями.
По влиянию на механизм гемостаза среди кровоостанавливающих средств обеих групп выделяют специфические и неспецифические средства.
Специфические средства имеют в составе свертывающие компоненты крови или вещества, напрямую влияющие на свертывание. К специфическим препаратам резорбтивного действия относится плазма, обогащенная тромбоцитами, эритропоэтин, стимулирующий образование эритроцитов и др.
Неспецифические средства оказывают на систему свертывания крови непрямое влияние — адреналин (или эпинефрин) местно, сужающий сосуды, перекись водорода.
В зависимости от характера кровотечения, особенностей пациента и расположения раны на теле в качестве местных гемостатиков в современной медицине применяют:
- синтетический или фибриновый клей (герметик);
- средства на основе желатина;
- окисленную восстановленную целлюлозу.
Современные средства остановки крови
Применение высоко-результативных гемостатиков во многих областях медицины:
- сокращают время проведения различных операций;
- уменьшают требующееся количество донорской крови;
- обеспечивают проведение сложных лечебных и операционных процедур.
Гемостатический порошок Starsil Hemostat (Старсил гемостат) не требует подготовки перед применением, используется немедленно после вскрытия упаковки при операциях или ранениях. Попадая на рану, мелкие частички препарата быстро впитывают в себя воду, входящую в состав крови, образуя гель. Новое вещество закупоривает поврежденные сосуды и таким образом задерживает или останавливает кровотечение.
Серия гемостатиков Surgicel (Серджисел) изготавливается из окисленной восстановленной целлюлозы, взятой из природы. Выпускается в виде:
- многослойного пористого материала, принимающего любую форму — фибрилляр;
- ткани плотного плетения, позволяющей прошивать и оборачивать кровоточащие органы — нью-нит;
- тонкой сеточки для малоинвазивных операций.
Все продукты Surgicel стерильны, не требуют приготовления, обладают бактерицидным эффектом, рассасываются за 7-14 дней.
Spongostan (Спонгостан) — рассасывающиеся гемостатические губки и пудра на основе желатина — применяются в мировой хирургической практике более 60 лет. Востребованность обеспечивается:
- быстрым приготовлением;
- гемостазом до 2 мин;
- 3-4 недельным рассасыванием;
- биологической инертностью;
- широким спектром применения — ортопедия, травматология, челюстно-лицевая хирургия, детская хирургия, нейрохирургия на черепе и позвоночнике.
Surgiflo (Серджифло) — стерильная пенообразная матрица из свиного желатина с тромбином:
- время приготовления — 30 сек;
- время использования — 24 ч;
- время гемостаза — меньше 4-х минут;
- адаптируется и плотно прилегает ко всем типам поверхностей за счет текучей формы;
- возможно нанесение в труднодоступные кровоточащие места с помощью аппликатора.
Применяется в гинекологии, урологии, ЛОР-хирургии, сердечно-сосудистой, общей и нейрохирургиях.
Фибриновый клей Evicel (Ивисел) применяется как дополнительный способ гемостаза (в случае недостаточности стандартных средств) и герметизации сосудистого шва. Смешивание действующих компонентов — фибриногена и тромбина — происходит с помощью специального аппликаторного устройства непосредственно перед раной. Образующийся сгусток мгновенно закупоривает открытый кровяной сосуд и образует прозрачную эластичную пленку. Применяется в нейро-, кардио-, сосудистой хирургии, гинекологии, урологии, общей хирургии. Evicel изготавливается только на основе человеческих компонентов.
Хирургический синтетический клей Omnex (Омнекс) — состоит из смеси двух синтетических мономеров. Тонкий слой Омнекса приклеивается к тканям, образуя прочную эластичную кровоостанавливающую пленку. Применяется при герметизации хирургических швов.
Из истории гемостатических средств
Не одно столетие известны лекарственные травы, обладающие кровоостанавливающим действием. Пастушья сумка, тысячелистник, листья крапивы использовались древними лекарями в качестве гемостатиков. Давно известны кровоостанавливающие действия настойки горца перечного, отвара коры калины обыкновенной, листьев подорожника. С испокон веков к открытой ране прикладывали сухой мох. Но травы проблему почти не решали, смертность от кровопотери оставалась высокой. Требовались более действенные средства, а дело продвигалось не быстро.
Только в 1883 г научные исследования привели французского биолога G. Hayem к открытию тромбоцита. В 1890 г была доказана роль кальция в свертывании крови. В 1916 г был открыт, а в 1918 — описан гепарин — вещество, препятствующее коагуляции крови. В 1931 г канадский ветеринар случайно открыл варфарин — антикоагулянт непрямого действия. Основной физиологический антикоагулянт — протеин С — открыт и описан в 1976 г. Когда враг выявлен, с ним легче бороться. Последовательное открытие и описание действия трех антикоагулянтов позволило ученым начать разработку новых гемостатических средств. С конца 60-х годов прошлого века постепенно началось производство эффективных кровоостанавливающих препаратов. Сегодня медицина располагает широким разнообразием современных гемостатиков.
Виды гемостатиков
Кровоостанавливающие средства делят на средства резорбтивного и местного действия. Гемостатический эффект кровоостанавливающих средств
- резорбтивного действия наступает при введении препаратов данной группы в кровь, а
- местногодействия — при их непосредственном контакте с кровоточащими тканями.
По влиянию на механизм гемостаза среди кровоостанавливающих средств обеих групп выделяют специфические и неспецифические средства.
Специфические средства имеют в составе свертывающие компоненты крови или вещества, напрямую влияющие на свертывание. К специфическим препаратам резорбтивного действия относится плазма, обогащенная тромбоцитами, эритропоэтин, стимулирующий образование эритроцитов и др.
Неспецифические средства оказывают на систему свертывания крови непрямое влияние — адреналин (или эпинефрин) местно, сужающий сосуды, перекись водорода.
В зависимости от характера кровотечения, особенностей пациента и расположения раны на теле в качестве местных гемостатиков в современной медицине применяют:
- синтетический или фибриновый клей (герметик);
- средства на основе желатина;
- окисленную восстановленную целлюлозу.
Современные средства остановки крови
Применение высоко-результативных гемостатиков во многих областях медицины:
- сокращают время проведения различных операций;
- уменьшают требующееся количество донорской крови;
- обеспечивают проведение сложных лечебных и операционных процедур.
Гемостатический порошок Starsil Hemostat (Старсил гемостат) не требует подготовки перед применением, используется немедленно после вскрытия упаковки при операциях или ранениях. Попадая на рану, мелкие частички препарата быстро впитывают в себя воду, входящую в состав крови, образуя гель. Новое вещество закупоривает поврежденные сосуды и таким образом задерживает или останавливает кровотечение.
Серия гемостатиков Surgicel (Серджисел) изготавливается из окисленной восстановленной целлюлозы, взятой из природы. Выпускается в виде:
- многослойного пористого материала, принимающего любую форму — фибрилляр;
- ткани плотного плетения, позволяющей прошивать и оборачивать кровоточащие органы — нью-нит;
- тонкой сеточки для малоинвазивных операций.
Все продукты Surgicel стерильны, не требуют приготовления, обладают бактерицидным эффектом, рассасываются за 7-14 дней.
Spongostan (Спонгостан) — рассасывающиеся гемостатические губки и пудра на основе желатина — применяются в мировой хирургической практике более 60 лет. Востребованность обеспечивается:
- быстрым приготовлением;
- гемостазом до 2 мин;
- 3-4 недельным рассасыванием;
- биологической инертностью;
- широким спектром применения — ортопедия, травматология, челюстно-лицевая хирургия, детская хирургия, нейрохирургия на черепе и позвоночнике.
Surgiflo (Серджифло) — стерильная пенообразная матрица из свиного желатина с тромбином:
- время приготовления — 30 сек;
- время использования — 24 ч;
- время гемостаза — меньше 4-х минут;
- адаптируется и плотно прилегает ко всем типам поверхностей за счет текучей формы;
- возможно нанесение в труднодоступные кровоточащие места с помощью аппликатора.
Применяется в гинекологии, урологии, ЛОР-хирургии, сердечно-сосудистой, общей и нейрохирургиях.
Фибриновый клей Evicel (Ивисел) применяется как дополнительный способ гемостаза (в случае недостаточности стандартных средств) и герметизации сосудистого шва. Смешивание действующих компонентов — фибриногена и тромбина — происходит с помощью специального аппликаторного устройства непосредственно перед раной. Образующийся сгусток мгновенно закупоривает открытый кровяной сосуд и образует прозрачную эластичную пленку. Применяется в нейро-, кардио-, сосудистой хирургии, гинекологии, урологии, общей хирургии. Evicel изготавливается только на основе человеческих компонентов.
Хирургический синтетический клей Omnex (Омнекс) — состоит из смеси двух синтетических мономеров. Тонкий слой Омнекса приклеивается к тканям, образуя прочную эластичную кровоостанавливающую пленку. Применяется при герметизации хирургических швов.
Источник
Гемостатические средства
Гемостатические средства — лекарственные средства, способствующие остановке кровотечений. Все гемостатики, в зависимости от механизма действия, подразделяются на три большие группы:
- ингибиторы фибринолиза (антифибринолитики);
- средства, усиливающие свертывание крови (коагулянты);
- средства, понижающие сосудистую проницаемость.
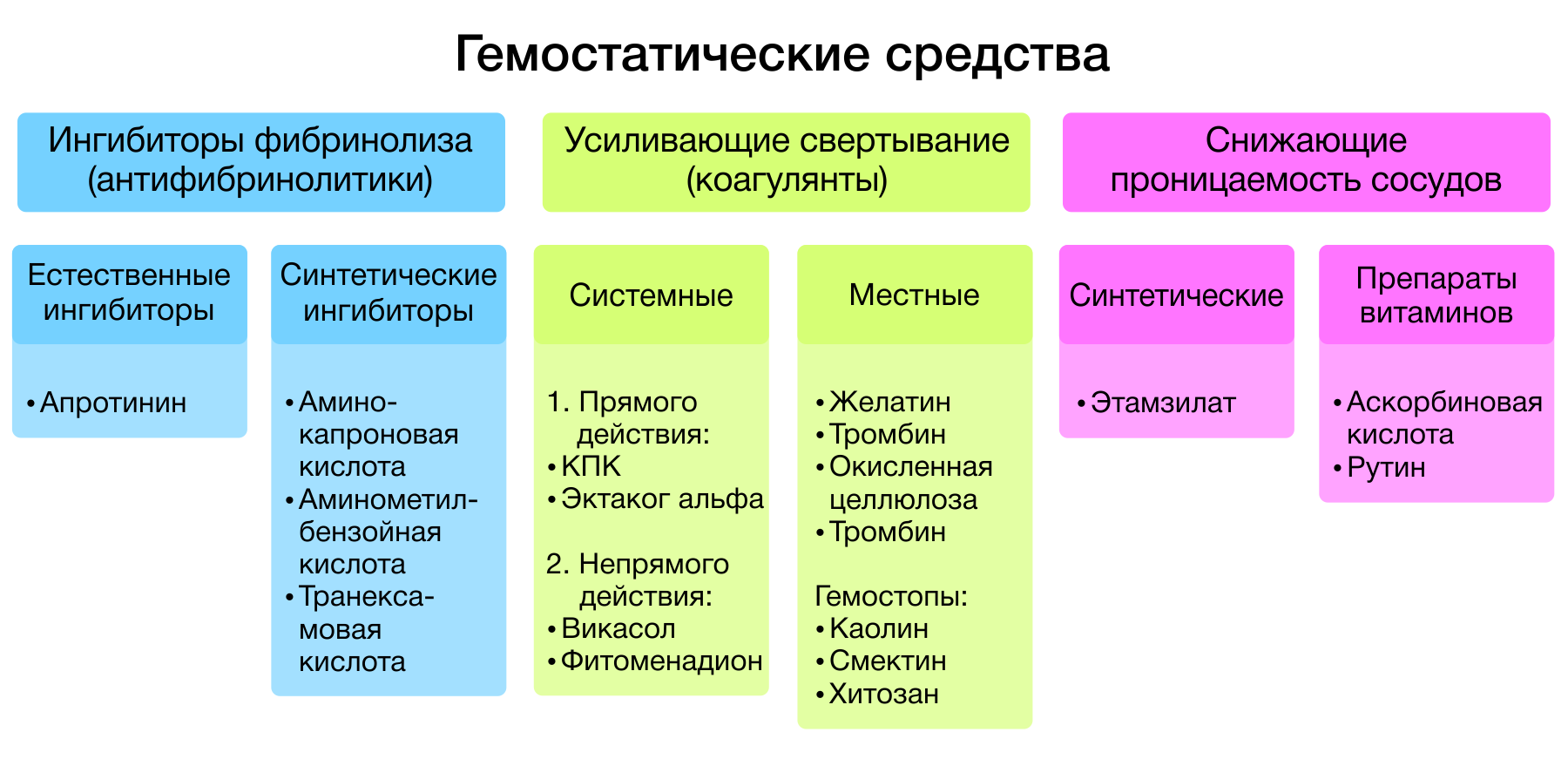
Рисунок 1 | Классификация гемостатиков.
1. Ингибиторы фибринолиза.
В клинической практике широкое распространение получили две группы препаратов ингибиторов фибринолиза: естественные ингибиторы фибринолиза (апротинин и его аналоги) и синтетические ингибиторы фибринолиза (аминокапроновая кислота, аминометилбензойная кислота, транексамовая кислота).
Апротинин — полипептид, получаемый из легких, поджелудочной и околоушной желез крупного рогатого скота, действующий аналогично α2-антиплазмину. Апротинин разрушает свободный плазмин, практически не взаимодействует со связанным плазмином, а также угнетает активацию тромбоцитов. Являясь сериновой протеазой, апротинин блокирует калликреин-кининовую систему путем разрушения калликреина, снижает активность отдельных протеолитических ферментов, таких как: трипсин, химотрипсин, кининогеназа. Изначально препарат был включен в рекомендации по лечению острого панкреатита и панкреонекроза, однако не подтвердил свою эффективность, и показания к его применению были пересмотрены.[1]
Аминокапроновая кислота – 6-аминогексановая кислота — синтетическое производное лизина. Присоединяясь к лизин-связывающему участку плазминогена, аминокапроновая кислота обратимо блокирует процесс фибринолиза, снижает активность стрептокиназы, урокиназы, тканевых киназ, калликреина, трипсина и гиалуронидазы. Аналогичным фармакологическим эффектом обладает производное аминокапроновой кислоты — аминометилбензойная кислота, отличающаяся улучшенной фармакокинетикой. Аминокапроновая кислота снижает активность тромболитических препаратов и может быть использована для нейтрализации их эффекта.
Транексамовая кислота — транс-4-(аминометил)-циклогексанкарбоновая кислота — обратимо блокирует эффект плазминогена, адгезию лейкоцитов и тромбоцитов на поверхность тромба за счет конкурентного ингибирования активатора плазминогена. Оказывает противоаллергическое и противовоспалительное действие посредством подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. По мощности антифибринолитического действия транексамовая кислота значительно превосходит аминокапроновую кислоту. Активность препарата в плазме сохраняется на протяжении 7-8 часов, в тканях — до 17 часов.[2]
У больных с высоким риском массивной кровопотери в плановой хирургии (сердечно-сосудистая хирургия, травматология и ортопедия, трансплантология) применение ингибиторов фибринолиза уменьшает интраоперационную кровопотерю и снижает потребность в трансфузии донорской крови. На протяжении 20 лет проводилось множество исследований, результаты которых были неоднозначны: мнения склонялись то в пользу апротинина, то в пользу синтетических производных лизина.
В 2007 году компания Bayer завершила исследование BART (Blood conservation using antifibrinolytics in a randomized trial), в котором было изучено действие апротинина у кардиохирургических больных высокого риска. Исследователи выявили большой риск летальных исходов и осложнений при использовании апротинина. В группе апротинина количество больных с массивной кровопотерей было несколько меньше, но 30-дневная летальность на 50% превышала аналогичный показатель в других группах.[3]
После публикации результатов BART компания Bayer уведомила Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) о намерении изъять апротинин с рынка. Показания к назначению были пересмотрены, и препарат был исключен из списка безопасных лекарственных средств.
Огромный мета-анализ позволил сделать вывод, что транексамовая кислота обеспечивает такое же снижение периоперационной трансфузии, какое наблюдается при использовании апротинина, но более безопасна. Согласно рекомендациям Европейского общества анестезиологов по ведению пациентов с массивной периоперационной кровопотерей (2013 г.), при массивном кровотечении рекомендуется применение транексамовой кислоты (20-25 мг/кг); она может быть введена повторно или применяться в виде пролонгированной инфузии (1-2 мг/кг/ч).[4]
2. Препараты, усиливающие свертывание крови
Среди средств, повышающих скорость свертывания крови, выделяют: средства системного действия и для местного применения. К препаратам системного действия относят непрямые коагулянты (фитоменадион, менадиона натрия бисульфит) и коагулянты прямого действия (факторы свертывания: концентрат протромбинового комплекса, эптаког альфа).
Менадиона натрия бисульфит — синтетический водорастворимый аналог витамина К3. Субстратно стимулирует витамин K-редуктазу, активирующую витамин К и обеспечивающую его участие в печеночном синтезе витамин K-зависимых плазменных факторов гемостаза (II, VII, IX, X). Фитоменадион является синтетическим структурным аналогом витамина К1, обладает большей активностью и более ранним началом реализации эффектов (через 6-10 часов после перорального применения, против 18-24 часов у менадиона натрия бисульфита). Данная группа препаратов показана для коррекции нарушений системы гемостаза, вызванных дефицитом витамина К1, передозировкой антикоагулянтов непрямого действия (варфарина), а также для предоперационной профилактики кровотечений.
Концентрат протромбинового комплекса (КПК) — лекарственный препарат, содержащий факторы II, VII, IX, X, а также следовые концентрации антитромбина III, гепарина, протеинов С и S. Основным показанием к применению КПК служит коррекция приобретенного дефицита витамин К1-зависимых факторов в экстренных ситуациях (кровотечение, экстренная операция). Помимо этого, КПК широко используется как средство для лечения и профилактики кровотечений у пациентов с врожденным дефицитом одного из К1 зависимых факторов свертывания (врожденная гипопротромбинемия, врожденный дефицит фактора Стюарта – Прауэра).[5]
Эптаког альфа — рекомбинантный активированный VII фактор свертывания. Механизм действия препарата заключается в прямой активации фактора Х на поверхности активированных тромбоцитов. Это вызывает «тромбиновый взрыв» независимо от имеющейся концентрации факторов VIIIa и IXa. В результате образуется стабильный фибриновый сгусток. Считается, что эптаког альфа инициирует гемостаз только в месте повреждения ткани и не вызывает системной активации механизмов свертывания. Препарат был разработан для лечения кровотечений и проведения хирургических вмешательств у пациентов с наследственной или приобретенной гемофилией и высоким титром ингибитора факторов свертывания VIIIa или IXa. Его применение у пациентов с массивным кровотечением можно сформулировать согласно рекомендациям ESA (2013): «Применение рекомбинантного фактора VII возможно только при кровотечениях, которые не могут быть устранены хирургическими методами или путем комплексной гемостаз-корригирующей терапии». Необходимо серьезное обоснование для применения данного препарата [6].
3. Местные гемостатики
Местные гемостатики используются для остановки капиллярных и паренхиматозных кровотечений преимущественно в неотложной хирургии и стоматологии. Данная группа включает в себя широкий спектр препаратов с различным механизмом действия.
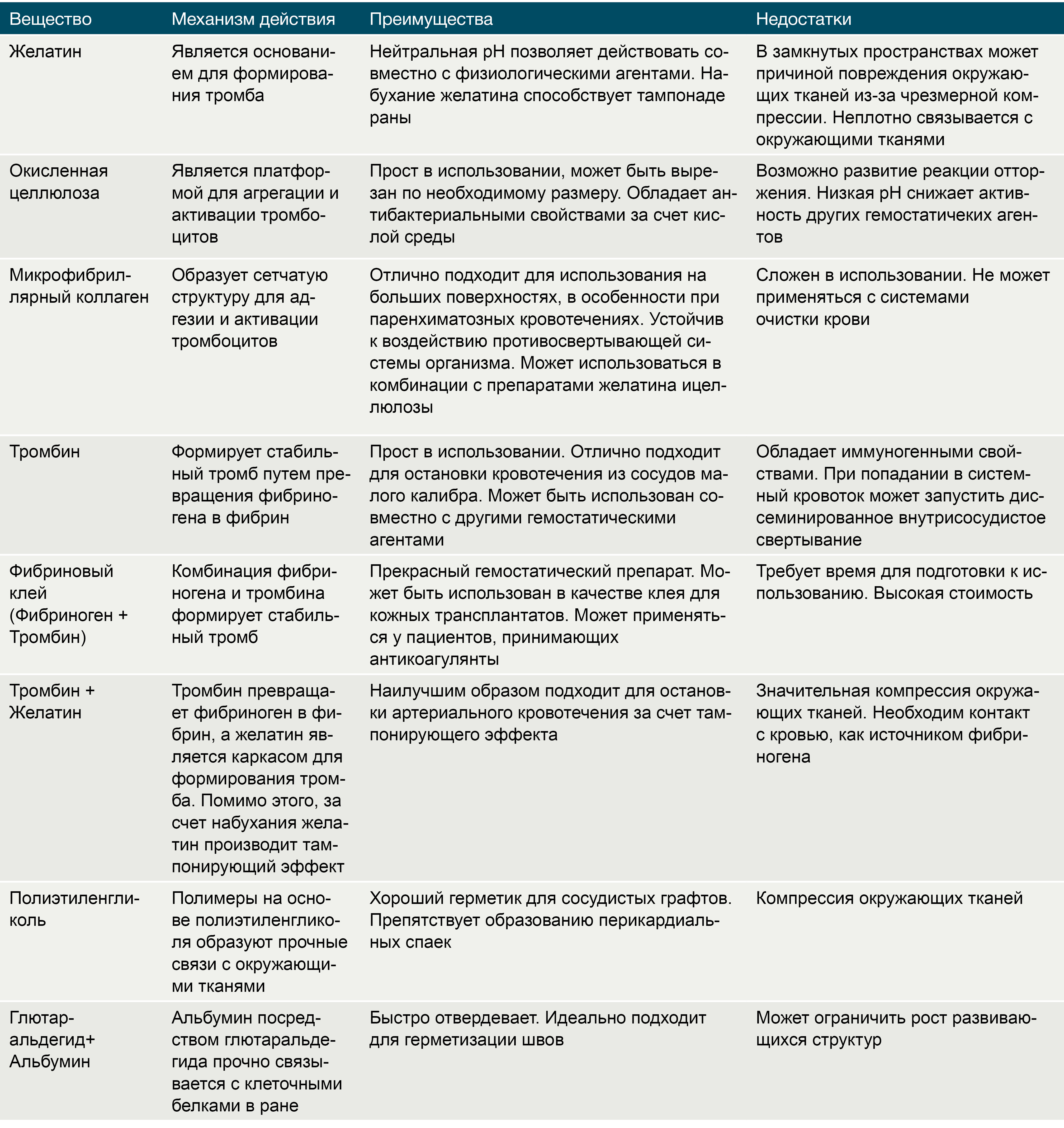
Препараты на основе желатина, получаемого из свиной кожи, существуют в трех формах: пленка, губка и порошок. Желатин чрезвычайно гигроскопичен, и за счет этого свойства он абсорбирует влагу, увеличиваясь в размерах и заполняя тканевой дефект. Существуют комбинации желатина с тромбином, которые помимо пассивного гемостатического эффекта напрямую запускают коагуляционный каскад и активируют тромбоциты в месте нанесения. Желатин разрушается протеиназами в течение 4-6 недель. Несмотря на абсолютную индифферентность, желатин может служить в качестве хронического очага инфекции. Помимо этого, одним из существенных недостатков данных препаратов является отсутствие прочных связей с окружающими тканями [7].
Тромбин является естественным компонентом свертывающей системы крови. Раствор тромбина используют только местно при капиллярных или паренхиматозных кровотечениях в ходе нейрохирургических вмешательств, операций на печени и почках, в стоматологической практике. Попадание тромбина в крупные кровеносные сосуды может вызвать распространенный тромбоз [7].
Окисленная целлюлоза выпускается в виде пленок, сеток, пучков и губок. Данный биологический агент играет роль субстрата для агрегации тромбоцитов и активации механизмов гемостаза. Целлюлоза значительно снижает рН среды, что приводит к лизису эритроцитов с образованием кислого гематина, который формирует дополнительный искусственный сгусток. Помимо этого окисленная целлюлоза обладает антибактериальным эффектом, в том числе в отношении антибиотикорезистентных микроорганизмов [7].
Микрофибриллярный коллаген, производимый из кожи крупного рогатого скота, имеет ряд преимуществ перед остальными топическими биологическими кровоостанавливающими агентами, среди которых: быстрый гемостатический эффект, минимальная реактивность тканей и высокая способность к реабсорбции. Аналогично целлюлозе, микрофибриллярный коллаген является матрицей для активации тромбоцитов, агрегации и образования тромбов [7].
Подвидом местных кровоостанавливающих средств являются гемостопы, получившие большое распространение в военной медицине. Это препараты внешнего воздействия, которые почти не влияют на свертывающую и противосвертывающую системы крови. Многообразие форм выпуска обеспечивает удобство применения в полевых условиях и полностью удовлетворяет потребностям оказания неотложной помощи при любых кровотечениях. На сегодняшний день наиболее эффективным средством считается хитозан.
Хитозан – это полисахаридный биополимер, получаемый из хитиновых панцирей ракообразных. Кровоостанавливающий эффект данного вещества достигается путем связывания хлопьев хитозана с отрицательно-заряженными эритроцитами и образования гелеобразного сгустка в месте контакта с кровью. Среди преимуществ препаратов на основе хитозана выделяют его антимикробные свойства, длительный срок хранения, стабильность при перепадах температур и безопасность при наружном использовании [8].
Наиболее известным представителем группы средств, понижающих сосудистую проницаемость, является этамзилат. Гемостатический эффект данного препарата обусловлен активацией тромбопластина в месте повреждения сосудов микроциркуляторного русла и снижением синтеза простациклина PGI-2 в эндотелии сосудов, что в конечном итоге приводит к усилению адгезии и агрегации тромбоцитов, остановке или уменьшению кровоточивости. За счет антигиалуронидазного действия этамзилат обладает ангиопротективным эффектом, улучшает микроциркуляцию и нормализует проницаемость сосудистой стенки при патологических процессах [9].
Источники
- Fergusson D. A. et al. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery //New England Journal of Medicine. – 2008. – Т. 358. – №. 22. – С. 2319-2331.
- Williams-Johnson J. A. et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial //West Indian Medical Journal. – 2010. – Т. 59. – №. 6. – С. 612-624.
- Ferraris V. A. et al. Perioperative blood transfusion and blood conservation in cardiac surgery: the Society of Thoracic Surgeons and The Society of Cardiovascular Anesthesiologists clinical practice guideline //The Annals of thoracic surgery. – 2007. – Т. 83. – №. 5. – С. S27-S86.
- Sedrakyan A., Treasure T., Elefteriades J. A. Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a systematic review and meta-analysis of randomized clinical trials //The Journal of thoracic and cardiovascular surgery. – 2004. – Т. 128. – №. 3. – С. 442-448.
- Song H. K. et al. Safety and efficacy of prothrombin complex concentrates for the treatment of coagulopathy after cardiac surgery //The Journal of thoracic and cardiovascular surgery. – 2014. – Т. 147. – №. 3. – С. 1036-1040.
- Shapiro A. D. et al. Prospective, randomised trial of two doses of rFVIIa (NovoSeven) in haemophilia patients with inhibitors undergoing surgery //Thrombosis and haemostasis. – 1998. – Т. 79. – №. 05. – С. 773-778.
- Achneck H. E. et al. A comprehensive review of topical hemostatic agents: efficacy and recommendations for use //Annals of surgery. – 2010. – Т. 251. – №. 2. – С. 217-228.
- McManus J. G., Wedmore I. Modern Hemostatic Agents for Hemorrhage Control â A Review and Discussion of Use in Current Combat Operations. – 2005.
- Okuma M. et al. Effects of etamsylate on platelet functions and arachidonic acid metabolism //Thrombosis and haemostasis. – 1982. – Т. 48. – №. 3. – С. 330-333.
Источник