- Тератогенность, эмбриотоксичность, фетотоксичность ЛС
- 117.Тератогенность и эмбрио- и фетотоксичность лекарств, применяемых во время беременности и при родах.
- 118.Противотуберкулезные и противогрибковын средства.
- 119.Виды действия и пути введения лекарственных веществ.
- Тератогенность эмбриотоксичность фетотоксичность лекарственных средств
- Тератогенность эмбриотоксичность фетотоксичность лекарственных средств
Тератогенность, эмбриотоксичность, фетотоксичность ЛС



Лекарственные средства, назначаемые женщинам во время беременности, могут оказывать отрицательное влияние на развитие эмбриона или плода.
Эмбриотоксическое действие (от греч. embryon — зародыш) ЛС развивается в первые 12 нед беременности. На ранних стадиях беременности (1-3 нед) оно является следствием д-я ЛС на зиготу и бластоцист, находящиеся в просвете фаллопиевых труб и матки (до имплантации), а также на процесс имплантации зародыша в матку. В результате этого развитие эмбриона нарушается. Эмбриотоксическое действие могут оказывать гормоны (эстрогены, гестагены, ДОКСА), антиметаболиты (меркаптопурин, фторурацил), антимитотические средства (колхицин и др.).
Тератогенное действие (от греч. teras — урод) развивается в период с 4-й по 8-ю неделю беременности. В это время происходит формирование скелета и закладка внутренних органов. На этой стадии беременности органы и ткани наиболее чувствительны к действию повреждающих факторов. Поэтому применение ЛС может привести к аномалиям развития скелета и внутренних органов. Примером тератогенного действия ЛС может служить так называемая «талидомидная катастрофа» — возникновение врожденных уродств у новорожденных в Западной Европе, Америке и Австралии, обусловленная приемом женщинами в ранние сроки беременности снотворного препарата талидомида. При его приеме чаще всего возникали аномалии развития конечностей — фекомелия (от греч. phoke — тюлень, melos — конечность). Верхние и нижние конечности ребенка имели форму ласт. Известно, что тератогенное действие могут оказывать противоопухолевые средства — антагонисты фолиевой кислоты (метотрексат), пероральные контрацептивы (их прием следует прекратить за несколько месяцев до планируемой беременности), спирт этиловый (принимаемый на фоне зачатия женщиной).
Фетотоксическое действие (от греч. fetus — плод) является следствием влияния ЛС на плод в период, когда у него уже сформировались внутренние органы и физиологические системы. Например, антикоагулянты могут ↓ свертывающую активность крови и провоцировать кровотечения у новорожденного, производные сульфонилмочевины — гипогликемию; алкоголь, наркотики, снотворные и транквилизаторы — угнетение ЦНС.
Мутагенное действие (от лат. mutatio — изменение и греч. genos -род) — это способность ЛС вызывать изменение генетического аппарата в женских и мужских половых клетках на стадии их формирования и в клетках эмбриона.
Поскольку ЛС способны вызывать гибель эмбриона и аномалии развития плода, применение их беременными женщинами должно находиться под строгим контролем.
Наркотические анальгетики, их классификация и фармакологическая характеристика. Рецепт. Токсикологическая характеристика наркотических анальгетиков. Принципы фармакотерапии при остром и хроническом отравлении. Роль студента-медика в профилактике наркомании.
Ситуационная задача. Для снижения АД при эклампсии больной М. Внутривенно струйно был введён гипотензивный препарат миотропного действия, в результате чего произошла остановка дыхания.
Источник
117.Тератогенность и эмбрио- и фетотоксичность лекарств, применяемых во время беременности и при родах.
Нежелательное действие лекарств может быть следствием прямого токсич влияния на плод, а также рез-том нарушений гемодинамики в фетоплацентарной системе, горм, вит, минерального баланса в организме берем женщины и плода.
-Эмбриотоксич эффект – повреждение неимплантированной бластоцисты, приводящее в большинстве случаев к ее гибели. Барбитураты, салицилаты, антиметаболиты, сульфаниламиды, никотин.
-Тератогенный эффект – в рез-те приема лекарств с 3 по 10 нед. Нарушение дифференцировки тканей плода. В рез-те пороки разв. Может ребенок быть не- и жизнеспособным, но инвалидом.
Чаще у женщин старше 40 лет и 12-14 лет. По степени опасности 3 гр лек средств:
1.Наиболее опасные: талидомид, андрогены, метотрексат.
2.Преп сред степ опасности: дифенин, фенобарбитал, противоэпилептич, цитостатики.
3.Менее опасные: салицилаты, левомиц тетрац, изониазид, фторотан, резерпин, дикумарин.
-Фетотоксический эффект – рез-тат р-ции созревающего или зрелого плода на лекарства.
Индометацин, в-адреномиметики, аминогликозиды, барбитураты.
118.Противотуберкулезные и противогрибковын средства.
1 группа. Наиболее эффективные препараты: гидразиды изоникотиновой к-ты, рифампицин.
2 группа. Преп средней эффективности: этамбутол, стрептомицин, протионамид, пиразинамид, канамицин.
3 группа. Преп умеренной эффективности: ПАСК, тибон.
-Изониазид. ГИНК. Конкурентный, антагонист амида никотин к-ты и вит В6. в/м peros. Поб: Наруш ф-ции ЦНС, гепатотоксич
-Рифампицин. А/б. Нарушает репликацию ДНК м/о. peros. Поб: наруш ф-ции печ, диспепсич.
-Этамбутол. Наруш реплик ДНК м/о. peros. Поб: нарушение зрения.
-Стрептомицин. А/б. Наруш ф-цию ЦПМ и с-з белка м/о. в/м. Поб: наруш слуха, ф-ции почек, нервно-мыш передачи, вестибуляр растр-ва, аллергич р-ции.
-ПАСК. Конкурентный антагонисть ПАБК. Peros. Поб: дисф-ция ЖКТ, дизурия.
Химиотерапия т-а длительная, непрерывная, 2 и более препарата, смена преп ч-з 3 мес и более.
1.Препараты, применяемые при поверхностных микозах.
-Гризеофульвин. А/б.П:-при фавусе, трихофитии, микроспории, поражении ногтей.
Фунгистатическое д-е. Поб: тошн, рвота, боли в жив, гол боль, головокруж, дезориентация.
-Ламизил. Класс аллиламинов. Подавл БИОС-з стеринов. Фунгицидное д-е. П:-кандидозы.
-Полиеновые а/биотики: нистатин, леворин, амфотерицин. -статич и –циды. П:-кандидозы.
-Растворы красителей: генциановый фиолетовый, метиленовый синий.
-Синтетич препараты: амиказол (П:-дерматофиты, кандида), клотримазол.
2.Прпараты, применяемые для лечения системных микозов.
-Амфотерицин В. П:-сист кандидоз. Поб:тошн, рвота, диарея, лихор, наруш деят серд, \гемопоэз.
-Амфоглюкамин, Микогептин. Менее токсичны.
-Синтетич противогрибковые преп-ты. Флуцитозин. Кетоконазол. Миконазол. Флуконазол.
119.Виды действия и пути введения лекарственных веществ.
Лекарст вещ-во может оказывать местное, резорбтивное и рефлекторное действие.
-Местное д-е – на месте введения, нанесеня на кожу.
-Резорбтивное д-е – после всасывания в кровь и распределения по тканям или ЦНС.
-Рефлекторное д-е – рез-тат активации вещ-вом рецепторов.
Пути введения лекарств вещ-в.
1.Введение без нарушения целостности покровов: через рот, прям кишку ингаляционно, под язык, в полость носа, конъюктивал мешок, уретру, влагалище и др.
2.Введение с нарушением целости покровов: инъекции – в/в, в/м, эндолимфатич, п/кож (для получения резорбтивного действия), в полость плевры, сустава, брюшины, в желудочки мозга, абсцессы (для местного действия).
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Тератогенность эмбриотоксичность фетотоксичность лекарственных средств
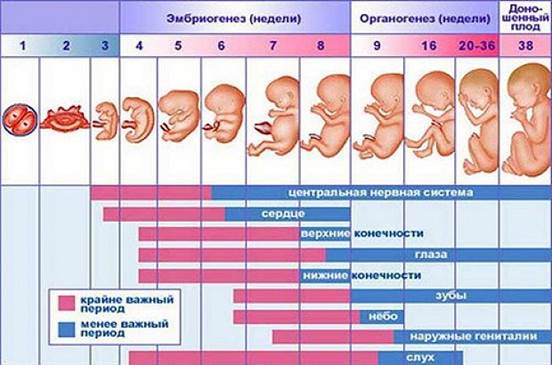
Врожденные аномалии у детей имеют широкий этиологический спектр. В настоящее время актуальность проблемы высока как на всем земном шаре, так и в России. Статистически частота врожденных пороков развития в России составляет 5-6 случаев на 1000 детей, тогда как в странах Европы 3-4 случая на 1000 родов. В настоящее время медицина не до конца выяснила причины врожденных аномалий у детей. Известно, что 10% врожденных пороков вызваны хромосомными и генетическими изменениями, 1% пороков вызваны действием лекарственных препаратов, в остальных 89% случаев изменения повлекли иные факторы. Путем рандомизированного исследования в странах мира лекарственные препараты во время беременности принимали более 80% опрошенных по данным Всемирной организации здравоохранения[2, 5]. Лекарства, которые выписывают доктора беременным, необходимы для нормального протекания беременности и развития здорового ребенка. Однако, есть определенный процент женщин, которые прибегают к самолечению, не выполняя указания врача. Во время беременности выделяют 3 триместра, в каждом из которых бесконтрольный и неправильный прием лекарственных средств может привести к врожденным порокам развития. Анализируя периоды беременности можно отметить, что отклонения от нормы будущего ребенка связаны с приемом лекарственных препаратов. Так, в первый триместр беременности, с 1-ой по 12-13-ю гинекологическую неделю, зародыш претерпевает ряд изменений, среди которых образование наружных половых органов, появляется точечно окостенение в хрящевом скелете, а также начинают функционировать мышцы, происходит окончание формирования плаценты[3]. (Рис.1) Во время 1-2 недели беременности, которые являются критическим периодом, эмбрион чувствителен к действию лекарств и при неправильном их приеме может произойти внутриутробная смерть зародыша. Второй триместр беременности длительностью с 14-ой по 26-ю гинекологическую неделю отличается относительным спокойствием, для этого периода характерно совершенствование органов и систем органов, которые начали закладываться в первом триместре. Третий триместр продолжается с 27-ой недели до родов. На данном этапе происходит формирование плода в плаценте. Происходит совершенствование нервной системы, почек, печени, органов чувств. Развиваются дыхательный, глотательный рефлексы. Плод набирает массу и активно растет в длину [3]. (Рис.1)
Рис.1 Внутриутробное развитие
Различают 3 вида патологических вариантов воздействия лекарственных средств на развитие плода: эмбриотоксический, тератогенный,фетотоксический. Эмбриотоксическое действие лекарственных препаратов, возникающее в первые 2-3 недели беременности, отмечается в негативном влиянии на зиготу и бластоцисту. Как следствие, может возникнуть гибель плода или морфофункциональные нарушения клеточных систем. Среди препаратов, которые вызывающие эмбриотоксическое действие выделяют противоопухолевые средства, противосудорожные препараты, никотин, эстрогены, гестогены, минералокортикоиды, антибиотики, сульфаниламиды, мочегонные препараты. (Табл. 1) Тератогенные эффекты, возникающие с 3 недели эмбриогенеза, вызывают нарушения биохимического, морфологического и функционального характера. Действие зависит от химической структуры, способности проникать через плаценту, дозировки препарата и скорость выведение лекарства из организма матери. По опасности препараты с тератогенными эффектами делятся на 3 группы: препараты, высоко опасные для плода, их употребление категорически запрещается даже за 6 месяцев до беременности, лекарства с определенной тератогенной опасностью, препараты, вызывающие отклонения при наличии определенных условий, например, высокий возраст беременной женщины, дозы применяемых лекарств [6]. Препараты с тератогенными эффектами являются наиболее опасными, так как они действуют на плод во время гистогенеза и органогенеза. Таким образом нарушение дифференцировки тканей может привести к порокам опорно-двигательной системы, а также внутренних органов. К таким средствам относятся: противоэпилептические средства, препараты половых гормонов, антибиотики, антикоагулянты, анальгетики, антидепрессанты, противомалярийные и противоопухолевые средства. Также известно, что прием ретиноидов, которые оказывают тератогенный эффект, вызывал врожденные аномалии развития, даже если курс лечения был завершен до начала беременности. (Табл. 1) [2,7]. Фетотоксическое действие наблюдается с 14-ой по 38-ую неделю беременности. Вызывают дисфункцию жизненно-важных систем органов. Примеры препаратов: аминогликозидные антибиотики, бета-адреномиметики и т.д. ( Табл. 1) [2,7] Лекарственные препараты проникают в организм плода через систему «мать-плацента-плод». Безусловно, самым важным органом во время беременности является плацента. Она служит своеобразным барьером между организмом матери и плода. Изначально толщина плаценты достигает 25мкм, но ближе к завершению беременности плацента становится заметно тоньше, ее толщина достигает 2 мкм. Этот факт способствует более легкому проникновению лекарств через плацентарный барьер в кровь плода. Также на ослабление плацентарного барьера влияют различные заболевания, например, сахарный диабет. Способность к проникновению различных веществ через плаценту обусловлена различными факторами, среди которых морфофункциональное состояние плаценты, плацентарный кровоток, физико-химическая характеристика лекарственных веществ и т.д. Известно, что большей проницаемостью через плаценту обладают низкомолекулярные вещества. Проникновение различных веществ через плаценту возможно различными путями, среди которых пиноцитоз, диффузия, активный транспорт. После проникновения лекарственного препарата происходит его дальнейшее попадание в пупочную вену, поэтому препарат достигает главных органов, например, сердце и мозг, минуя печень. Также важной проблемой является то, что некоторые препараты могут несколько раз циркулировать по организму плода, вызывая у него больший риск возникновения аномалий и пороков [8].
Таблица 1. Влияние лекарственных препаратов на развитие плода в первом, втором и третьем триместре беременности [4,5,9].
Источник
Тератогенность эмбриотоксичность фетотоксичность лекарственных средств
Первостепенное внимание научного сообщества уделяется поиску новых противомикробных средств или их комбинаций, обладающих комплексным профилактическим и терапевтическим потенциалом, позволяющим снизить риск возникновения побочных эффектов и осуществить полноценную терапию [1,7]. Особое значение при этом придается снижению токсичности препаратов и повышению их биодоступности [8,10, 6].
Известно, что практически все антибактериальные препараты обладают эмбриотоксическим действием, соответственно, экспериментальное изучение отдаленных последствий воздействия на организм химических веществ является существенным разделом токсиколого-гигиенической оценки лекарственных препаратов [5]. В комплексе биологических эффектов, относящихся к отдаленным последствиям воздействия химических факторов, важное значение имеет изучение влияния химических соединений в пренатальный период развития организма. В настоящее время накоплены многочисленные данные о возможном влиянии химических веществ на процессы эмбриогенеза [4].
Выявление реальной и потенциальной опасности вредного действия химических веществ на плод в условиях эксперимента на лабораторных животных требует унифицированных методических подходов для выбора тест-объектов, испытуемых доз, продолжительности опыта и количественной оценки результатов. Общепринятое понятие — эмбриотоксичность подразумевает потенциальную возможность какого-либо вещества оказывать отрицательный эффект на потомство во время начального периода беременности, т.е. в период между зачатием и образованием эмбриона [9].
Учитывая широкое, а не редко и бесконтрольное применение антибактериальных препаратов широкого спектра действия в животноводстве и птицеводстве [2], необходимо особое внимание уделять изучению фармако-токсикологических свойств разрабатываемых химиотерапевтических препаратов, в том числе определению эмбриотоксических свойств [3].
Цель исследования. Провести экспериментальное изучение эмбриотоксического действия новой лекарственной формы разработанного препарата «Доксициклин-комплекс» на лабораторных животных.
Материалы и методы исследований
Исследуемый объект — комбинированный антибактериальный препарат, представляющий собой сочетание следующих компонентов: доксициклина гиклат — 100 мг/мл, бромгексина гидрохлорид — 5 мг/мл, а в качестве вспомогательных веществ лактулоза — 100 мг/мл и солюфор (поливинилпирролидон).
Исследования проводились в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985), «Методическими указаниями по гигиенической оценке новых пестицидов» (Киев, 1988), методическими рекомендациями Фармакологического Государственного комитета («Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ», Москва, 2005) и приказа МЗ РФ №267 от 19.06.2003 «Об утверждении правил лабораторной практики». Эксперименты проводили на беспородных белых половозрелых виргинных (неоплодотворенных) самках крыс массой 230-260 г.
Животных содержали в виварии согласно санитарным правилам и на стандартном рационе в соответствии с приказом МЗ СССР № 1045-73 от 06.04.73 г.; правилами лабораторной практики и приказом МЗ СССР № 1179 от 10.10.83 г. Животные находились в виварии при стандартном освещении (12 ч свет/12 ч темнота) при температуре воздуха 20 °С и относительной влажности 70 %. Работу с животными проводили в соответствии с приказом МЗ СССР № 755 от 12.08.77 г. и правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей.
Эмбриотоксические свойства доксициклина изучали в дозе 10 мг/кг (терапевтическая доза).
Интактные половозрелые самцы массой 280-350 г., случённые с самками для индукции беременности, после подтверждения наступления беременности из эксперимента были исключены. Перед постановкой эксперимента у каждой самки брались вагинальные смывы. Животное считалось беременным, если в смывах при микроскопических исследованиях обнаруживались сперматозоиды (этот день считают первым днём беременности). Изучение безопасности «Доксициклин-комплекс» в антенатальном периоде проводили на нелинейных виргинных крысах 2-х групп (n=15 в каждой группе) с исходной массой 230-260 г. Животным вводили следующие исследуемые вещества: I группа (контроль) — солюфор (растворитель), содержащий вспомогательные вещества бромгексин и лактулозу — в адекватных объемах (исходя из объемов препарата, вводимого опытной группе животных или 100 мг/кг массы тела);
II группа (опыт) — препарат «Доксициклин-комплекс» в дозировке 10 мг/кг массы тела животного по действующему веществу (Доксициклина гиклат).
Препараты вводили животным при помощи желудочного зонда один раз в сутки в одно и то же время с 1 по 19 дни беременности. На 20 день беременности под эфирным наркозом производили эвтаназию крыс и их вскрытие. На основании результатов вскрытия животных были определены следующие показатели: количество желтых тел, количество мест имплантации, количество живых и мертвых плодов, регистрировали данные о предимплантационной и постимплантационной гибели плодов, измеряли краниокаудальный размер плодов, проводили внешний осмотр плодов и определяли количество плодов с аномалиями развития, изучали состояние костной системы и состояние внутренних органов плодов, в частности, регистрировали количество обследованных плодов с аномалиями развития.
После наружного осмотра и морфометрии плоды каждого помета фиксировали в 96° этаноле и использовали для изучения состояния скелета по методике Доусона. Окрашивание скелета ализарином (методика Доусона, модифицированная в отделе эмбриологии НИИЭМ АМН СССР). Окрашивание окостеневших участков скелета плодов производили погружением плодов в слабый раствор ализарина красного. Затем плоды изучали, учитывали аномалии скелета, количество точек окостенения в различных костных образованиях. Данные, полученные при вскрытии каждого животного, протоколировали.
Результаты исследования и их обсуждение. Оценка состояния генеративной функции крыс под воздействием препарата «Доксициклин-комплекс» не выявила достоверных изменений предимплантационной гибели эмбрионов, которая составила 6 % в опытной и 5 % в контрольной группе, что указывает на однородность групп животных. Вместе с этим отмечаются достоверные изменения при исследовании постимплантационной гибели плодов, которая в опытной группе составила 15,7 %, что значительно выше по сравнению с 7,14 % в контрольной группе животных (табл. 1). Данные изменения свидетельствуют о высокой эмбриотоксичности препарата.
Таблица 1. Оценка состояния генеративной функции крыс под воздействием препарата «Доксициклин-комплекс»
Источник