Технология экстракции лекарственных растений
Разработка и внедрение в практику ресурсосберегающего способа экстракции (за счет максимального истощения сырья), а также получение стабильных препаратов на основе экстрактов растений, является актуальной задачей.
Цель исследования — разработка технологии получения сухого экстракта из сбора растительного сырья, состоящего из равных частей (по массе) листьев смородины черной, листьев малины обыкновенной, травы кипрея узколистного (иван-чай), травы таволги вязолистной (лабазник), далее СМИЛ, методом водной экстракции.
Материал и методы исследования
Объектами исследования служили: 1) растительное сырье, приобретенное в ООО «Беловодье», Россия. Образцы представляли собой измельченное высушенное сырье: листья малины обыкновенной (ТУ 9198-015-57345339-05, сертификат: № РОСС RU АЮ65.Н01516); листья смородины черной (ТУ 9198-001-79413863-06, сертификат: № РОСС RU АЮ85.В30422); трава таволги (лабазник вязолистный) (ТУ 9198-008-57345339-02, сертификат: № РОСС RU.АЮ65.Н01522); трава кипрея узколистного (Иван-чай) (ТУ 9198-015-57345339-05, сертификат: № РОСС RU АЮ65.Н01516); 2) сухой водный экстракт, полученный из сбора СМИЛ.
Технология получения водного экстракта из сбора СМИЛ
В настоящее время существует большое количество разнообразных схем экстракции, призванных увеличить выход действующих веществ, обеспечить максимальное истощение сырья и обогащение вытяжки целевыми биологически активными веществами (БАВ). Среди них выделяется схема экстрагирования сырья водой очищенной, предложенная Саргиным Б.В. и соавт., реализованная на примерах сырья, богатого аскорбиновой кислотой (плоды калины обыкновенной, Viburnum opulus), водорастворимыми фенольными соединениями (листья березы плакучей, Betula pendula Roth) [2].
За основу собственных исследований была взята схема, предложенная Саргиным Б.В. и соавт., с некоторыми модификациями. В варианте, предложенном Саргиным Б.В., указаны общие условия первичного и последующего нагревания экстрагируемого растительного сырья в достаточно широком диапазоне температур и времени нагревания. Не конкретизированы условия охлаждения — приводится только временной интервал, однако, не указана конечная температура экстрагируемой смеси.
В связи с этим, изучены несколько вариантов экстрагирования сырья по предложенной технологии с применением различных температурных режимов и временных экспозиций, приведенных в таблице 1.
На стадии № 3 процесса экстракции (первоначальное нагревание смеси) были подобраны условия постепенного повышения температуры от 20°C до 40°C на 1°C и 5°C в различные промежутки времени. Далее на стадиях № 4, 6 (настаивание сырья при постоянной температуре) была оценена возможность экстрагирования сырья путем выдержки экстрагируемой смеси при постоянной температуре, а также возможность сокращения времени экстрагирования за счет исключения данной стадии.
На стадии № 5 процесса экстракции оценивалась возможность постепенного повышения температуры экстрагируемой смеси от 40°C до 90°C в течение 8 часов как на 1°C через каждые 10 мин, так и в интервале 3°C каждые 30 мин. В дальнейшем, на стадии №7, конкретизировались условия охлаждения смеси.
Таким образом, рассмотрены три варианта получения водных извлечений: 1-ый по схеме, описанной в патенте РФ 2473356, 2,3-ий — по модифицированной методике. Кроме того, при выполнении первого варианта, охлаждение проводили, не вынимая экстракционную емкость из термостата, а только выключив его.
Во всех трех случаях использовали сбор СМИЛ в сухо-воздушном состоянии, предварительно измельченный, смешанный и просеянный от пыли; первую стадию для всех трех схем экстракции оставляли неизменной.
В соответствии со схемой 1, сбор СМИЛ помещали в керамический сосуд, предварительно выдержанный в печи-термостате при температуре 20°C в течение 1 часа; заливали рассчитанным объемом воды очищенной (20°C) с учетом коэффициента поглощения сырья; осуществляли нагревание сырья с постепенным повышением температуры от 20°C до 40°C в течение 2 часов и выдерживали при температуре 40°C в течение часа. По истечении обозначенного времени, осуществляли последующее нагревание с постепенным повышением температуры до 90°C в течение 6 часов и выдерживали при температуре 90°C в течение часа; далее охлаждали сосуд с растительным сырьем в течение 6 часов, не вынимая из термостата.
В соответствии со схемой 2 экстрагирования, сбор растительного сырья СМИЛ помещали в керамический сосуд, заливали рассчитанным объемом воды очищенной (20°C) с учетом коэффициента поглощения сырья; осуществляли нагревание сырья с постепенным повышением температуры от 20°C до 40°C в течение 2 часов (на 1ºС, через каждые 6 мин) и выдерживали при температуре 40°C в течение часа; по истечении обозначенного времени, осуществляли последующее нагревание с постепенным повышением температуры до 90°C в течение 8 часов (на 1°C, через каждые 10 мин) и выдерживали при температуре 90°C в течение часа; охлаждали сосуд с растительным сырьем в течение 10 часов с постепенным снижением температуры от 90 °C до 20 °C в (на 1 °C каждые 9 минут).
В соответствии со схемой 3 экстракции сбор СМИЛ заливали рассчитанным объемом воды очищенной (20°C) с учетом коэффициента поглощения сырья; осуществляли нагревание сырья с постепенным повышением температуры от 20°C до 40°C в течение 2 часов (на 5 °C, каждые 30 минут); выдержку не осуществляли, а продолжали последующее нагревание с повышением температуры до 90°C в течение 8 часов (на 3°C, через каждые 30 мин); выдержку на данной стадии также не осуществляли. Экстрагируемую смесь извлекали из термостата и охлаждали при комнатной температуре.
В качестве сравнения использовали настой сбора СМИЛ, изготовленного по технологии, рекомендуемой ГФ ХI изд.: навеску сбора СМИЛ заливали водой очищенной комнатной температуры в соотношении 1:10. Настаивали на кипящей водяной бане в течение 15 мин, периодически перемешивая, и охлаждали при комнатной температуре в течение 45 мин. Настой отфильтровывали, сырье отжимали. В случае необходимости доводили объем настоя до требуемого.
Сравнительную оценку полноты извлечения БАВ проводили по содержанию экстрактивных веществ, полифенольных соединений в пересчете на рутин, органических кислот в пересчете на хлорогеновую кислоту, дубильных веществ в пересчете на галловую кислоту после каждого этапа выдержки при заданной температуре, в готовых продуктах (водные экстракты), полученных по схемам 1, 2, 3, а также в водном извлечении, приготовленном по правилам изготовления настоев и отваров из не сильнодействующего растительного сырья. Результаты проведенного исследования представлены в таблицах 2 и 3.
Результаты и их обсуждение
Результаты, представленные в таблице 2, свидетельствуют о целесообразности применения приема постепенного повышения температуры и медленного охлаждения, поскольку в данном случае в экстрактах увеличивается содержание целевой группы БАВ. Данные, представленные в таблице 3, свидетельствуют о том, что содержание экстрактивных веществ в водном экстракте, полученном по схеме 2, выше такового в экстрактах, полученных по схеме 1 и 3 в 1,1 раз, и в 1,9 раз соответственно и выше содержания экстрактивных веществ в настое в 2,8 раз. Вместе с тем, содержание полифенольных соединений в пересчете на рутин (%) в экстракте, полученном по схеме 2, превышало содержание таковых в экстрактах, полученных по схеме 1, 3 и в водном извлечении из сбора СМИЛ (настой) в 1,1 раза, в 1,5 раза и в 2,3 раза соответственно.
Таблица 1
Подбор оптимальной схемы экстрагирования сырья
Источник
Способы получения, состав и антиоксидантная активность растительных экстрактов
В.А. Волков, Е.Е. Кевер
Институт биохимической физики им. Н.М. Эмануэля РАН, Москва, Россия
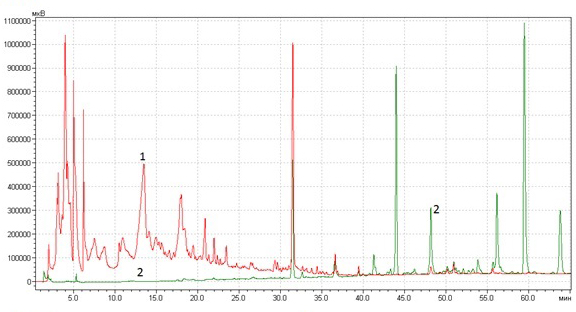
Человечество всю свою историю использует растения в пищу, а также в лечебных и косметических целях. При приготовлении напитков, пищевых добавок, косметических изделий и лекарственных препаратов применяются различные технологии извлечения (экстракции) полезных веществ из тканей растений. Эти технологии различаются как по используемому экстрагенту, так и по методике экстракции и применяемому оборудованию. От методики экстракции зависит не только полнота извлечения веществ из сырья, но и степень их сохранности. Некоторые вещества (например, каротиноиды) не переносят нагрева выше 40 ͦС и действия как прямого, так и рассеянного света [1]. Другие вещества (флавоноиды, сапонины, терпеноиды) более термоустойчивы, однако для обеспечения высокого качества экстрактов проводит этот процесс при температурах выше 55 ͦС не рекомендуется. Из одного и того же сырья получаются принципиально разные по составу экстракты при использовании экстрагентов различной полярности (рис. 1 и 2).
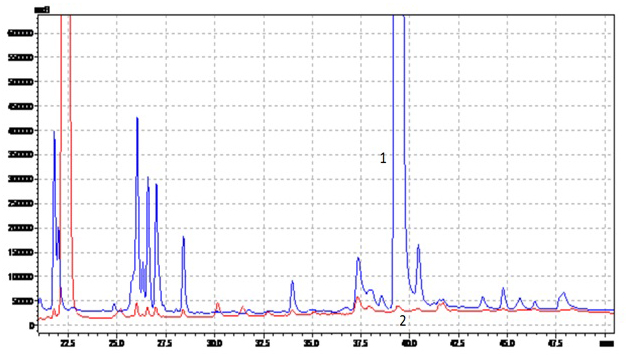
Рис. 1. Хроматограммы экстрактов ромашки: 1 – воднопропиленгликолевого, 2 — полученного с использованием сверхкритического СО2. Хроматограф Shimadzu LC-20Prominence, детектор диодно-матричный SPDM20A, колонка Merck Superspher-100 RP-18, 4×250 мм. Элюирование градиентное, элюент ацетонитрил-вода, скорость потока 0.5 мл/мин.
В левой части хроматограмм, соответствующей выходу наиболее полярных соединений, имеются пики только у воднопропиленгликолевого экстракта, в то время как в правой части, соответствующей выходу малополярных соединений – только у СО2 – экстракта.Аналогичная картина наблюдается и при сравнении воднопропиленгликолевых и масляных экстрактов:
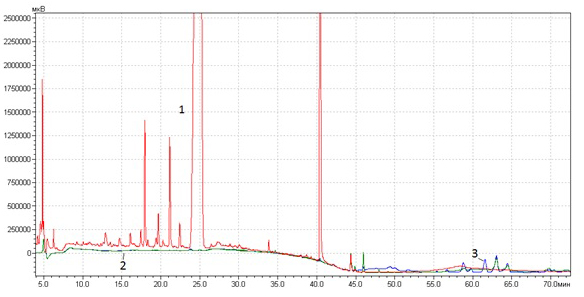
Рис. 2. Хроматограммы экстрактов календулы: 1 -воднопропиленгликолевого (Завод эндокринных ферментов, Россия), 2 — масляного экстракта (Завод эндокринных ферментов, Россия), 3 — масляного экстракта (Symrise, Германия).
Очень хорошими экстрагентами, извлекающими из тканей растений как гидро-, так и липофильные соединения, являются водно-этанольные смеси. Они с успехом применяются для производства экстрактов для приема внутрь и обработки полости рта, однако практически не применяются при производстве косметики из-за негативного воздействия на кожу и способности расслаивать косметические составы.
Поэтому для производства косметики применяются, главным образом, пропиленгликолевые и воднопропиленгликолевые экстракты. 1,2-пропиленгликоль является веществом, разрешенным для наружного и внутреннего применения, безопасность которого доказана многочисленными исследованиями. 1,2-пропиленгликоль при нанесении на кожу улучшает проникновение в нее действующих веществ косметических композиций.
Глицерин также является полностью биосовместимым веществом, более дешевым, чем 1,2-пропиленгликоль, однако, из-за высокой вязкости уступает последнему по экстрагирующей способности.
Сверхкритический (при давлении около 25 МПа) CO2 обладает превосходной способностью извлекать из тканей растений липофильные соединения в условиях максимального их сохранения, в результате чего получаются экстракты, не содержащие растворитель. Однако, гидрофильные соединения, среди которых многие ценные вещества, в частности, флавоноиды, таннины, углекислота не экстрагирует. Кроме того, такие экстракты имеют высокую себестоимость. Поэтому для извлечения жирорастворимых соединений чаще всего применяют экстракцию растительными маслами.
При использовании одного и того же экстрагента получаемые экстракты могут сильно различаться по составу и количеству экстрагированных веществ. При этом играют роль следующие факторы:
- сорт, место произрастания сырья, почвенно-климатические условия, время его заготовки;
- соблюдение технологии заготовки и хранения растительного сырья;
- метод экстракции, соотношение массы сырья и экстрагента.
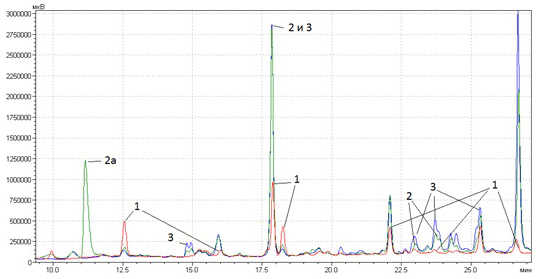
На рис. 3а. представлены хроматограммы полярных соединений (главным образом, полифенолов, в т.ч. флавоноидов) ромашки аптечной (Chamomilla recutita L.), произведенных на различных российских и известном зарубежном предприятиях. Очевидно, что все экстракты изготовлены из натурального качественного сырья. Российские экстракты по величине большинства основных пиков превосходят зарубежный аналог, хотя некоторых компонентов в последнем, все же, больше, что объясняется различиями состава компонентов в исходном сырье.
Рис. 3а. Хроматограмма полярных соединений ромашки (Chamomilla recutita L.) различных производителей: 1 – Symrise (Германия), 2 – 2Д-Фарма (Россия), 3 – Завод эндокринных ферментов (Россия).
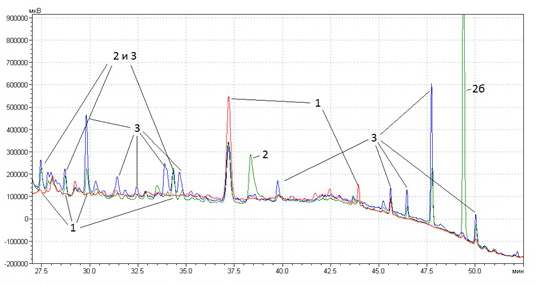
Такая же картина наблюдается и на хроматограмме малополярных соединений ромашки:
Рис. 3б. Хроматограмма малополярных соединений ромашки (Chamomilla recutita L.) различных производителей: 1 – Symrise (Германия), 2 – 2Д-Фарма (Россия), 3 – Завод эндокринных ферментов (Россия).
Иногда на хроматограммах обнаруживаются пики веществ, не входящих в состав природных композиций изучаемого экстракта (пик 2а на рис. 3а).
Однако, в некоторых экстрактах экстрактивные вещества заявленных растений обнаруживаются в очень малых количествах. В частности, нами это было выявлено при сравнительном хроматографическом анализе двух экстрактов женьшеня – известного источника тонизирующих веществ, главными из которых являются гликозилированные формы сапонинов (рис. 4):
Рис. 4. Хроматограммы воднопропиленгликолевых экстрактов женьшеня различных производителей: 1 –Завод эндокринных ферментов (Россия), 2 – известная британская фирма. Пик 39.5 мин в экстракте 1 – консервант триклозан, пик 22.5 мин в экстракте 2 – консервант метилпарабен.
Экстракты растений (за исключением некоторых, содержащих сильнодействующие и ядовитые вещества), обладают высокой биосовместимостью, полинаправленностью действия и влияют на организм человека подобно внутренним метаболитам, чем обусловливается популярность использования растительных экстрактов в пищевой технологии, косметологии и медицине[2].
Со времени открытия т.н. «французского парадокса» [3] (обусловленный потреблением большого количества растительных антиоксидантов с пищей низкий уровень заболеваемости сердечно-сосудистыми заболеваниями при высоких факторах риска во Франции) ученые, промышленники и потребители стали проявлять возрастающий интерес к антиоксидантным свойствам пищевой, косметической и фармацевтической продукции. Слово «антиоксидант» превратилось из предложенного учеными ИХФ РАН Н.М Эмануэлем и Е.Б. Бурлаковой научного термина в популярный рекламный «бренд», эффективно повышающий продажи товаров и услуг, но далеко не всегда добросовестно и обоснованно используемый.
В 2004 году Главным санитарным врачом РФ утверждены «Рекомендуемые уровни потребления пищевых продуктов и биологически активных веществ» [4], в соответствии с которыми введены адекватные и верхние допустимые уровни суточного потребления АО растительного происхождения. Суммарное адекватное потребление фенольных АО составляет около 500 мг, верхнее допустимое – около 1100 мг. В США наиболее распространена точка зрения, что суточная норма потребления фенольных АО с пищей составляет около 1000 мг; при этом лишь 30% жителей США потребляют АО в количестве, соответствующем этой норме.
Тем не менее, большинство производителей пищевой и косметической продукции, использующие слово «антиоксидант» в рекламных целях, не имеют данных даже об общем количественном их содержании в исходном сырье и в готовой продукции.
В ходе наших более ранних исследований [5] мы установили на примере серии образцов белых и красных вин, что при количественном анализе общего содержания антирадикальных АО в объектах растительного происхождения наиболее адекватные результаты в сочетании с удобством применения дают методы, основанные на наблюдении инициированной люминесценции люминола и ДФПГ-тест. Последний был использован авторами данной работы и для количественного анализа содержания АО в экстрактах образцов тех же растений, в отношении экстрактов которых был ранее проведен хроматографический анализ.
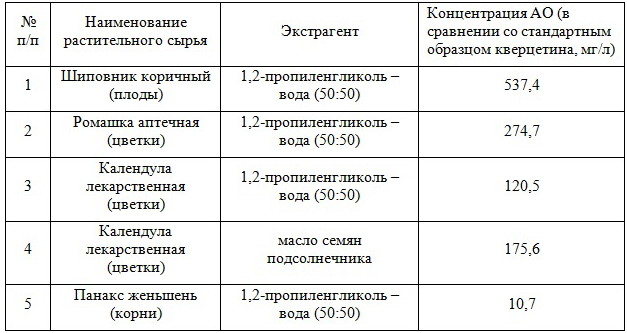
При анализе суммарной концентрации АО в образцах некоторых отечественных экстрактов, производимых для нужд косметической промышленности (Завод эндокринных ферментов, Москва, см. таблицу) было установлено, что экстракты надземных частей растений содержат АО в количестве, равном их содержанию в высококачественных красных виноградных винах [6]. Тот факт, что масляный экстракт календулы лекарственной содержит АО значительно больше, чем воднопропиленгликолевый, объясняется присутствием в исходном подсолнечном масле значительного количества токоферолов и токотриенолов, главным образом, α-токоферола, которые обеспечивают большую часть наблюдаемой антиоксидантной активности масляных экстрактов.
Экстракты подземных частей растений, в частности, женьшеня, содержат гораздо меньше АО, чем экстракты надземных частей. Тонизирующее действие этого экстракта связано, главным образом, с гликозидами сапонинов [2], которые имеют стероидную химическую природу и антиоксидантными свойствами не обладают.
Таблица. Суммарная концентрация АО в образцах некоторых воднопропиленгликолевых и масляных экстрактов, производимых для нужд косметической промышленности (Завод эндокринных ферментов)
Таким образом, для обеспечения высокого качества продукции на основе растительного сырья и ее конкурентных преимуществ предприятиям необходимо при отборе поставщиков и выборе производственных технологий осуществлять контроль физико-химических параметров экстрактов и конечного продукта с применением современных аналитических методов, дающих адекватные представления об их свойствах. Проведенные исследования продемонстрировали, что производство экстрактов в странах Европейского Союза не является показателем их качества, и имеются превосходящие их российские аналоги.
Источник