Связывание лекарственных веществ с белками плазмы крови
После попадания в кровь лекарственные средства могут связываться с молекулами белка, которые присутствует в большом количестве, что приводит к образованию комплексов лекарственное средство-белок.
К связывающим белкам относятся в основном альбумин и в меньшей степени β-глобулины и кислые гликопротеиды. Другие белки плазмы (транскортин, трансферрин, тироксинсвязывающий глобулин) выполняют специализированные функции по связыванию определенных веществ.
Степень связывания зависит от концентрации реагентов и аффинитета лекарственного вещества к конкретному белку. Концентрация альбумина в плазме составляет 4,6г/100 мл (или 0,6 ммоль/л) и поэтомуобусловливаеточень высокую связывающую способность (два места на молекулу). Как правило, лекарственные средства обладают гораздо меньшим аффинитетом (KD — 10 -5 -10 -3 М) к белкам плазмы, чем к специфическим связывающим местам (рецепторам).
В диапазоне терапевтически значимых концентраций связывание белков с большинством лекарственных средств повышается линейно с концентрацией (исключения: салицилат и определенные сульфаниламиды).
В молекуле альбумина имеются разные места связывания анионных и катионных лигандов, а также действуют силы Ван-дер-Ваальса. Степень связывания коррелирует с гидрофобностью лекарственного вещества (лекарственное средство вытесняется из воды).
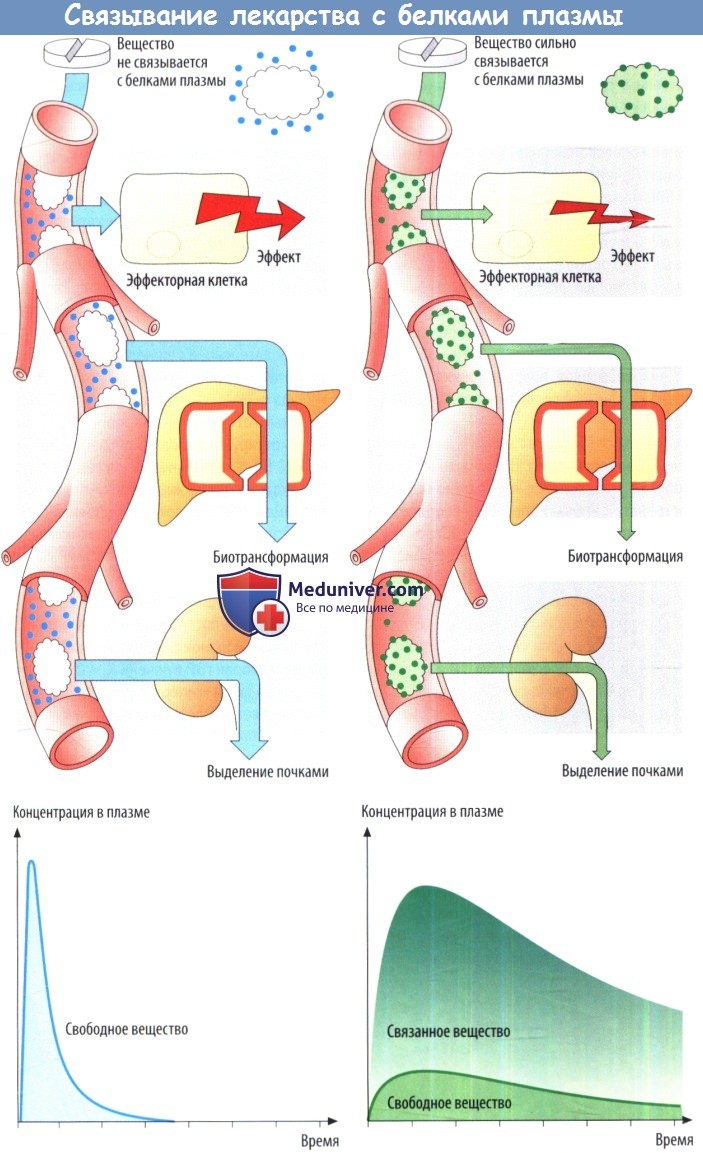
Связывание с белками плазмы — это быстрый и обратимый процесс, т. е. за любым изменением концентрации несвязанного лекарственного вещества немедленно следует соответствующее изменение связанной концентрации. Связывание белками имеет большое значение, т. к. именно концентрация свободного лекарственного вещества определяет интенсивность действия.
При данной общей концентрации в плазме (предположим, 100 нг/мл) эффективная концентрация составит 90 нг/мл для лекарственного вещества, связанного с белком на 10%, но 1 нг/мл для лекарственного вещества, связанного с белком на 99%. Снижение концентрации свободного лекарственного вещества в результате связывания с белками влияет не только на интенсивность действия, но и на биотрансформацию (в печени) и выделение почками, и, лишь свободное лекарственное средство поступая в печень, осуществляющую метаболизм, или подвергается клубочковой фильтрации.
При падении концентрации свободного лекарственного вещества недостаток восполняется за счет связанного с белком количества. Связывание белком плазмы аналогично депонированию для увеличения времени действия за счет задержки выделения, но при этом снижается интенсивность эффекта. Если два вещества обладают аффинитетом к одному и тому же участку связывания в молекуле альбумина, они начинают конкурировал за это место.
Одно лекарственное средство может вытеснить другое с места связывания и тем самым повысить уровень свободной (действующей) концентрации замещенного лекарственного вещества (вид лекарственного взаимодействия). Увеличение свободной концентрации замещенного лекарственного вещества означает повышение эффективности и ускорение выведения.
Снижение концентрации альбумина (при заболевании печени, нефротическом синдроме, плохом общем состоянии) приводит к изменению фармакокинетики лекарственных средств, которые в значительной степени связываются с альбумином.
Лекарственные средства, связанные с белками плазмы, которые являются субстратами переносчиков, выводятся из крови с высокой скоростью. Например, парааминогиппурат выводится почечными канальцами, а сульфобромофталеин — печенью. Скорость клиренса этих веществ можно использовать для определения почечного или печеночного кровотока.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Связывание лекарственных веществ с белками плазмы крови
Альбумин является наиболее важным белком плазмы, связывающим кислые лекарства. Конкуренция за участки связывания, присутствующие на альбумине, приобретает клиническую значимость для лекарств, связывающихся более чем на 80%, особенно если связывание превышает 90%. При столь высокой степени связывания любое небольшое изменение величины связанной фракции приведет к значительным изменениям величины свободной фракции, т.е. фракции, от которой зависят фармакологические эффекты.
Многие основные лекарства связываются с глобулиновой фракцией (например, с альфа-кислым гликопротеином). Интерпретация клинического значения этого взаимодействия осложняется тем, что данный белок представляет собой реагент острой фазы и его концентрация относительно быстро меняется и неодинакова у различных индивидов. Концентрация а-кислого гликопротеина повышается с возрастом, при воспалительных заболеваниях и остром патологическом стрессе.
При передозировке выбор наиболее подходящей среды для определения концентрации лекарства зависит от его химических свойств. Кислые лекарства концентрируются в плазме, поэтому кровь является наиболее подходящей средой для определения их концентрации. Основные лекарства, независимо от пути их введения, целесообразно определять в просвете желудка. Диффузия основных лекарств в желудке приводит к почти полной их ионизации в этой среде. Если градиент концентрации остается постоянным, основные лекарства концентрируются в желудке до тех пор, пока не возникнет равновесие распределения неионизированной фракции. Прием бикарбоната для подщелачивания мочи может увеличить длительность действия амфетамина. В результате такого подщелачивания возрастающая фракция амфетамина в моче присутствует в неионизированной форме и быстро реабсорбируется через люминальную поверхность почечных канальцев.
Анатомические и физиологические факторы, способствующие дифференциальному распределению лекарств. Анатомическая и биохимическая природа гематоэн-цефалического барьера влияет на способность лекарственных веществ проникать в головной мозг. Диффузия из капилляров мозга жестко ограничена клеточными зонулами; они усиливают барьерный эффект на пути диффузии лекарств в мозг. Однако существуют 4 области мозга, где этот барьер отсутствует: гипофиз, эпифиз, дно 4-го желудочка мозга и капилляры хориоидеи.
Хориоидея содержит также транспортеры, удаляющие заряженные молекулы из спинномозговой жидкости (СМЖ). В норме СМЖ не содержит белков, поэтому концентрация лекарства в СМЖ сходна с концентрацией свободного лекарства в крови.
Все лекарства проходят через плаценту и поступают в материнское молоко (если не доказано обратное). Лекарства диффундируют через плаценту, однако равновесие между матерью и плодом устанавливается медленнее вследствие ограниченного плацентарного кровотока. Если не доказано обратное, следует полагать, что все лекарства проходят через плаценту и поступают в материнское молоко. Клиническое значение присутствия лекарств в плаценте и молоке следует оценивать индивидуально для каждого препарата.
Источник
Связывание с белками плазмы крови и распределение лекарственных средств
Лекарственный препарат, попав в кровь, находится в ней в двух фракциях: свободной и связанной.
Главным образом лекарства связываются с альбуминами, в меньшей степени с кислыми альфа1-гликопротеинами, липопротеинами, гамма-глобулинами и форменными элементами крови (эритроцитами и тромбоцитами). Необходимо подчеркнуть, что уровень альфа1-кислого гликопротеина увеличивается при острых воспалительных заболеваниях, при приеме фермент-продуцирующих препаратов (фенобарбитала, дифенина и др.), а также у пожилых людей.
Под концентрацией лекарства в плазме крови понимают сумму свободной и связанной с белками его фракций. Особенно важно обращать внимание на связывание препаратов с белками плазмы крови, если оно превышает 70—80%, так как в некоторых случаях данный показатель мoжет существенно меняться. Например, связывание с белками может уменьшаться при заболеваниях печени, почек, сепсисе, ожогах, атрофическом или гипертрофическом гастрите, болезни Гиршпрунга, синдроме мальабсорбции, энтерите, раке желудка, неспецифическом язвенном ко лите, белковом голодании, ферментопатиях желудочно-кишечного трак та, действии ионизирующей радиации на органы брюшной полости (уменьшается синтез или увеличивается потеря белка); при повышении в крови уровня билирубина, остаточною азота, жирных кислот или при одновременном введении нескольких препаратов (одно вещество вытесняет другое из связи с белком); у недоношенных новорожденных, новорожденных и пожилых людей (онтогенетически обусловленный низкий уровень белка и особый аминокислотный состав белков). Уменьшение связанной фракции лекарства на 10—20% приведет к увеличению свободной фракции на 50—100%, что важно при использовании препаратов с малой широтой терапевтического диапазона. Имеет значение не только процент связывания, но и степень сродства (аффинитета) ксенобиотика к белку. Последняя зависит от степени комплементарности (соответствия) активных центров белков и молекул лекарств, а также от характера возникающих при взаимодействии химических связей. По убыванию прочности их можно расположить в следующем порядке: ковалентная, ионная, водородная, гидрофобная, ван-дер-ваальсова.
Что касается беременных женщин, то у них увеличивается связывание некоторых препаратов (нитрофуранов, викасола, местных анестетиков и др.) с эритроцитами (число последних возрастает в среднем на 18—20%). Следует подчеркнуть, что при беременности увеличивается содержание в плазме крови специфических белков-переносчиков, таких как транскортин (связывающий естественные глюкокортикоиды), трансферрин (связывающий ионы трехвалентного железа), тироксинсвязывающий глобулин, альфа2-глобулин, связывающий половые гормоны. Поэтому понижается проникновение некоторых лекарственных веществ к плоду через плацентарный барьер. И наоборот, у беременных отмечено снижение неспецифических белков в плазме крови, что приводит к уменьшению связывания определенных препаратов в крови. Так, в III триместре беременности концентрация альбуминов в крови снижается на 1 г/100 мл с ослаблением связывания лекарств на 20%. Это все крайне важно учитывать при лечении беременных женщин.
Связывание с белками плазмы крови, несомненно, оказывает влияние на распределение лекарственных средств в организме. Как уже было сказано, в ткани и клетки поступает только свободная фракция, именно она (10в-8—10в-9 M — обычная рабочая концентрация) и оказывает фармакодинамическое действие. Однако на распределение препаратов в организме влияют и другие факторы: степень сродства к рецептору, соотношение ионизированной и неионизированной фракции вещества, наличие лигандинов (эндогенных веществ, связывающих лекарства в клетках), относительная масса мышечной ткани, жира, внеклеточной жидкости, скорость суточной обмениваемости внеклеточной жидкости, общее содержание воды в организме, состояние гемодинамики и т. п. Распределение лекарственного средства в организме с учетом всех факторов, влияющих на этот процесс, характеризуется фармакокинетическим показателем — объемом распределения (Vd). Это условный объем жидкости, необходимый для равномерного распределения в нем лекарственного средства, обнаруживаемого в терапевтической концентрации в плазме крови после однократного внутривенного введения. В большинстве руководств и справочников при характеристике лекарства приводится величины удельного объема распределения (л/кг).
Если объем распределения меньше 0,5 л/кг, то лекарственный препарат преимущественно находится в плазме крови и но внеклеточной жид кости, если больше, то лекарство распределено во всей водной фазе и в маловаскуляризованных тканях. Если объем распределения более 1 л/кг, то вещество преимущественно содержится в мышцах и других тканях. В этом случае применение гемодиализа, гемофильтрации, плазмафереза и гемосорбции при отравлении бесполезно.
При беременности увеличивается объем плазмы крови на 30—40% и объем внеклеточной жидкости на 5—7 л, а также количество жира на 3—4 кг. Поэтому объем распределения и водо-, и жирорастворимых (липидорастворимых) препаратов возрастает. Однако накопление в жирах носит временный характер и при длительном назначении концентрация липидорастворимых лекарственных средств может даже повыситься, по скольку наблюдается высвобождение их запаса, ранее накопленного в жировой ткани.
В организме новорожденных и грудных детей жидкости, особенно внеклеточной, относительно больше, чем у взрослых и детей дошкольного и школьного возраста. В результате лекарства, хорошо растворимыe и воде, могут преимущественно оказаться во внеклеточной жидкости, а не внутри клетки. К тому же суточная обмениваемость внеклеточной воды у взрослого человека значительно меньше (14%), чем у грудного ребенка (50%). Это может способствовать и попаданию вещества во внеклеточную жидкость, и исчезновению из нее. В организме ребенка меньше жира, в нервной ткани меньше липидов. Поэтому жирорастворимые вещества у детей хуже накапливаются и задерживаются в тканях.
Особому правилу подчиняется проникновение лекарств в мозг через гематоэнцефалический барьер (ГЭБ) — динамически функционирующую мембрану между кровью и мозгом, которая регулируется самим мозгом. Через данный барьер существуют следующие виды транспорта: для глюкозы, аминокислот обнаружены специальные носители, синтезирующиеся эндотелием; для инсулина, трансферрина — специальные рецепторы, которые их захватывают, а затем интернализуются и освобождают эти вещества в интерстициальное пространство мозга; известно, что при соприкосновении белков плазмы крови с поверхностью эндотелиальных клеток сосудов мозга происходит конформационное изменение белка и отщепление связанного с ним вещества. Между клетками эндотелия капилляров гипофизарной и эпифизарной областей, срединного возвышения, хориоидального сплетения и area postrema существуют «водные поры», которые могут пропускать молекулы, имеющие массу до 30 000 дальтон.
При некоторых заболеваниях мозга (менингит, травма и т. п.) проницаемость ГЭБ повышена. Поступлению лекарств в мозг также способствует нарастание количества остаточного азота в крови, так как повышается проницаемость ГЭБ и увеличивается свободная фракция лекарства, вытесненного из связи с белком.
У новорожденных и детей грудного возраста ГЭБ (впрочем, как и другие гистогематические барьеры) значительно более проницаем, чем у взрослых. Окончательное формирование и созревание ГЭБ завершается только в постнатальном периоде Поэтому многие лекарственные вещества, даже плохо растворимые и липидах, значительно легче и скорее, чем у взрослых, проникают в мозговую ткань детей.
О функции ГЭБ новорожденных детей можно судить по наличию в крови специальных кислых белков (так, альфа, глобулин является маркером олигодендроглиоцитов).
Следует отметить достаточно высокую проницаемость гематоэнцефалического барьера плода. Концентрация лекарственного препарата в его ликворе может достигать таких же значений, как и в крови матери. При этом возникает высокая опасность повреждения головного мозга ребенка. Кроме того, ксенобиотик может проникать в центральную нервную систему плода и через сосудистую оболочку глаз. Кстати сказать, лекарство может попасть в кровь плода, а затем в его мозг и из околоплодной жидкости путем ее заглатывания, а также через кожу, которая только после 16 недель начинает формироваться как барьер.
Удаление лекарств из мозга происходит при участии сосудистого сплетения желудочков по типу секреции вещества в почечных канальцах или с током спинномозговой жидкости через ворсинки паутинной оболочки.
Источник