Структурной единицей коллоидного раствора лекарственного вещества является. A
| Сторінка | 2/4 |
| Дата конвертації | 15.12.2016 |
| Розмір | 426.24 Kb. |
| Тип | Правила |
Структурной единицей коллоидного раствора лекарственного вещества является.
Дисперстные системы используются в фармацевтической практике. Методом
подтверждения коллоидного состояния является прохождение света через систему. При
этом пучок света:
A * рассеивается в виде светящегося конуса
D испытывает преломление
E проникает внутрь частицы
Чему равно число компонентов в точке пересечения линии ликвидуса с осью ординат на
Кинетические методы широко используют для определения стабильности
лекарственных форм. Период полупревращения какой из реакций выражается
Для количественного определения гидроксида калия выбран метод
потенциометрического титрования. Точку эквивалентности в этом методе определяют
по резкому изменению:
A *Электродвижущей силы
D Интесивности флуоресценции
Порошки, одержащие экстракт красавки и активированный уголь, имеют пониженную
терапевтическую активность. Какое поверхностное явление влияет на снижение их
В лаборатории получен коллоидный раствор лекарственного вещества. С какой целью к
нему прибавляют высокомолекулярное вещество?
A *Для повышения его устойчивости
B Для понижения его устойчивости
E Для усиления действия электролита – стабилизатора
Конденсованою системою називають систему, в якій:
A *Відсутня газоподібна фаза
B Відсутня тверда фаза
C Відсутня рідка фаза
D Компоненти знаходяться в рідкому стані
E Є більше двох компонентів
Розчини,що використовуються для їнєкцїй, мають бути їзотонїчними. Ізотонічними
розчинами називають такі, у яких:
A *Однаковий осмотичний тиск
B Однаковий онкотичний тиск
C Однаковий рН розчинїв
D Однакова полярнїсть молекул розчинених речовин
E Однакова масова частка розчинених речовин
Одним із сучасних методів вимірювання рН біологічних рідин є потенціометричний. Який
із запропонованих електродів можна застосувати як електрод визначення
Правило Вант-Гоффа застосовують при визначеннї термїну придатностї лїкїв. В яких
межах знаходиться температурний коефіцієнт швидкості більшостї хїмїчних реакцій?
Ферменти (бїологїчнї каталїзатори) застосовують як фармакологїчнї препарати. Який
механізм дії ферментів в біохімічних реакціях?
A *Знижують енергію активації реакції
B Підвищують енергію активації
C Інгібірують процес реакції
D Змінюють константу швидкості реакції
E Змінюють порядок реакції
Поверчнево-активнї речовини (ПАР) широко використовують у фармацевтичнїй практицї,
як стабїлїзатори диспертних систем. Характерною особливістю будови молекул ПАР є:
Процес, під час якого відбувається хімічна взаємодія між молекулами адсорбата і
активними центрами адсорбенту, називають:
В колоїднї препарати аргентуму (протаргол, коларгол) додають високомолекулярнї
сполуки (ВМС) для збїльшення стїйкостї золей. Здатність ВМС захищати золь від
B Порогом коагуляції.
C Величиною електрокїнетичного потенцїалу
D Величиною електротермодїнамїчного потенцїалу
E Електрофоретичною рухливїстю
При боротьбї з шоком використовують розчин полїглюкїну
Розчини високомолекулярних сполук одержують:
A *Розчиненням у відповідному розчиннику.
B Реакцією полімеризації.
C Реакцією поліконденсації.
Одним из факторов, влияющих на увеличение выхода лекарственного вещества в
процессе его синтеза, является понижение энергия активации реакции. Этому
A Добавление катализатора
B Повышение температуры
C Понижение температуры
D Увеличение концентрации
E Уменьшение концентрации
Для расчетов тепловіх эффектов реакций синтеза лекарственных препаратов при
повышенных температурах следует использовать:
A *Уравнение Кирхгоффа
B Уравнение Больцмана
C Уравнение изобары
D Уравнение изохоры
E Уравнение изотермы
В изобарно-изотермических условиях для прогнозирования возможности и направления
B Энергии Гельмгольца
E Внутренней энергии
Термодинамические расчеты позволяют определить возможность и направление
самопроизвольных процессов. В изолированной системе для этой цели используют
изменение термодинамической функции:
C Энергии Гельмгольца
D Внутренней энергии
Поверхностная активность – это один из факторов биодоступности лекарственных
препаратов. Во сколько раз возрастет поверхностная активность при удлинении
углеводородного радикала ПАВ на группу СН2?
Растительные и животные организмы относятся к таким биологическим системам,
которые обмениваются с окружающей средой веществом и энергией. Как называются
A *Открытая, гетерогенная
B Изолированная, гетерогенная
C Закрытая, гомогенная
D Закрытая, гетерогенная
E Открытая гомогенная
Потенциометрия широко используется в анализе лекарственных препаратов. Э.д.с.
какого гальванического элемента не зависит от величины стандартного электродного
Кинетические методы используются для определения стабильности лекарственных
препаратов. Определите порядок реакции, если константа скорости ее имеет
размерность с -1
При производстве лекарственных препаратов их выход можно повысить при правильном
выборе температурного режима. Какое уравнение устанавливает зависимость
константы равновесия от температуры при постоянном давлении?
A *Изобары химической реакции
B Изотермы химической реакции
D Изохоры химической реакции
Для ізохорного процесу тепловий ефект рівний:
A *Зміні внутрішньої енергії.
B Зміні ентальпії процесу
D Зміні ентропії системи.
E Зміні вільної енергії Гібса.
Стандартні умови визначаються наступними значеннями тиску та температури
Тепловий ефект реакції нейтралізації кислот HCl, HNO3:
B Залежить від їх основності.
C Визначається окислювальними властивостями.
D Залежить від природи кислотного залишку
E Залежить від послідовності злиливання компонентів кислота-луг
В евтектичній точці двокомпонентної системи з простою евтектикою в рівновазі
A * 2 твердих і розплав евтиктичного складу
B 2 рідких і 1 тверда
D 1 тверда, 1 рідка і 1 газоподібна
E 1 рідка і 1 тверда
Число ступенів свободи в точці перетину лінії ліквідуса з віссю ординат на діаграмі
плавкості двокомпонентної системи дорівнює:
Яким повинен бути тиск пари рідини при кипінні?
A *Рівним атмосферному.
D Рівним тиску насиченої пари при кімнатній температурі.
E Рівним тиску насиченої пари при 273 К.
При виготовленні деяких лікарських форм необхідно враховувати величину осмотичного
тиску. Який з перерахованих 0,1М розчинів: глюкози, сахарози, AlCl3, KNO3, CaCl2,
має найбільший осмотичний тиск?
B 0,1М розчин глюкози
C 0,1М розчин сахарози
Який з перерахованих розчинів однакової моляльності кипить при найбільшій
Потенціометричний метод визначення рН, як найбільш універсальний, занесений до
Державної фармакопеї України. Який з електродів використовують у якості електроду
A *насичений каломельний
Хімічна кінетика має велике значення для фармації. Який порядок має реакція гідролізу
Скільки фаз має рівноважна система, шо застосовується у технології фармацевтичного
Більшість технологічних процесів у фармації відбувається в гетерогенних системах. Яка
кількість фаз міститься у суміші евтектичного складу при евтектичній температурі
Водно-спиртові суміші широко застосовується в медичній та фармацевтичній практиці.
Вони відносяться до азеотропів. Яка особливість азеотропних сумішей?
A *Нероздільно киплять;
C Взаємодіють між собою;
D Не взаємодіють між собою;
E Мають критичну температуру змішування.
Міцелярні розчини ПАР застосовують у фармацевтичному виробництві як стабілізатори і
солюбілізатори. Для якого з розчинів колоїдних ПАР можна очікувати найбільшого
значення ККМ (критичної концентрації міцелоутворення)?
У фармацевтичній промисловості міцелярні розчини ПАР використовуються для
виготовлення водорозчинних препаратів із нерозчинних у воді речовин, наприклад,
вітамінів А і Е. В розчинах яких речовин критична концентрація міцелоутворення має
Фармацевтичний препарат коларгол — це колоїдний розчин срібла, до складу якого
входить високомолекулярна сполука. Яку функцію виконує ця сполука?
A *Підвищує агрегативну стійкість
B Викликає коагуляцію
C Сприяє седиментації
D Знижує агрегативну стійкість
E Збільшує ступінь дисперсності
Залежність величини електродного потенціалу від різних факторів виражається
До якого типу відноситься електрод, складений за схемою Au 3+ |Au ?
A *до електродів І роду
B до електродів ІІ роду
D окисно-відновних електродів
E іон-селективних електродів
Приготовленная эмульсия лекарственного вещества имеет размер частиц дисперсной
фазы 10 -6 м. К какому типу дисперсных систем (классификация по степени
дисперсности) следует отнести данную лекарственную форму?
A *микрогетерогенная система
B гетерогенная система
C грубодисперсная система
D коллоидно-дисперсная система
Пороги коагуляции золя лекарственного вещества электролитами MgSO4, NaCI,
AI(NO3)3 равны соответственно 0,81; 51,0; 0,095 ммоль/л. Какой из ионов
электролитов оказывает наибольшее коагулирующее действие?
При очистке глицерина, который входит в состав многих лекарственных форм,
используют активный уголь. Какое явление лежит в основе этого процесса?
E Капиллярная конденсация
Высокомолекулярные вещества при определенных условиях образуют студни, которые
широко используются при изготовлении лекарственных форм. Какое явление
происходит при старении студней?
Йодоформ при хранении самопроизвольно разлагается с образованием йода. Какая из
термохимических функций служит критерием направления этого процесса при
постоянстве V и Т?
A *энергия Гельмгольца F
D энергия Гиббса G
В Державну Фармакопею України включен метод определения молярной массы
полимера, основанный на изменении такого свойства растворов высокомолекулярных
C температура замерзания
D осмотическое давление
E давление насыщенного пара
Для внутривенных инъекций используют водный раствор СаСI2 с массовой долей 10% .
Каково максимальное значение изотонического коэффициента СаСI2 в водном
При изготовлении ряда жидких лекарственных форм для повышения растворимости
отдельных компонентов, добавляют коллоидные поверхностно-активные вещества.
Какое физико-химическое явление лежит в основе этого процесса?
Криоскопические постоянные воды, бензола, хлороформа, уксусной кислоты и камфоры
соответственно равны 1,86; 5,12; 4,9; 3,9; 40,0. Какой из этих растворителей Вы
выберете для наиболее точного определения молярной массы лекарственного
вещества (неэлектролита) криоскопическим методом?
В физико-химической лаборатории были приготовлены водные растворы. Какой из
перечисленных растворов имеет наибольшее осмотическое давление при 298 К ?
A *раствор сульфата алюминия
D раствор бензоата натрия
E раствор сульфата натрия
Основний закон термохімії (закон Гесса) встановлює, що тепловий ефект хімічної реакції
A *Не залежить від шляху перебігу реакції.
B Залежить від природи вихідних речовин.
C Залежить від природи продуктів реакції.
D Залежить від природи продуктів реакції.
E Не залежить від природи реагуючих речовин.
Ентропія, як одна з основних термодинамічних функцій, є мірою:
B Внутрішньої енергії системи.
C Повної енергії системи.
D Енергії, яку можна використати для виконання роботи.
Як із підвищенням температури змінюється фізична адсорбція речовин?
C Переходить у хемосорбцію
D Зменшується у гетерогенних системах
E Збільшується у гомогенних системах
Источник
ЖИДКИЕ ГЕТЕРОГЕННЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ



Лекция № 12
План:
- Кинетическая (седиментационная) устойчивость суспензий и эмульсий
- Агрегативная устойчивость суспензий и эмульсий.
- Эмульгаторы, классификация, гидрофильно-липофильный балланс, механизм их действия.
- Коллоидные растворы, характеристика, их технология.
Суспензия — это жидкая лекарственная форма, в которой твердое вещество находится во взвешенном состоянии в жидкости.
Эмульсия — это жидкая лекарственная форма, состоящая из 2 -х взаимонерастворимых тонко диспергированных жидкостей.
Коллоидный раствор — это жидкая лекарственная форма, представляющая собой ультрамикрогетерогенную систему, структурной единицей которой являются мицеллы.
Данные лекарственные формы являются гетерогенными системами и им характерна кинетическая (седиментационная) и агрегативная (конденсационная) неустойчивость.
Кинетическая устойчивость — это способность дисперсной системы сохранять равномерное распределение частиц по всему объему (или массе) лекарственной формы. Частицы под действием силы тяжести опускаются на дно или всплывают в зависимости от относительных плотностей дисперсионной среды и дисперсной фазы. Кинетическая неустойчивость описывается формулой Стокса:
V — скорость оседания частиц, м/с;
r — радиус частиц, м;
ρт — плотность дисперсной фазы, г/м 3 ;
ρж — плотность дисперсионной среды, г/м 3 ;
η — вязкость среды, Па • с;
g — ускорение свободного падения, м/с 2 ;
Устойчивость (U) является величиной обратной скорости седиментации. Формулу Стокса можно преобразить:
Кинетическая устойчивость прямо пропорциональна вязкости среды. Чем больше вязкость, тем выше устойчивость гетерогенной системы, следовательно для придания устойчивости системе необходимо вводить вещества повышающие вязкость среды: сиропы, глицерин и др. Из формулы видно, что при ρт = ρж — система наиболее устойчивая, однако изменять пропись рецепта может только врач, а в рецепте прописано конкретно дисперсионная среда и дисперсная фаза. Кинетическая устойчивость обратно пропорциональна радиусу частиц: чем меньше радиус, тем больше устойчивость. Малый размер частиц обуславливает их большую удельную поверхность, что приводит к увеличению свободной поверхностной энергии.
Δ F — изменение свободной поверхностной энергии, Н/м;
Δ S — изменение поверхности, м 2 ;
δ — поверхностное натяжение, Н/м.
Измельчать частицы до бесконечно малых размеров невозможно, так как свободная поверхностная энергия стремится к минимуму. Уменьшение свободной поверхностной энергии может происходить за счет агрегации частиц, поэтому на границе раздела фаз частицы, как правило, стабилизируют. Формула Стокса применима к идеальным системам, содержащим частицы строго шаровидной формы, абсолютно твердые и гладкие. Реальные суспензии не удовлетворяют этим требованиям, поэтому формула Стокса, не отражающая явления на границе раздела фаз, носит приближенный характер, так как самопроизвольно протекают процессы, направленные на уменьшение запаса свободной энергии. Внешне это проявляется слиянием частиц или их слипанием.
Агрегативная устойчивость — это способность частиц дисперсной фазы противостоять слипанию, агрегации, слиянию. При большом запасе свободной поверхностной энергии в суспензиях может происходить процесс флокуляции (от лат. flocke — хлопья). Флокулы способны оседать или всплывать, то есть нарушение агрегативной устойчивости приводит к нарушению кинетической устойчивости. Система восстанавливает свои свойства при взбалтывании. При образовании кристаллоподобных осадков систему нельзя восстановить взбалтыванием, частицы не сохраняют свою индивидуальность. Процесс образования конденсата — процесс необратимый. В эмульсиях может происходить коалесценция, то есть слияние капелек друг с другом, образуется два слоя — эмульсия расслаивается. Для того, чтобы эмульсия сохранила агрегативную устойчивость, необходимо сохранить достигнутую степень дисперсности, понизив величину поверхностного натяжения. Практически это можно осуществить с помощью веществ, способных адсорбироваться на поверхности раздела фаз (П.А.В. — поверхностно-активные вещества). По международной номенклатуре такие вещества называются тензидами (от лат. tension — натяжение), характерной особенностью которых является их дифильность.

П.А.В. имеют полярные группы и неполярный хвост. Порядок ориентации П.А.В. зависит от численного преобладания полярных и неполярных групп. Гидрофильные группы способны к гидратации и всегда ориентированы к водной фазе и погружены в нее. Неполярные участки не гидратируются, являются гидрофобными (олеофильными), ориентируются к масляной фазе, распределяются в ней. Таким образом, эмульгатор гидрофобной системе придает гидрофильные свойства и определяет не только устойчивость, но и тип эмульсий (правило Банкрофта). Дисперсионной средой становится та фаза, в которой эмульгатор преимущественно растворяется. Эффективность любого эмульгатора характеризуется специальным числом гидрофильно-липофильного баланса. Под Г.Л.Б. (по шкале Гриффина) понимают соотношение гидрофильных и гидрофобных групп в молекуле. Шкала Гриффина для известных П.А.В. от 1 до 40. Чем больше в молекуле П.А.В. гидрофильных групп, тем выше значение Г.Л.Б. Число 10 — граница между липофильными и гидрофильными П.А.В. При Г.Л.Б. ниже 10 образуются эмульсии вода / масло. Чем выше число Г.Л.Б., тем больше шансов для образования эмульсии масло / вода. Шкала Гриффина может быть представлена следующим образом (таблица 1).
| Значение Г.Л.Б. | Свойства П.А.В. |
| 1 — 3 | пеногасители |
| 3 — 6 | эмульгаторы в/м |
| 7 — 8 | моющие средства |
| 8 — 13 | эмульгаторы м/в |
| 13 — 15 | детергенты |
| выше 15 | солюбилизаторы |
Самое низкое значение имеет олеиновая кислота (1), самое высокое (40) натрия лаурилсульфат.
Эмульгаторы классифицируются по особенностям строения на 3 группы:
Ионогенные эмульгаторы делятся на анионные П.А.В. (мыла) и катионные П.А.В. (4-х замещенные аммониевые основания).
Анионные П.А.В., диссоциируя в воде образуют отрицательно заряженные ионы, а катионные П.А.В. положительно заряженные ионы. К анионактивным эмульгаторам относятся (камеди, гуммиарабик, трагаканты), растительные слизи, пектиновые вещества.
Молекулы их не способны к диссоциации.
К ним относятся:
- эмульгатор Т2;
- диэфиртриглицерин;
- твины, спаны, производные сорбитана;
- производные целлюлозы, метилцеллюлозы; карбоксиметилцеллюлозы в виде 1 — 2 % растворов;
- крахмал в виде 10 % клейстера.
В зависимости от рН среды проявляются кислотные или основные свойства. Сюда относится:
1. желатоза — продукт неполного гидролиза желатина с водой в соотношении 1:2 в автоклаве в течении 2-х часов при давлении 2 атмосферы;
2. казеин, казеинат натрия, сухое молоко. Казеин выделяется из казеиногена — белка молока, содержит аминокислоты. В сухом молоке находятся белки, казеиноген (фосфопротеид) и молочные (альбумин и глобулин).
Эмульгаторы классифицируются по природе:
1. Природные вещества (камеди, слизи, пектин, белки и т. д.);
2. Полусинтетические вещества (производные целлюлозы);
3. Синтетические вещества (твины, спаны).
Эмульгаторы классифицируются по типу образующейся эмульсии:
1. Гидрофильные образуют эмульсии типа м/в (белки, камеди, слизи, крахмал);
2. Олеофильные образуют эмульсии типа в/м (мыла двух и трехвалентных металлов, амиды жирных кислот и т. д.).
Классификация эмульгаторов по медицинскому назначению:
1. Для внутреннего применения: камеди, яичный желток, желатин, желатоза и т.д.;
2. Для наружного применения (щелочные мыла, агар и т. д.).
Классификация эмульгаторов по механизму действия:
1. Эмульгаторы, стабилизирующие систему за счет снижения поверхностного натяжения;
2. Эмульгаторы, стабилизирующие систему за счет образования защитных слоев и в охвате частиц, которые стабилизируются длинными цепочкообразными макромолекулами (3-х мерная сетка);
3. Эмульгаторы смешанного действия (большинство эмульгаторов).
Механизм стабилизирующего действия П.А.В. и В.М.С. заключается в том, что они адсорбируются на поверхности твердых частиц или капельках жидкости, полярной фазой обращаясь к полярной фазе, а неполярной — к неполярной. Снижается поверхностное натяжение, образуется мономолекулярный слой П.А.В., вокруг которого образуется сольватный слой — все это стабилизирует системы.
Коллоидные растворы (Solutiones colloidales)
Главное свойство коллоидных растворов это их ультрамикрогетерогенность. Коллоидная частица представляет собой агрегат атомов и молекул. Поперечник частиц дисперсной фазы лежит в пределах от 1 до 100 нм. Как отмечалось, это неустойчивые системы. Необходим стабилизатор, который имеется изначально в мицеллах в виде продуктов гидролиза белка, что характеризует коллоидные частицы высокой лабильностью. Таким образом, в медицине нашли применение препараты защищенных коллоидов. Принцип защиты коллоидов заключается в сочетании коллоидно-раздробленного вещества (гидрофобного) и ВМС за счет адсорбции этих ВМС на коллоидных частицах. Эти ВМС являются ПАВ, уменьшают поверхностную энергию. Благодаря защите гидрофобных коллоидов макромолекулами данных соединений они приобретают новые свойства: спонтанность растворения и обратимость. Свойства коллоидных растворов приведены в таблице 2.
Rp.: Sol. Protargoli 1 % — 50 ml
D. S. Для промывания полости носа
Протаргол представляет собой коллоидный раствор оксида серебра, защищенный щелочным альбуминатом. Содержит около 92 % продуктов гидролиза белка, поэтому при приготовлении они должны набухнуть, а затем раствориться. В связи с этим, приемлема следующая технология.
Характеристика и свойства коллоидных препаратов
| Наименование препарата по Г.Ф. | Синоним | ПАВ для защиты коллоидов | Свойства |
| Колларгол (список Б) Collargolum | Серебро коллоидное Argentum colloidale | натриевая соль лизальбиновой и протальбиновой кислот | зеленовато- или синеваточерные пластинки с металлическим блеском; содержит 70 % серебра |
| Протаргол Protargolum | Серебро белковое Argentum Proteinicum | альбуминаты натрия (продукты гидролиза белка) | Коричнево-желтый или коричневый легкий порошок, гигроскопичен, содержит 8 % серебра оксида |
| Ихтиол Ichthyolum | Аммониевая соль сульфокислот сланцевого масла | аммониевые соли сульфокислот | почти черная, в тонком слое бурая, сиропообразная жидкость, своеобразного запаха, водные растворы при взбалтывании сильно пенятся |
В подставку наливают 50 мл воды очищенной и помещают тонким слоем на поверхность воды 0,5 протаргола, оставляют в покое до растворения. Взбалтывать нельзя, так как образуется пена и проторгол всплывает на поверхность в виде комков. Процеживают через рыхлый тампон из ваты, или через беззольный фильтр. Зольную бумагу использовать не рекомендуют, так как ионы железа, кальция, магния вызовут коагуляцию белковой части протаргола, и следовательно потерю препарата на фильтре. Наиболее целесообразно процеживать через стеклянные фильтры.
Rp.: Sol. Collargoli 1 % — 100 ml
D. S. Для спринцеваний
Колларгол содержит 70 % металлического серебра и до 30 % защитного компонента (натриевые соли лизальбиновой и протальбиновой кислот), поэтому представляет собой крупнокристаллический порошок, который необходимо предварительно измельчать в ступке под пестиком с небольшим объемом воды. Процеживают аналогично растворам протаргола. Как и протаргол, колларгол светочуствителен, поэтому отпускают эти растворы в склянках темного стекла.
Ихтиол — это природный защищенный коллоид. Смесь сульфидов, сульфатов, сульфонатов, полученных из продуктов сухой перегонки битуминовых сланцев. Это вязкая бурая жидкость, со специфическим запахом. Смешивается с водой и глицерином, частично растворим в спирте и эфире. Вследствие вязкости растворение идет медленно.
Rp.: Ichthyoli 3,0
Aq. purificatae 100 ml
Ихтиол растворяют в фарфоровой чашке в части воды, переносят в цилиндр и доводят объем до 100 мл, процеживают через ватный тампон в склянку для отпуска.
Варианты отвешивания ихтиола:
1. При большой массе непосредственно в фарфоровую чашку.
2. Если ихтиола небольшая масса, то отвешивают на кружочек фильтровальной бумаги, смачивая с другой стороны водой, или на кусочек пергаментной бумаги. Снимают ихтиол с пергаментной бумаги скальпелем. Бумагу и скальпель промывают водой.
При приготовлении глицериновых растворов ихтиола используют горячую воду.
Электролиты, введенные в растворы защищенных коллоидов в виде порошков, могут вызвать коагуляцию, поэтому к коллоидным растворам целесообразно прибавлять только электролиты в виде растворов.
Хранят коллоидные растворы в прохладном, защищенном от света месте для предотвращения коагуляции.
Качество приготовленных растворов оценивают, как и для всех жидких лекарственных форм.
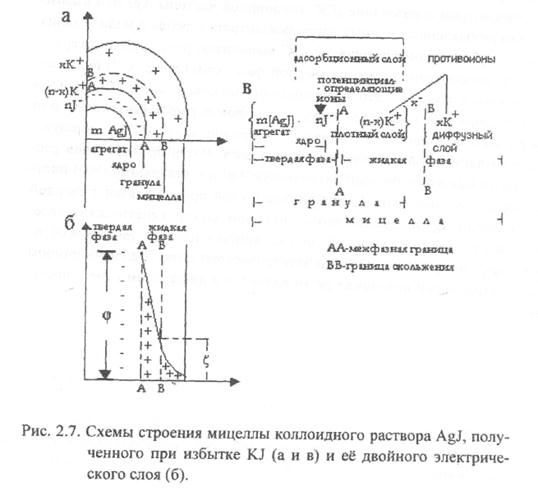
На границе адсорбционного и диффузного слоя (граница скольжения В.В.) возникает электрокинетический — дзета (ζ) потенциал (см. рисунок). Электрокинетический потенциал — часть электротермодинамического потенциала. Чем больше диффузный слой, тем больше ζ — потенциал.
ζ-потенциал – мера устойчивости коллоидных частиц.
Структурной единицей лиофобных коллоидбв является мицелла. Мицелла состоит из электронейтрального агрегата (в приведенном примере это AgJ) и ионогенной части. Ионогенная часть — это адсорбционный и диффузный слои двойного электрического слоя.
Агрегат и потенциалопределяющие ионы образуют ядро.
Агрегат вместе с адсорбционным слоем называют гранулой. Знак заряда гранулы определяют потенциалопределяющие ионы. В приведенном примере гранула имеет отрицательный заряд (х — ).
Структура мицеллы рассмотренного выше коллоидного раствора AgJ, стабилизатором которого является KJ, представлена на рисунке (часть рисунка с буквой А).
Состав мицеллы этого золя схематично можно изобразить и в виде формулы (часть рисунка с буквой В),
m — число молекул труднорастворимого вещества;
n — число потенциалопределяющих ионов
(число противоионов тоже n);
n-x — число противоионов в адсорбционном слое.
x — в диффузном слое коллоидной частицы.
х — — вверху за фигурной скобкой – заряд гранулы.
Формулу мицеллы золя BaSO4, полученного при избытке K2SO4, можно записать так:
<m[BaSO4] • nSO4 2- • 2(n-x)K + > 2 x — • 2xK +
Коэффициенты увеличения объёма при добавлении к растворителю лекарственных веществ *
| Наименование вещества | Растворитель | Коэффициент увеличения объема, мл/г |
| Анестезин | Масло касторовое | 0,92 |
| Антипирин (суспензия) | Масло оливковое | 0,80 |
| Бензилпенициллина натриевая соль | Вода очищенная | 0,68 |
| Дерматол (суспензия) | Этанол 96 % | 0,39 |
| То же | Этанол 50 % | 0,35 |
| Камфора | Масло оливковое | 1,04 |
| Кислота ацетилсалициловая | Этанол 90 % | 0,72 |
| Ментол | Масло оливковое | 1,11 |
| Метилурацил (суспензия) | Масло оливковое | 0,69 |
| Натрия нуклеинат | Вода очищенная | 0,55 |
| Рутин (суспензия) | Масло оливковое | 0,66 |
| Стрептоцид (суспензия) | Масло оливковое | 0,66 |
| Сульфадимезин (суспензия) | Этанол 96 % | 0,72 |
| То же | Этанол 50 % | 0,79 |
| Фенол | Масло оливковое | 0,91 |
| Хинина гидрохлорид | Вода очищенная | 0,81 |
| Хлоралгидрат | Масло оливковое | 0,59 |
| Эритромицин (суспензия) | Масло оливковое | 0,87 |
Коэффициенты увеличения объёма * водных или спиртовых смесей при добавлении к ним лекарственных веществ
| Наименование вещества | Жидкая фаза (среда) | Коэффициент увеличения объема, мл/г |
| Висмута нитрат основной | Вода очищенная | 0,19 |
| Глина белая | То же | 0,39 |
| Кальция глицерофосфат | » | 0,46 |
| Кальция карбонат | » | 0,38 |
| Крахмал | » | 0,67 |
| Магния оксид | » | 0,34 |
| Метилурацил (метацил) | Спирт этиловый 30 % | 0,69 |
| Норсульфазол | Вода очищенная | 0,65 |
| Осарсол | Спирт этиловый 70, 90,96 % | 0,59 |
* Коэффициенты увеличения объема для спиртовых растворов и суспензий используют только при анализе лекарственных форм.
Сроки годности суспензий, изготовляемых в аптеках — 3 суток.
| Наименование вещества | Жидкая фаза (среда) | Коэффициент увеличения объема, мл/г |
| Сера | Спирт этиловый 70, 90, 96% | 0,48 |
| Сульфадимезин | Вода очищенная | 0,68 |
| Стрептоцид | То же | 0,69 |
| Сульгин | » | 0,65 |
| Тальк | » | 0,34 |
| Уросульфан | » | 0,66 |
| Фталазол | » | 0,65 |
| Цинка оксид | » | 0,21 |
| Этазол | » | 0,65 |
| Дисперсная фаза | Дисперсионная среда | Типы эмульсий |
| Масло | Вода очищенная | Масло в воде (М/В); эмульсии первого типа (прямые) |
| Вода очищенная | Масло | Вода в масле (В/М); эмульсии второго типа (обратные) |
Эмульгаторы, применяемые при изготовлении масляных эмульсий
При изготовлении эмульсии, как правило, стабилизируют эмульгаторами. В случае необходимости консервируют, используя разрешенные к медицинскому применению консерванты (нипагин, нипазол и др.).
Для изготовления эмульсий используют персиковое, оливковое, подсолнечное, касторовое, вазелиновое и эфирные масла, рыбий жир, бальзамы и другие несмешивающиеся с водой жидкости. Если нет указания о применении масла, то используют персиковое, оливковое или подсолнечное масло.
При отсутствии указаний о концентрации для приготовления 100 г эмульсии берут 10 г масла.
Эмульсии независимо от концентрации лекарственных веществ изготовляют по массе.
Лекция № 13
СУСПЕНЗИИ
План:
1. Суспензии как лекарственная форма, характеристика.
2. Случаи образования суспензий.
3. Получение суспензий дисперсионным методом.
4. Получение суспензий конденсационным методом.
5. Оценка качества суспензий, перспективы развития лекарственной формы.
Суспензии (Suspensiones) — жидкая лекарственная форма, содержащая в качестве дисперсной фазы одно или несколько измельченных порошкообразных лекарственных веществ, распределенных в жидкой дисперсионной среде. На данную лекарственную форму есть общая статья «Суспензии» в Г.Ф. XI, выпуск 2-й, С. 154.
С точки зрения дисперсологической классификации (по А. С. Прозоровскому) суспензии — это свободно дисперсные системы с жидкой дисперсионной средой.
Суспензии в фармацевтической практике принято делить на 2 группы:
1. микстуры взбалтываемые (Mixturae agitandae) — грубые суспензии;
2. микстуры мутные (Mixturae turbidae) — тонкие суспензии, в которых в отличие от взбалтываемых не происходит быстрого осаждения твердых частиц и образования осадков.
Размер твердых частиц в тонких суспензиях лежит в пределах 0,1-1 мкм, в грубодисперсных системах — более 1 мкм.
Суспензии назначают для наружного и внутреннего применения (в виде микстур и капель) и реже для внутримышечного введения.
Суспензиям характерен конус Тиндаля, осмотическое давление отсутствует, броуновское движение выражено слабо, диффузия не обнаруживается. Гетерогенная система неустойчивая.
Преимущества лекарственной формы — суспензии:
1. Не растворимые в воде вещества имеют более высокую степень дисперсности, чем в порошках, поэтому быстрее и полнее проявляется терапевтическое действие вследствие увеличения площади контакта с поверхностью больных тканей.
2. Лекарственные вещества обладают пролонгированным действием по сравнению с растворами. Суспензия цинк — инсулин оказывает действие в течение 24-36 часов по сравнению с растворами, которые действуют в течение 6 часов.
3. Снижается отрицательное воздействие желудочного сока на лекарственные вещества, находящиеся в виде мелких частиц.
4. В суспензиях можно использовать вспомогательные вещества, увеличивающие вязкость дисперсионной среды, корригенты, консерванты, антиокислители, ПАВ, разрешенные к медицинскому применению.
5. Лекарственная форма удобна для применения.
6. Лекарственную форму можно отпускать в виде сухого полуфабриката.
Случаи образования суспензий
— Чаще всего это случаи, когда прописаны твердые лекарственные вещества, весьма мало растворимые или практически не растворимые в воде (цинка оксид, крахмал, ментол, сера и др.).
— Нарушен предел растворимости вещества. Например: кислота борная в концентрации более 5 %, натрия гидрокарбонат в концентрации более 8 %.
— В результате происшедших в растворе химических реакций образования новых лекарственных веществ, не растворимых в воде (пример: хлорид аммония совместно с ацетатом свинца).
— В результате замены растворителя ухудшились условия растворимости лекарственных веществ (пример: добавление в микстуры галеновых и новогаленовых препаратов).
Существуют 2 метода изготовления суспензий:
Получение суспензий дисперсионным методом
В аптечной практике находят применение механические способы диспергирования. При сухом растирании в ступке нельзя получить порошок с частицами менее 50 — 5 мкм. Прибавление жидкости способствует процессу диспергирования, доводя размер частиц до 5 — 0,1 мкм. Это связано с эффектом Ребиндера.
Сущность заключается в следующем: смачиваемая жидкость попадает в устья микротрещин и образует жидкий клин. При этом, если расклинивающее давление превышает значительно лапласовское давление (стягивающее действие вогнутого мениска), происходит эффект диспергирования в жидкой среде. Как правило, первоначально берут 0,4 — 0,6 мл жидкости на 1,0 твердого вещества (40 — 60 %), при этом наблюдается максимальный эффект диспергирования (правило Б. В, Дерягина).
Технологическая схема получения суспензий дисперсионным методом
Источник