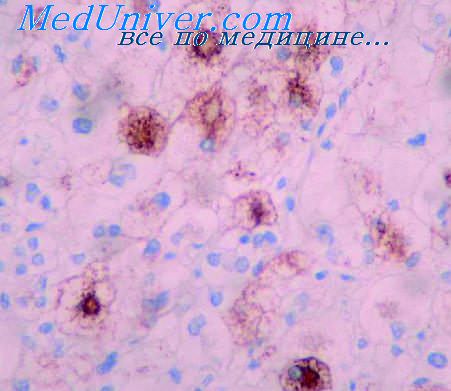
- Степень лечебного патоморфоза молочной железы
- Тройной негативный рак молочной железы
- Тройной негативный рак молочной железы
- Что такое тройной негативный рак молочной железы?
- Предоперационная терапия при тройном негативном раке молочной железы
- Нарушение процессов восстановления ДНК — мишень при лечении тройного негативного рака молочной железы
- Тройной негативный рак молочной железы и мутации BRCA
- Материалы конгрессов и конференций
- III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
Степень лечебного патоморфоза молочной железы
Вопрос о структуре самого лечебного патоморфоза болезни продолжает оставаться дискуссионным. Как известно, этиология н патогенез подавляющего большинства опухолевых болезней точно не установлены, а потому эти элементы не могут служить достоверными показателями патоморфоза. Наиболее значимыми являются изменения клинических и морфологических проявлений болезни.
Именно эти изменения входят в число существенных признаков, раскрывающих содержание понятия. В разряд патоморфоза следует отнести изменчивость н другие элементы болезни, в частности, ее осложнения, неходы н непосредственные причины смерти.
Часто возникает вопрос о том, все ли изменения болезни и опухоли можно отнести к патоморфозу. Отвечая на этот вопрос, следует заметить, что к патоморфозу могут быть отнесены лишь типовые и стойкие изменения болезни (опухоли) Я. Л. Раппопорт (1962) подчеркивал, что нозоморфоз — это не эксцесс, выходящий за рамки клинико-анатомических вариаций, свойственных данной опухоли. Нозоморфоз представляет собой типичное для данной опухоли (либо для данного метода лечения) явление.
Следует при этом, однако, помнить, что «типичное», «стандартное» для опухоли весьма относительно, как относительна и сама клиническая и морфологическая характеристика патоморфоза. Вместе с тем патоморфоз — это не беспорядоч ное н хаотичное изменение. Изучение проявлений и механизмов патоморфоза позволяет выделить его общую и главную черту — перестройку закономерностей происхождения и развития болезни (родовое понятие) на уровне вида, популяции и индивидуума (видовое отличие).
Иными словами, в понятие «патоморфоз» входят типичные явления, повторяющиеся существенные отношения, отражающие определенные и во многом пока еще не установленные закономерности возникновения, развития и проявления опухолевого процесса.
Следует отметить, что по мере усовершенствования лучевых методов лечения и увеличения числа лекарственных средств с усилением их лечебных свойств при химиотерапии возрос не только лечебный потенциал врача-онколога, но также возросло и количество повреждений различных органов и тканей. Ятрогенные патологические процессы не только изменяют клинико-анатомические проявления опухолевой болезни, но и могут быть непосредственной причиной смерти. Однако разнообразные неблагоприятные реакции на медикаментозные средства, а также осложнения, вызванные хирургическими и терапевтическими вмешательствами, в проявление патоморфоза включать не следует.
Установление патоморфоза опухолевых болезней представляет интерес с точки зрения практики и теории медицины. Данные о патоморфозе опухолей используют на практике для сравнения разных методов лечения, для оценки эфектквкости проводимого (или уже законченного) лечения для объективного обоснования прогноза и его критериев, для оптимизации сроков диспансерного наблюдения и экспертизы трудоспособности, а также для других целей. Наблюдения патоморфоза в клинике одновременно являются основой для теоретических разработок в различных областях онкологии, патологии, радиобиологии и т. д.
Сюда можно отнести разработку принципов лечения злокачественных новообразований, изучение сущности биологического действия ионизирующих излучений, взаимоотношения опухоли и организма в условиях лечения, восстановления повреждений нуклеиновых кислот и клеточных органелл и т. д.
В качестве примера важности изучения лечебного патоморфоза опухолей достаточно привести данные ВОЗ (Женева, 1982) из доклада «Оптимизация лучевой терапии». Различия в характере используемых методов противораковой терапии свидетельствуют о том, что даже в развитых странах еще не удалось добиться повсеместной оптимизации ее программ. Около одной трети всех больных раком нуждаются в лучевой терапии либо отдельно, либо в сочетании с хирургическим лечением, тогда как потребность в хирургическом лечении отдельно или в сочетании с другими методами выявляется в половине случаев заболевания раком.
Менее одной десятой всех больных раком подвергаются химиотерапии, гормонотерапии и другим видам лечения, а около четверти всех больных либо не получают специфического лечения, либо находятся на слишком поздних стадиях заболевания для применения соответствующих методов лечения. Следовательно, знание особенностей патоморфоза болезни и патоморфоза опухоли необходимо для оптимизации лечения. Решение этой проблемы требует решения многих частных вопросов, например, определяет ли гистологическое строение опухоли ее чувствительность к лечебному фактору (излучению, хнмиопрепарату, гормону и т. д.). В широком плане вопрос должен решаться в рамках проблемы взаимоотношения общего и частного с тем, чтобы не уклониться в морфологизм, функционализм и другие крайности.
В зависимости от клинической ситуации и цели исследования для выявления и оценки патоморфоза можно использовать любые доступные методы и подходы клинические, морфологические, радиологические, рентгено логические, биохимические и др. Неуклонно возрастает роль цитологических исследований в оценке патоморфоза. Каждый метод используемся либо самостоятельно, либо в комплексе. Объектом морфологического исследования может быть биопсийныи, операционный и секционный материал. Морфологическое исследование леченых опухолей не отличается от общих правил обработки онкологического материала.
Следует лишь подчеркнуть 3 момента. Во-первых, на всех этапах исследования должно руководствоваться клинико-анатомическнм принципом, который подразумевает тесный контакт патологоанатома и клинициста на практике и в познании. Приступая к исследованию материала, патологоанатом должен располагать необходимыми клиническими сведениями о больном, о цели и об особенностях проведенного лечения (метод лечения, доза облучения или химиопрепарата, вид и сроки оперативного лечения и т. п. ). Без данных о характере лечения производить оценку патоморфоза не рекомендуется ввиду возможных ошибок и дискредитации морфологического метода и самого исследования.
Во-вторых, максимального внимания заслуживают те случаи, в которых после лечения визуально опухоли не находят. При предоперационной лучевой и/или химиотерапии с видимым исчезновением опухоли операционный материал приходится исследовать иногда повторно с обработкой большого числа биоптатов. Снять диагноз «рака» почти всегда бывает труднее, чем его установить. В-третьих, при оценке патоморфоза обязателен сравнительный метод. Сравнение может быть либо на уровне конкретного больного (повторные пункции опухоли и биопсии в процессе лечения, сравнение биопсийного и операционного материала и т.д.), либо на уровне группы больных одной нозологической формой (сравнение типичных проявлений болезни).
— Вернуться в оглавление раздела «гистология»
Источник
Тройной негативный рак молочной железы
Тройной негативный рак молочной железы
Что такое тройной негативный рак молочной железы?
В большинстве случаев рост клеток рака молочной железы зависит от наличия в организме женских половых гормонов, эстрогена и прогестерона, кроме того, во многих случаях в злокачественных клетках выявляется большое количество белка HER2 (гиперэкспрессия HER2). И рецепторы эстрогена/прогестерона и HER2 являются мишенями, на которые можно воздействовать с целью подавления роста опухоли и уничтожения раковых клеток (подробнее про разновидности рака молочной железы) [1].
Опухоли, в которых отсутствует экспрессия рецепторов эстрогена и прогестерона, а также не выявляется повышенной выработки белка HER2, относятся к так называемому тройному негативному раку молочной железы. Для обозначения этой разновидности рака может также использоваться термин «базально-подобный рак молочной железы». Рост клеток опухолей, которые относятся к этому подтипу, не зависит от стимулирующего влияния женских половых гормонов и белка HER2, по этой причине для лечения этого вида рака молочной железы не применяется ни гормонотерапия, ни анти-HER2 препараты. Тройной негативный рак молочной железы характеризуется агрессивным течением, его клетки склонны к быстрому делению, что сопровождается высокими темпами роста опухоли. Как правило, эти опухоли также характеризуются большим значением индекса Ki-67. Отсутствие трех основных мишеней для лечения и дало название этой разновидности рака молочной железы. На его долю приходится 10-20% случаев злокачественных опухолей молочных желез.
Предоперационная терапия при тройном негативном раке молочной железы
Тем не менее, этот вариант опухоли наиболее чувствителен к химиотерапии, во многих случаях на фоне её проведения можно достичь полной гибели всех злокачественных клеток. Высокая агрессивность тройного негативного рака молочной железы, а также его нечувствительность к вышеуказанным препаратам вынуждают врачей и ученых применять для его лечения особые методы лечения и искать новые лекарства, которые бы эффективно воздействовали на раковые клетки. Этот материал посвящен некоторым наиболее важным особенностям тройного негативного рака молочной железы.
В настоящее время для лечения тройного негативного рака молочной железы все шире применяется проведение предоперационной (или неоадъювантной) химиотерапии. В этом случае пациентке проводится необходимое количество курсов химиотерапии, после – оперативное лечение (удаление опухоли или всей молочной железы) и, при необходимости – лучевая терапия. Проведение лекарственного лечения до операции не только позволяет уменьшить размеры опухоли и облегчить выполнение оперативного вмешательства, но и имеет еще одно важное преимущество. Такой вид лечения позволяет оценить, насколько эффективно лекарственные препараты воздействуют на опухоль.
Достаточно часто после проведения такого лечения опухоль резко уменьшается в размерах, что является показателем эффективности предоперационной терапии. После завершения запланированного объема лечения проводится хирургическое удаление опухоли и врач-патологоанатом, изучив ткань опухоли, может сказать, насколько хорошо сработало лечение. Во многих случаях в послеоперационном материале не остается жизнеспособных опухолевых клеток – это означает, что лекарственное лечение убило все клетки, которые были в опухоли. Если предоперационная терапия оказалась высокоэффективной это свидетельствует в пользу благоприятного прогноза дальнейшего течения болезни и того, что терапия смогла или сможет убить все клетки опухоли, которые могли разнестись по организму. Это называется «полный лечебный патоморфоз» (или «патоморфоз четвертой степени»), что является благоприятным прогностическим признаков и резко снижает риск развития рецидива и появления метастазов (подробнее про пред- и послеоперационную химиотерапию).
Нарушение процессов восстановления ДНК — мишень при лечении тройного негативного рака молочной железы
У тройного негативного рака молочной железы тоже есть «уязвимое место». В клетках этих опухолей часто обнаруживается выраженное нарушение работы систем, восстанавливающих ДНК, содержащую всю основную генетическую информацию клеток и являющуюся «матрицей» для выработки всех структур и белков клетки. Клетки опухоли быстро делятся, но не могут восстанавливать свою ДНК, что делает их уязвимыми к воздействию лекарственных препаратов, повреждающих ДНК. К ним относятся алкилирующие препараты (например, циклофосфамид), а также препараты платины. Последние образуют связки между нитями ДНК (поперечные сшивки), что нарушает функционирование её функционирование и приводит к гибели опухолевых клеток. В настоящее время проводится множество исследований, посвященных изучению роли препаратов платины в лечении тройного негативного рака молочной железы. Например, в одном из исследований было показано, что добавление карбоплатина к стандартной терапии этого заболевания повышает вероятность полного уничтожения клеток опухоли на 17% [2].
В настоящее время также изучается роль препаратов, подавляющих активность PARP (ферментов, играющих важную роль в процессах восстановления ДНК) в лечении тройного негативного рака молочной железы. Функция PARP особенно важна для раковых клеток в тех случаях, когда не работают другие системы, ответственные за поддержание целостности ДНК – например, если в клетке присутствует мутация BRCA. Подавление активности PARP приводит к нарушению работы системы восстановления ДНК, что лишает клетки опухоли возможности восстановить свое ДНК после повреждения. Это приводит к очень быстрому накоплению в них мутаций и последующей гибели опухолевых клеток. Предполагается, что добавление ингибиторов PARP позволит повысить эффективность терапии. В одном из ранних исследований было показано, что применение PARP-ингибитора велипариба позволяет увеличить вероятность достижения полного патоморфоза с 26% до 51% [3].
Тройной негативный рак молочной железы и мутации BRCA
Кроме того, необходимо отметить, что во многих случаях развитие тройного негативного рака молочной железы связано с наличием мутаций в генах BRCA1 или BRCA2, особенно при развитии опухолей у пациенток молодого возраста (≤50 лет). Исследования показали, что до от 9% до 28% пациенток с этим диагнозом являются носительницами мутаций в гене BRCA1, от 3% до 17% — в гене BRCA2. Наиболее часто носительство этих мутаций встречается у пациенток, относящихся к евреям-ашкенази. Гены BRCA принимают активное участие в процессах восстановления ДНК после повреждения. Наличие этих мутаций значительно повышает риск возникновения раковой опухоли во второй молочной железе, а также злокачественных опухолей яичников.
По этой причине в настоящее время многим больным с наличием мутаций BRCA, с целью снижения риска второй злокачественной опухоли, предлагают выполнение удаления обеих молочных желез, а также, во многих случаях – профилактическое удаление яичников (придатков матки), особенно у пациенток в постменопаузе или не планирующих деторождение. Проведенные исследования показали, что проведение профилактического удаления обеих молочных желез у пациентов-носительниц мутаций в генах BRCA снижает риск развития рака молочной железы на 93%. Профилактическое удаление яичников снижает риск развития рака яичников, маточных труб и брюшины на 80%, рака молочной железы – на 50-64% [4, 5].
Кроме того, получение информации о носительстве мутации в генах BRCA важно не только для самой пациентки, но и для её близких родственников, особенно, в тех случаях, когда в семье отмечалось развитие злокачественных опухолей молочных желез, яичников и других органов. В этих случаях кровным родственникам пациентки (особенно матери, сестрам, дочерям) целесообразно пройти генетическое консультирование.
Источник
Материалы конгрессов и конференций
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
НЕОАДЪЮВАНТНОЕ ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
Э.К. Возный, Н.Ю. Добровольская, С.Н. Гуров, С.А. Большакова.
Научно-исследовательский центр рентгенорадиологии МЗ РФ, Москва
Более 100 лет тому назад родилась концепция радикализма в лечении опухолевых заболеваний. Впервые об этом упоминает William Holsted, когда описывает метод удаления молочной железы, впоследствии названный его именем. Он считал, что рак молочной железы является локо-региональным заболеванием, поэтому радикальное хирургическое вмешательство может способствовать удалению всех опухолевых клеток и «излечению» больного.
На протяжении всего ХХ века с помощью открытий в области физики, химии, биологии и других фундаментальных наук, мы все больше проникаем в механизмы функционирования опухолевых клеток, их распространения в организме, выявления факторов, влияющих на эти процессы.
При изучении процессов метастазирования было показано, что отдаленные микрометастазы могут присутствовать у 30%-90% пациентов с первичным раком молочной железы (РМЖ), даже на ранних его стадиях.
Все эти открытия способствовали развитию системных методов воздействия на злокачественный процесс с целью элиминации отдаленных опухолевых отсевов и, таким образом, достижения максимального радикализма в лечении. Полученные позитивные результаты позволили рекомендовать химиотерапию как дополнительное лечение после радикальных операций, для профилактики развития отдаленных метастазов и местных рецидивов.
Этому способствовали результаты преклинических исследований доктора B. Fisher и его коллег, которые показали, что удаление первичного очага повышает скорость роста метастазов. Как оказалось это происходит за счет стимуляции влияния сывороточного фактора роста на опухолевые клетки. В это же время в опытах in vivo было продемонстрировано, что введение циклофосфана или тамоксифена предотвращает это воздействие, и чем раньше начата адъювантная терапия, тем лучше результаты лечения.
Совсем недавно вошла в практику неоадъювантная (первичная, индукционная) химиотерапия. Первоначально ее применение ограничивалось местно-распространенными неоперабельными формами РМЖ, но по мере накопления и анализа клинических данных она стала использоваться и при операбельных формах заболевания.
Какие же цели ставят перед собой врачи проводя неоадъювантную химиотерапию?
- уменьшение объема первичной опухоли;
- уменьшение размеров и количества пораженных лимфатических узлов;
- увеличение числа консервативных хирургических вмешательств;
- элиминация отдаленных микрометастазов;
- увеличение безрецидивной и общей выживаемости;
- изучение факторов прогноза (патоморфоза опухоли, индекса апоптоза, Bcl-2; Ki-67) и в зависимости от этого планирование адъювантного лечения.
При проведении неоадъювантной химиотерапии мы имеем возможность in vivo оценить ее эффективность и, соответственно, при отсутствии ответа опухоли на проводимую терапию применить альтернативные схемы. Первичная опухоль является неспецифическим индикатором ответа микрометастазов на проведение предоперационного лечения. В некоторых работах получены данные о корреляции ответа первичной опухоли, отдаленных микрометастазов и выживаемости больных.
В данной ситуации мы можем термин адъювантная заменить на «слепая» терапия, так как все видимые проявления заболевания уже убраны и у нас отсутствует возможность оценивать эффективность лечения и, соответственно, изменять его, при необходимости.
Конечно же, исследователей интересуют и факторы прогноза при проведении предоперационной терапии, чтобы основываясь на них строить дальнейшую стратегию лечения.
В исследованиях Royal Marsden (количество больных=185), в работах Миланской и Эдинбургской групп было показано, что наиболее важными прогностическими факторами безрецидивной и общей выживаемости является объективный ответ опухоли на лечение и статус аксиллярных лимфатических узлов после проведенной терапии. В тех случаях, когда мы достигаем полного клинического и патоморфологического эффекта в опухоли и аксилярных лимфатических узлах, получены и наилучшие отдаленные результаты. В работах Эдинбургской группы получены интересные данные: 10-тилетняя выживаемость пациентов с отсутствием пораженных лимфатических узлов при патоморфологическом исследовании составляет 90%, при метастатической инвазии 1-3 лимфатических узлов — 52% и при инвазии 4-9 лимфатических узла — 18%.
Нам кажется, что здесь важно упомянуть о значении патоморфоза опухоли. В определенной степени он связан с уровнем объективного ответа и, следовательно, является одним из слагаемых, влияющих на выживаемость пациентов. Степень патоморфоза можно считать индикатором ответа опухоли на лечение, что также помогает врачам в выборе дальнейшей тактики лечения. Так, например, при 0-I степени патоморфоза опухоли, возможно, следует применить какие-то альтернативные схемы химиотерапии при проведении адъювантного лечения.
Работа по оценке значения неоадъювантного лечения проведена в нашем институте. До сих пор еще остается спорным вопрос о количестве курсов предоперационной химиотерапии. Для нас было важным выяснить, какое количество курсов необходимо провести, чтобы получить наибольший эффект и выяснить как влияют полученные результаты на эффективность лекарственной терапии, какова взаимосвязь объективного эффекта и степени лекарственного патоморфоза. В исследование включена группа в количестве 89 человек, получавших неоадъювантную химиотерапию по схеме CAF. Максимальное число курсов было 6, но так как количество больных с каждым разом уменьшалось, то мы оценили только 4 курса. В таблице 1 представлены результаты неоадъювантной химиотерапии в зависимости от количества курсов.
Таблица 1.
Влияние количества курсов неоадъювантной химиотерапии на эффективность лечения.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общий эффект (ПР+ЧР) | 47 (52,8%) | 29 (32,5%) | 14 (15,7%) |
| Полная регрессия | 17 (19,1%) | 9 (10,1%) | 6(6,7%) |
| Частичная регрессия | 30(33,7%) | 20 (22,4%) | 8 (8,9%) |
| Стабилизация | 41(46,0%) | 18 (20,2%) | 15 (16,8%) |
| Прогрессирование | 1 (1,1%) | — | — |
При анализе полученных результатов видно, что после двух курсов химиотерапии полный эффект зарегистрирован у 17 (19,1%) больных, после трех курсов он проявился еще у 9 (10,1%), а после проведения четырех курсов — у 6 (6,7%) пациентов, таким образом была выявлена группа пациенток, чувствительных к лекарственному лечению. Общий эффект после проведения всех 4 курсов химиотерапии составил — 35,9%.
В нашей работе была проанализирована зависимость степени лекарственного патоморфоза от количества курсов. Стабилизация заболевания после 2 курсов терапии была получена у 41 (46,0%) больной, после радикального хирургического лечения выявлен патоморфоз I и II степени у 18 (20,2%) и 23 (25,8%) пациенток, соответственно. Далее 47 женщинам был проведен 3курс лечения, у 18 (20,2%) из них не отмечено нарастания эффекта, поэтому им был проведен 2 этап лечения — хирургический. Патоморфоз I степени проявился у 1 (1,1%), II степени — у 9 (10,1%), III степени — у 7 (7,8%), IV степени — у 1 (1,1%) пациентки.
После 4 курсов химиотерапии у 29 больных была выполнена мастэктомия, в этой группе также был прослежен патоморфоз: II степени — у 3 (3,3%), III степени — у 11 (12,3%), IV степени — у 1 (1,1%). Итак можно сделать вывод, что при нарастании объективного эффекта лечения увеличивается и количество больных с более высокой степенью лекарственного патоморфоза.
В таблице 2 представлены данные влияния количества проведенных курсов неоадъювантной химиотерапии на общую и безрецидивную выживаемость.
Таблица 2.
Влияние количества курсов на общую и безрецидивную выживаемость.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общая выживаемость: | |||
|---|---|---|---|
| 3 года | 88,6 +/- 8,5% | 89,0 +/- 6,5% | 90,0 +/- 1,7% |
| 5 лет | 51,1 +/- 9,9% | 54,0 +\- 7,3% | 57,7 +/- 7,3% |
| 10 лет | 33,0 +/- 13,0% | 39,6 +/- 9,8% | 37,5 +/- 11,3% |
| Безрецидивная выживаемость | |||
| 3 года | 87,6 +/- 6,2% | 88,0 +/- 6,5% | 90,0 +/- 2,7% |
| 5 лет | 44,2 +/- 6,7% | 45,0 +/- 7,3% | 46,7 +/- 7,3% |
| 10 лет | 25,0 +/- 11,8% | 29,6 +/- 9,8% | 28,5 +/- 1,3% |
При анализе общей выживаемости трехлетние результаты практически не отличаются во всех трех группах, при пятилетнем сроке наблюдения отмечается незначительное увеличение выживаемости у больных с 4 курсами химиотерапии, при десятилетнем сроке наблюдения прослеживается нарастание увеличения общей выживаемости от курса к курсу, если после 3 курсов она составила 33%, то после 4 курсов — 37,5% (р=0,023).
При сравнении безрецидивной выживаемости можно также констатировать зависимость ее продолжительности от количества проведенных курсов лекарственной терапии, здесь также получены статистически достоверные результаты (р=0,032).
Из всего вышесказанного можно сделать вывод, что увеличение количества курсов неоадъювантной химиотерапии в группе больных с нарастанием объективного эффекта лечения и, соответственно, степени лекарственного патоморфоза способствует увеличению общей и безрецидивной выживаемости.
Важными факторами прогноза ответа опухоли на лечение являются следующие биологические параметры — индекс апоптоза (АИ), индекс пролиферации (Ki-67), и Bcl-2 (экспрессия белков). Работа по оценке биологических параметров ответа опухоли на лечение была также проведена в госпитале Royal Marsden. Полученные результаты подтверждают гипотезу о том, что апоптоз и пролиферация клеток зависимы друг от друга: снижение уровня апоптоза и пролиферации при повышении значения Bcl-2можно трактовать как появление резистентности клеток рака молочной железы к цитостатикам. В этом же исследовании проводили сравнение значений индекса апоптоза до и через 24 часа после проведения химиотерапии. Если эти результаты подтвердятся при проведении большого рандомизированного исследования, то мы получим уникальную возможность прогнозирования ответа опухоли на проводимое системное лечение сразу же после его начала, что даст нам возможность скорректировать план и схемы терапии.
Переходя от факторов прогноза к причинам, побудившим ученых начать рандомизированные исследования по изучению роли индукционной химио и гормональной терапии, следует отметить, что в работах на животных, перед хирургическим вмешательством проводилась системная терапия цитостатиками и тамоксифеном. Результатом данной работы стало увеличение общей выживаемости. Предположили, что удлинение продолжительности жизни явилось следствием уменьшения опухолевой диссеминации во время операции. Успех более раннего проведения системной терапии согласуется с гипотезой Goldie-Goldman, которая обосновывает необходимость более раннего воздействия на метастазы, учитывая возможность образования химиорезистентных мутантных клеток.
Интерес представляют данные одного из основополагающих исследований В-18, проведенное по эгидой NSABP (National Surgical Adjuvant Breast and Bowel Project), целью которого было сравнить безрецидивный промежуток и выживаемость в группах с неоадъювантной и адъювантной химиотерапией. Также перед учеными стояла задача определить насколько уменьшение размеров первичной опухоли или пальпируемых лимфатических узлов коррелирует с удлинением безрецидивной и общей выживаемости, а также насколько такой подход к лечению способствует увеличению уровня консервативных хирургических вмешательств.
В исследование было включено 1523 пациентки с первично-операбельными формами РМЖ и ожидаемой продолжительностью жизни — 10 лет. Набор больных производился в течение 5 лет с 1988 по 1993 годы. Для проведения химиотерапии как в неоадъювантном, так и в адъювантном режимах была выбрана схема АС (доксорубицин 60мг/кв.м и циклофосфан 600мг/кв.м) каждые 3 недели, всего планировалось провести 4 курса . Все женщины старше 50 лет принимали тамоксифен в дозе 20мг в день. Лучевую терапию начинали в течение 4 недель после проведения консервативной операции в группе с предоперационной химиотерапией (1), в группе в адъювантной химиотерапией (2) лучевая терапия проводилась в течение 4 недель после её окончания.
В первую группу было набрано 747, во первую -759 пациенток. Объективный эффект получен у 80% больных, полная регрессия опухоли (ПР) — у 36%, патоморфологическая полная регрессия (ППР) — у 26%. Уменьшение размеров лимфатических узлов отмечено у 89%, при этом ПР получена у 73% женщин. Количество консервативных хирургических вмешательств в первой группе увеличилось на 12% от планируемого уровня, при этом следует отметить, что у пациенток с размером опухоли > 5,1см — число органосохраняющих операций увеличилось до 175%.
Оценивая результаты этого исследования можно сказать, что наиболее важными факторами, влияющими на выбор тактики хирургического вмешательства является размер опухоли и статус лимфатических узлов. Чаще всего такой объем операции предполагалось выполнить пациенткам без поражения лимфатических узлов, возраст в данной ситуации не играл роли.
При анализе данных по безрецидивной и общей выживаемости в этих двух группах выяснилось, что значительных различий по этим двум параметрам в течение 5 лет наблюдения получено не было. В первой группе безрецидивная выживаемость составила 67,3% и 66,7%, соответственно, во второй. Также значительных различий не было получено при сравнении результатов отдаленной безрецидивной выживаемости — 73,2% и 73,3%, соответственно.
Конечно же, многих интересует вопрос об уровне местных рецидивов. За время наблюдения процент локо-региональных рецидивов составил 5,8% в послеоперационной группе и 7,9% в предоперационной группе. При этом полученные различия недостоверны.
Оказалось, что в развитии местных рецидивов наиболее значимую роль играет возраст (р 49 лет), то есть там, где женщины принимали тамоксифен. Аналогичные данные получены и в других работах. Поэтому одним из перспективных направлений в развитии стратегии неоадъювантной терапии является внедрение различных эндокринных препаратов. Например, в Великобритании уже начато рандомизированное исследование, где больные набираются в 3 группы, в одной пациентам предлагается прием только тамоксифена, в другой — аримидекса, в третьей — комбинации тамоксифен + аримидекс. Его целью является определить клинические и/или биологические различия (уровень пролиферации) при трех методах лечения.
Подводя итоги проведенных клинических исследований, мы можем сказать, что неоадъювантная химиотерапия может способствовать уменьшению размеров первичной опухоли, размеров и количества пораженных лимфатических узлов, что дает нам возможность увеличить число выполняемых органосохраняющих операций. Кроме того, она позволяет элиминировать отдаленные микрометастазы и помогает спланировать адъювантное лечение в зависимости от полученного патоморфоза опухоли и таких факторов прогноза, как экспрессия Bcl-2, индекса апоптоза и индекса пролиферации опухолевых клеток — Ki-67.
Единственным контраргументом для проведения предоперационной химиотерапии является проблема местного контроля за заболеванием. Исследования, в которых пациентам проводилось хирургическое лечение и лучевая терапия показали, что риск развития местного рецидива возрастает при увеличении объема пораженных тканей. Например, выявлено, что иногда две разные формы опухоли — внутрипротоковый рак и инвазивный рак могут занимать одинаковые объемы в молочной железе при обследовании на предоперационном этапе, хотя, обычно, внутрипротоковый рак имеет значительно меньшие размеры. Существует опасность, что какое-то число опухолевых клеток может оказаться за границей резекции. Весь вопрос в том, сколько их осталось в молочной железе? На данном этапе ответом могут служить данные, полученные при микроскопическом изучении краев резекции.
Во Франции, была проведена работа, где в одной группе на первом этапе лечения проводилась химиотерапия и лучевая терапия с последующей туморэктомией (она выполнена 47 пациенткам с остаточной опухолью Поделиться |
Источник