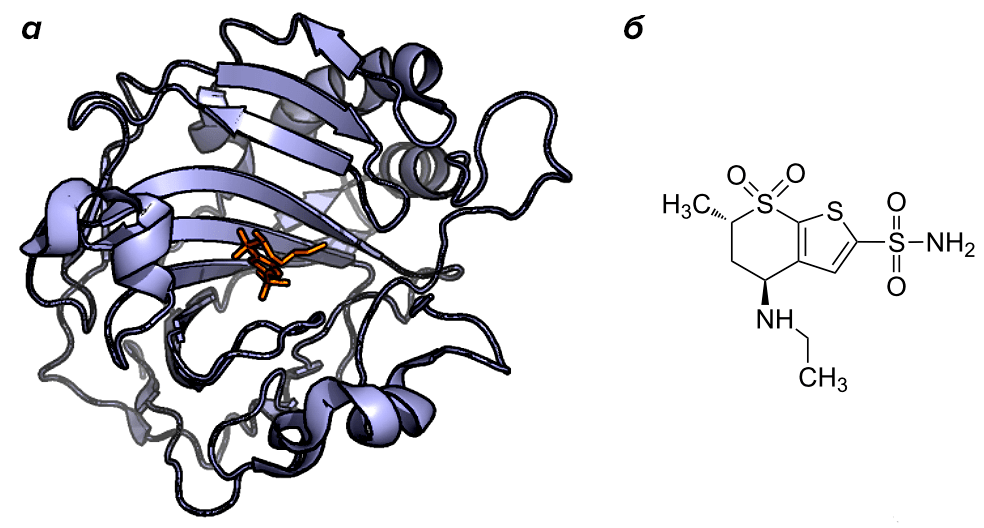- Молекулярное действие лекарств (молекулярные мишени)
- Содержание
- МОЛЕКУЛЯРНОЕ ДЕЙСТВИЕ ЛЕКАРСТВ [ править | править код ]
- Поиск лекарственных мишеней
- Поиск лекарственных мишеней
- Современные лекарства
- Молекулы под прицелом: как «попасть» поточнее?
- Начало большого пути: первые попадания в цель
- Классификация мишеней
- Клинические исследования
- Мишень и лиганды
- Собирая пазл: как подобрать лиганд
- На смену статике — динамика
- Антагонист главного героя
- Сумма технологий: как собирают данные для выбора мишеней
- Иголка в стоге сена: поиск и валидация мишеней
- Скрининг и открытие мишеней
- Важное видится издалека: как эволюционная биология помогает выбирать мишени
- Фенотипический скрининг
- Валидация — начало
- Валидация на клетках
- Amersham Typhoon — лазерные сканеры для биомолекул
- Валидация in vivo
- Клиническая валидация
- Заключение
Молекулярное действие лекарств (молекулярные мишени)
Содержание
МОЛЕКУЛЯРНОЕ ДЕЙСТВИЕ ЛЕКАРСТВ [ править | править код ]
Мишень — это молекула с центром связывания для лекарства. Эта молекула может содержать мембранные белки, распознающие гормоны или нейротрансмиттеры (рецепторы), а также ионные каналы, нуклеиновые кислоты, молекулы-переносчики или ферменты. Но не все лекарства действуют на рецепторы.
Большинство лекарств должны связаться с молекулярной мишенью, чтобы произвести эффект, но существуют и исключения. Уже в первых исследованиях эффектов лекарств на тканях животных в конце XIX в. стало ясно, что большинство лекарств реализуют специфическое действие в определенных тканях, т.е.:
- лекарство, которое оказывает эффект на один тип ткани, может не влиять на другой;
- лекарство может оказывать совершенно разные эффекты на разные ткани.
Например, алкалоид пилокарпин, как и нейротрансмиттер ацетилхолин, вызывает сокращение гладких мышц кишечника и тормозит частоту сердечных сокращений. С учетом этих феноменов Сэмуэль Лэнгли (1852-1925) в 1878 г., основываясь на изучении эффектов алкалоидов пилокарпина и атропина на слюноотделение, предположил, что «существуют некие рецепторные вещества. с которыми оба могут образовывать соединения». Позже, в 1905 г., изучая действие никотина и кураре на скелетные мышцы, он обнаружил, что никотин вызывает сокращения, когда действует на определенные небольшие участки мышц. Лэнгли заключил, что «рецепторная субстанция» для никотина находится в этих участках и что кураре действует путем блокады взаимодействия никотина с рецептором.
Считается, что Пауль Эрлих (1854-1915) самостоятельно разработал теорию рецепторов, наблюдая, как многие органические красители селективно окрашивают специфические компоненты клетки. В 1885 г. он предположил, что у клеток есть «боковые цепи», или «рецепторы», к которым лекарства или токсины могут присоединяться, реализуя свое действие. До сих пор Эрлих известен благодаря своей идее о «волшебной пуле» — химическом соединении, образованном для выявления селективной токсичности, например, инфекционного агента. Кроме того, Эрлих синтезировал органические производные мышьяка, которые использовали ранее при лечении сифилиса. Развивая теорию рецепторов, Эрлих был первым, кто показал, что быстрая обратимость действия алкалоидов свидетельствует о непрочных (нековалентных) химических связях между лекарством и рецепторами.
Последние достижения молекулярной биологии раскрывают природу связи лекарство-рецептор на молекулярном уровне. Сегодня под рецептором понимают специфическую молекулярную структуру, которая работает как молекулярная мишень для группы соответствующих лекарств (раньше связывающий центр не был определен отдельно от молекулярной мишени, и весь комплекс в целом рассматривали как рецептор).
Не все лекарства имеют молекулярные мишени
Для лекарств, действующих на ферменты, молекулярной мишенью является фермент. Рецептором выступает та часть фермента, которая связывается с лекарством. Для большинства лекарств молекулярными мишенями являются белки, углеводы, липиды и другие макромолекулы, на которые направлено действие препаратов. С этой позиции молекулярные мишени определены более точно, чем другие рецепторы.
Сегодня рецепторы определены и охарактеризованы с помощью методов молекулярной биологии. Действие некоторых типов лекарств легко объяснить без вовлечения молекулярных мишеней человека. К этим типам лекарств относятся антациды (буферы), которые уменьшают кислотность в желудке, формообразующие слабительные и комплексообразователи. Есть вещества, для механизма действия которых характерно отсутствие четкой химической специфичности. Основным примером являются газообразные и летучие общие анестетики, включая инертный газ ксенон. Для этих препаратов практически невозможно определить связывающий центр или одну молекулярную мишень. Тем не менее, вероятно, их фармакологические эффекты происходят из-за действия на компонент мембран (например, потенциал- или лиганд-зависимые ионные каналы). Этот компонент и является молекулярной мишенью для анестетиков.
Теория рецепторов очень важна для средств, которые действуют сходно или антагонистически гормонам, нейрогормонам, нейротрансмиттерам и аутакоидам
Лекарства (включая такие растительные алкалоиды, как никотин, кураре и атропин), которые оказывают сходные или противоположные нейротрансмиттерам эффекты, привели Лэнгли к формулировке теории рецепторов. Изучение действия этих средств первоначально сводилось к оценке их эффектов у животных и на изолированных тканях: например, на артериальное давление, частоту сердечных сокращений, секрецию или, чаще, сокращения гладких мышц кишечника, бронхов, сосудов или матки. Эти эффекты давно расценивают как побочную реакцию на взаимодействие лекарств с их рецепторами. Теория рецепторов способствовала развитию подходов, использующих эти данные для классификации лекарств по рецепторам, с которыми они взаимодействуют, и разработке новых лекарств, нацеленных на специфические рецепторы.
Классические рецепторы нейротрансмиттеров или гормонов в основном представлены крупными белками, содержащими участки, которые «распознаются» лекарствами и связываются с ними (рис. 2.1). Эти связывающие центры обычно ассоциированы с системой переноса
Стало ясно, что многие рецепторы являются белками. Они содержат как минимум один отдельный центр, с которым связываются и агонисты, и антагонисты. Когда связывается агонист, он запускает цепь трансдукции, которая либо непосредственно вызывает измеримый ответ (например, открытие канала), либо изменяет активность фермента, что в свою очередь приводит к измеримому ответу. Связь между действием агониста и трансдукцией может быть прямой или вовлекать в действие вторичные мессенджеры и каскад других белков. В общем случае трансдукцию вызывает не распознаваемый участок, а, скорее, происходящие аллостерические изменения рецепторной молекулы, обусловливающие каталитическую активность других частей белка (обычно во внутриклеточной среде). При этом другие части молекулы рецептора могут работать как мишени для других типов лекарств-ингибиторов, которые не являются конкурентными антагонистами.
Активный комплекс агонист-рецептор вызывает клеточный ответ через реакцию трансдукции
Активный комплекс агонист-рецептор инициирует трансдукцию либо локально на уровне мембраны, либо внутриклеточно. Примеры системы трансдукции приведены далее. Общепризнано, что в большинстве случаев ассоциация агониста с рецептором ведет к конформационным изменениям последнего и возникновению активного комплекса лекарство-рецептор. Это дает основу для модели, с помощью которой можно объяснить различное действие агонистов, частичных агонистов и антагонистов.
С рецептором могут связываться различные типы лекарства. Здесь связывание определяет лекарство в качестве лиганда для рецептора, а результат связывания показывает, является ли лекарство агонистом, антагонистом, частичным агонистом или обратным агонистом:
- если лиганд связывается с рецептором и вызывает молекулярный ответ (конформационное изменение рецептора) с последующим клеточным ответом, это агонист;
- если лиганд связывается с рецептором без индукции молекулярного ответа, ведущего к клеточному и тканевому ответу, и конкурентно блокирует доступ агониста к рецептору, этот лиганд рассматривают как конкурентный антагонист;
- если лиганд связывается с рецептором таким образом, что даже высокие концентрации не могут вызвать достаточный молекулярный ответ, лиганд называют частичным агонистом. Следовательно, максимальный тканевый ответ на действие частичного агониста будет меньше, чем на действие «полного» агониста;
- если лиганд связывается с рецептором, который в отсутствие агониста находится в активном состоянии, и делает этот рецептор неактивным, этот лиганд — обратный агонист.
Базальный уровень активности вызывает фоновый уровень трансдукции и клеточных эффектов. Когда обратный агонист связывается с активным рецептором, он инактивирует его и тем самым ингибирует базальную активность.
Тканевые ответы не обязательно прямо пропорциональны клеточным ответам, возникающим от связывания агониста с его рецептором (см. далее)
Лекарства и эндогенные вещества (гормоны и нейротрансмиттеры), которые активируют рецепторы, называют агонистами. Молекулярный ответ обусловлен активированным состоянием рецептора, который инициирует клеточный ответ.
Эндогенные агонисты есть ко многим рецепторам. Иногда эти агонисты называют первичными мессенджерами, поскольку взаимодействие с их молекулярной мишенью является первым проявлением внутриклеточных связей (аналогично другие молекулы, участвующие в развитии клеточного ответа, известны как вторичные мессенджеры).
Агонист, который полностью активирует рецептор, называют полным агонистом (см. далее в описании частичного агонизма).
В отсутствие агониста большинство рецепторов пребывают в состоянии покоя. Однако даже в этом случае рецептор может временно становиться активным, что приводит к низкоуровневому молекулярному ответу. Появление агониста изменяет равновесие в сторону активированного состояния.
Математическое соотношение между концентрацией агониста (А) и ответом определяется связыванием с рецептором (R) и ответом в результате формирования комплекса агонист-рецептор (AR), который активирует рецептор (R*). Поэтому А + R = AR =AR*. Для активации некоторых рецепторов необходима связь двух молекул агониста (А + А + R= AAR= AAR*). Для других рецепторов характерна реакция А + R + R = ARR = ARR*, т.е. присоединение агониста ведет к связыванию двух неактивных рецепторов в активированный гомодимер. Математическая основа для такого соотношения детально обсуждается далее. В книге агонисты указаны специальным значком (рис. 2.2).
В большинстве клеток максимальный клеточный ответ на действие агониста происходит только тогда, когда активирована небольшая часть рецепторов. Другими словами, рецепторов обычно намного больше, чем необходимо для достижения максимального клеточного ответа. Этот избыток рецепторов (резервные рецепторы) очень важен, поскольку он увеличивает чувствительность клетки к малым изменениям концентрации агониста (см. далее).
Частичный агонизм — это неэффективная активация рецептора
Лекарство, которое относительно неэффективно активирует рецептор, является частичным агонистом. Частичный агонист — это средство, взаимодействие которого с рецептором оказывает эффект меньше максимального либо вызывает или не вызывает молекулярный ответ (недостаточный молекулярный ответ). В любом случае максимальный клеточный ответ на действие частичного агониста меньше, чем максимальный клеточный ответ на действие полного агониста, действующего на тот же рецептор без вовлечения резервных рецепторов. Для частичных агонистов необходимо взаимодействие с большим количеством рецепторов для возникновения максимального клеточного ответа, когда нет неоккупированных рецепторов или остается их небольшое количество. Если присутствует множество резервных рецепторов, возможно, что частичный агонист вызывает максимальный клеточный ответ, хотя считается, что частичный агонист менее эффективен, чем полный, и требует большей оккупации рецепторов для возникновения максимального клеточного ответа (см. далее). Большинство клеток содержат намного больше рецепторов, необходимых для возникновения максимального клеточного ответа, поэтому частичные агонисты чаще всего способны вызвать максимальный клеточный ответ, сходный с действием полных агонистов, но для этого необходимы очень высокие дозы препаратов.
Обратный агонизм — это инициация явного клеточного ответа путем торможения спонтанной активации рецептора
Молекулярный ответ на обратный агонизм может быть:
- инактивацией активированного рецептора;
- стабилизацией рецептора в неактивной конформации.
Данная модель выглядит как R = R* и I + R* = IR, где R* — активированное состояние, I — обратный агонист.
Антагонизм — это предотвращение действия агониста
Многие лекарства связываются с рецептором, образуя комплекс лекарство-рецептор, который не вызывает клеточного ответа. Более того, оккупация рецептора антагонистом препятствует либо связыванию агониста, либо возникновению клеточного ответа при связывании агониста с рецептором. Таким образом, антагонизм может быть результатом различных молекулярных механизмов. Математическое описание эффектов различных типов антагонистов приведено далее. Кратко — антагонизм может возникать вследствие:
- связывания антагониста в том же участке рецептора, который в норме занимает агонист. Связывание антагониста препятствует оккупации центра агонистом (конкурентный антагонизм);
- связывания антагониста с участком рецептора, который в норме не оккупирует агонист (аллостерический центр), ведущего к конформационным изменениям связывающего центра агониста, что либо препятствует связыванию агониста, либо делает невозможным возникновение молекулярного ответа.
Антагонист, связывающийся с аллостерическим центром только в отсутствие агониста, называют неконкурентоспособным антагонистом. Если антагонист может связываться с аллостерическим центром даже в присутствии связанного агониста, его называют неконкурентным антагонистом. В данном случае центр часто называют лиганд-связывающим (где лигандом может быть агонист, антагонист, частичный агонист и др.).
Таблица 2.2 Шесть возможных типов антагонизма
Источник
Поиск лекарственных мишеней
06 декабря 2019
Поиск лекарственных мишеней
Лекарство, как управляемая ракета, должно попадать точно в цель
Автор
Редакторы
Вводная статья нашего спецпроекта рассказала, что многие лекарства были открыты случайно, и механизм их действия поначалу был неизвестен. Настоящая рациональная (научная) разработка лекарств стала возможна только после того, как ученые осознали, что у каждого лекарства в организме есть одна или несколько мишеней. Что такое лекарственная мишень, как, зная ее, найти или изобрести лекарство, и как найти саму мишень — расскажет эта статья.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Говоря о современных методах разработки лекарственных препаратов — а особенно о «мишенях», выбор которых ложится в основу всего процесса, — следует сразу оговориться: долгие годы создание лекарств происходило без использования технологий, которым посвящена эта статья. Пожалуй, современная биомедицина — и конкретно рациональный дизайн лекарственных препаратов (Rational Drug Design, RDD) [1], — ярчайшая иллюстрация прогресса наук об устройстве жизни. Каждое новое лекарство показывает, как эти знания и технологии конвертируются во что-то осязаемое, доступное широкой публике — ведь почти каждый из нас хотя бы иногда принимает лекарства, а многие вынуждены делать это постоянно. И всё же лекарственная индустрия очень долго не имела надежного представления о молекулярных процессах в живых системах и о том, как развиваются болезни.
Тем более у нас отсутствовали знания о конкретных молекулярных «мишенях», воздействие на которые могло бы обратить болезнь. Создание первых лекарств не просто шло путем проб и ошибок — это присуще науке в целом, — этот путь совершенно не учитывал принципов устройства живой материи на уровне молекул. Ученые и врачи, создавая первые лекарства, даже если и понимали, что по сути они работают с одними молекулами, воздействующими на другие молекулы, совершенно не представляли (и не могли представить) деталей и всей сложности этих взаимодействий.
Удивительно: то, что сейчас преподают в школах и университетах, чему посвящены книги, учебники и даже научно-популярные статьи, было попросту неизвестно ученым, впервые ступившим на дорожку молекулярных исследований менее 70–80 лет назад. Увы, даже краткий экскурс в молекулярную биологию невозможен в рамках этой статьи — но на «Биомолекуле» она рассказана в картинках («Молекулярная биология» [2]), да и «Википедия» дает неплохое представление об этой истории, оставляя ощущение невероятной стремительности научного прогресса на таком коротком промежутке времени, не превышающем продолжительности жизни одного человека.
Надеемся, что и этот обзор убедит читателя в реальности прогресса в области биологии, медицины и фармацевтики. Кстати, если кто-то из вас только выбирает карьерный путь, и этот текст подтолкнет вас в сторону драг-дизайна, вам практически гарантирована интересная работа на переднем крае науки.
Прежде чем всерьез окунуться в молекулярную фармакологию, кратко обратимся к первым лекарствам, созданным во времена «упрощенных» представлений о биологии и биомедицине, — а ведь некоторые из них по сей день не теряют популярности (и эффективности):
- Первые обезболивающие выделили из природных источников (общеизвестный пример — «Аспирин» (ацетилсалициловая кислота), предтечей которого был экстракт ивовой коры). Однако следующее их поколение родилось уже из дотошного «перебора» больших библиотек молекул, притом понимания, как они работают, не было до сравнительно недавнего времени. Вероятно, самый популярный препарат из этой группы сейчас — «Нурофен» (ибупрофен). К слову сказать, если мишени ацетилсалициловой кислоты, ибупроофена и других нестероидных противовоспалительных средств (НПВС) хорошо изучены (это циклооксигеназы), то на что действует одно из самых популярных противовоспалительных — парацетамол — до сих пор в деталях не ясно.
- Антибиотики — также исходно природные вещества — уверенно ворвались в списки лекарств и (по очевидным причинам) очень быстро завоевали всеобщую популярность, но механизм их действия, опять же, долгое время оставался загадкой.
Как только исследователи не просто выделили первые лекарственные субстанции, но и доступными (тогда) методами изучили их молекулярные структуры, стало очевидно, что сознательный выбор лекарственной мишени будет ключом к куда более аккуратному, «рациональному» дизайну лекарств. Физики и химики получали все более детальную картину мира, в том числе, подтверждая, что любые процессы в живых системах — это в своей основе физические взаимодействия.
Позволим по сему поводу небольшое «лирическое отступление» и приведем высказывания двух выдающихся ученых, лауреатов Нобелевской премии:
. Если бы некий катаклизм уничтожил все научные знания, и к грядущим поколениям дошло бы только одно утверждение — то какое, составленное из наименьшего количества слов, содержало бы наибольшую информацию? Думаю, атомная гипотеза: все вещи состоят из атомов — маленьких частиц, которые беспрерывно движутся, притягивая друг друга на некоем расстоянии и отталкивая при большом сжатии. В одной этой фразе огромное количество информации о мире — стоит лишь приложить немного воображения и подумать.
Ричард Фейнман,
американский физик,
обладатель Нобелевской премии по физике [3].
. Мы все знаем, что любое явление, любое событие или, говоря широко, любое «знание», любая передача информации подразумевает физическое взаимодействие.
Жак Моно,
французский биохимик,
обладатель Нобелевской премии по физиологии или медицине [4].
Нежданно-негаданно к единому видению мира пришли и физики, и биологи. Это «выкристаллизовавшееся» в умах ученых понимание позволило создателям лекарств уверенно предположить, что зачастую патогенез определяется неправильным взаимодействием всего лишь нескольких молекул (белков, низкомолекулярных соединений), — и лишь небольшого (но тщательно нацеленного!) воздействия может быть достаточно, чтобы все исправить.
Молекулы под прицелом: как «попасть» поточнее?
Так как же разработка лекарств «спустилась» на молекулярный уровень, как и когда появилось понятие лекарственной мишени? Начнем с (вероятно, очевидного) утверждения: наиболее существенный прогресс биологии неразрывно связан с развитием экспериментальной науки, в первую очередь — физики. Изучая процессы в живых системах (и получая возможность делать это все более точными методами), ученые убедились, что биохимия и биофизика — это в первую очередь именно «химия» и «физика». Многочисленные эксперименты и наблюдения убедили ученых, что грань между живым и неживым практически стирается на уровне молекул, а уж тем более атомов. Отдельные клетки, органы, да и организмы в целом на поверку оказывались чем-то вроде «бульона» из триллионов взаимодействующих молекул. Конечно, разобраться в хитросплетении этих взаимодействий и выделить ключевые процессы непросто. Но главным моментом для развития прикладных, биомедицинских «ответвлений» биологии стало именно понимание глубоко физической природы происходящего в мире живого.
Лекарственная мишень конкретная молекула в организме, чья биохимическая функция тесно связана с возникновением и/или развитием определенной патологии, воздействие на которую молекулой лекарственного препарата дает терапевтический эффект.
Представление о белках как о главных «рабочих лошадках» и стремительное развитие физических методов прямого изучения их структур (первая была расшифрована в 1958 г. [5]) естественным образом поставили вопрос: можем ли мы, зная структуру белков, начать управлять их функциями? К середине XX века стало очевидно, что для многих белков можно найти «регуляторы» — взаимодействующие с ними молекулы (как низкомолекулярные соединения, так и другие белки), позволяющие «включать» и «выключать» практически любые процессы в организме. Оказалось, что большинство лекарств — это лиганды (то есть партнеры по связыванию) тех или иных белков, причем самые разнообразные, см. например статью «Аллостерические регуляторы GPCR: ключи от всех замков» [6].
Начало рациональному дизайну лекарств положило появление конкретных структурных данных о белковых молекулах [7]. Ведь без представления о том, как расположены атомы в молекуле белка и какие их объединяют взаимодействия, невозможно прицельно воздействовать на его структуру (а значит и на функцию). Но как только рентгеноструктурный анализ, ЯМР или иной метод структурной биологии [5] открывает нам атомарную картину белка, мы сразу получаем представление о том, как повлиять на нее — опять же, с помощью атомов. Из этого-то представления и родился «рациональный дизайн» лекарств — конструирование молекулы с пониманием, как она будет взаимодействовать со своей мишенью на молекулярном уровне.
Природа физических сил, определяющая взаимодействие молекул (в том числе — белков с лигандами), стала понятна уже давно — к середине XX века. Силы Ван-дер-Ваальса, потенциал Леннарда-Джонса, водородные связи, электростатика — эти факторы, определяющие белок-лигандные взаимодействия (да и саму структуру белка), были уже хорошо изучены физиками [8], [9]. Возникло резонное предположение, что аккуратное моделирование упомянутых взаимодействий позволило бы неплохо оценить способность малых молекул стать специфическими лигандами конкретных белков. Мы акцентируем внимание на вышесказанном, чтобы прояснить причины, определившие выбор первых белковых мишеней для рационального дизайна лекарств. Они были хороши в первую очередь тем, что:
- выполняли простую и понятную функцию — как правило, катализировали ферментативную реакцию, предопределяя некий патогенетический путь;
- их структуры, и конкретно структуры активных сайтов, были хорошо изучены экспериментально;
- было понятно, что простое «закрытие» этого сайта малой молекулой заблокирует эту реакцию — что, в свою очередь, остановит (или хотя бы замедлит) патогенез.
Начало большого пути: первые попадания в цель
Итак, выбор мишеней поначалу определялся наличием экспериментальных данных о конкретном белке — в первую очередь, его пространственной структуры. Если какой-то белок удавалось выделить и изучить для целей фундаментальной науки, то только вслед за этим специалисты в биомедицине начинали задумываться о его использовании как мишени для терапии какого-то заболевания.
Первым рационально сконструированным лекарственным препаратом, созданным на основе знания структуры и функции конкретной белковой мишени, стал дорзоламид. Этот препарат, снижающий давление жидкости в глазе — в первую очередь при глаукоме, — был разрешен к использованию FDA в 1995 г. Дорзоламид — ингибитор карбоангидразы, разработанный именно в расчете на аккуратное «закрытие» ее активного сайта, а сам этот фермент, таким образом, стал первой успешно использованной мишенью для RDD (рис. 1).
Рисунок 1. Первая мишень. а — Структура карбоангидразы с ее блокатором в активном центре — дорзоламидом. б — Структура самого дорзоламида.
Классификация мишеней
Большинство мишеней одобренных препаратов — белки. Большинство белков человека, которых насчитывается несколько десятков тысяч (если принимать во внимание все их изоформы [10]), не подходит для того, чтобы быть мишенями низкомолекулярных лекарств (по-английски они называются undruggable targets). Одобренные препараты, по разным подсчетам, действуют на 300–400 белков [11]. Биоинформатические подходы позволили идентифицировать еще не менее 700 таких потенциальных мишеней [11].
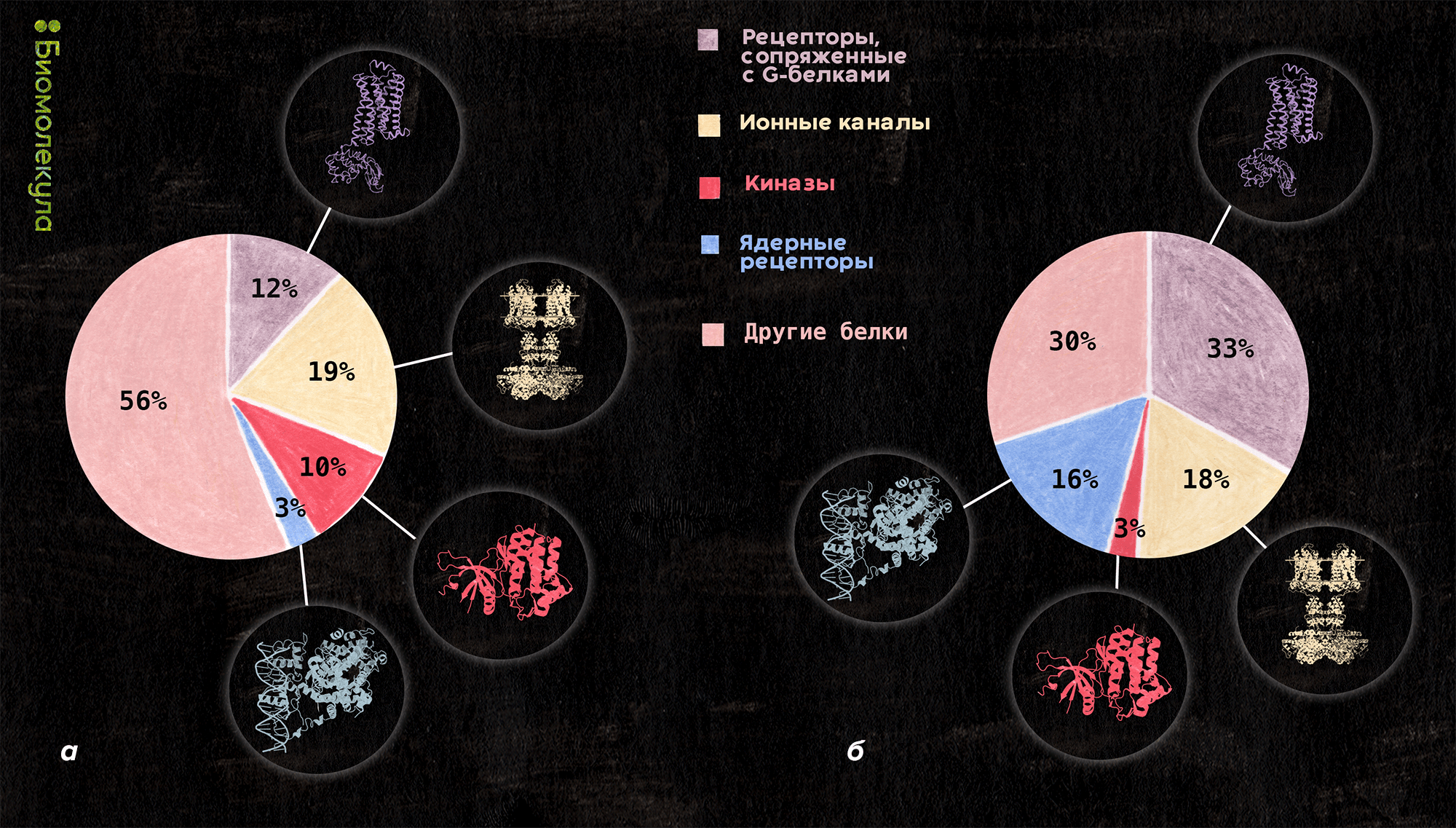
Оказалось, что классов мишеней не так уж много (рис. 2): например, около 33% лекарств воздействует на рецепторы, сопряженные с G-белками (GPCR) [12–15]. Изучение этих рецепторов, можно сказать, революционизировало рациональный дизайн лекарств. Дело в том, что именно через них проходят основные сигнальные каскады снаружи внутрь клеток, и регуляция их активности влияет на очень многие процессы в человеческом организме. Появление структур этих белков (первый экспериментально изученный человеческий GPCR — β2-адренорецептор в 2007 году [13]) стало огромным подспорьем для RDD. Показательно, сколь быстро расшифровка первых структур GPCR-белков и изучение молекулярных механизмов их работы были «вознаграждены» Нобелевской премией — огромная фундаментальная и прикладная ценность полученных данных была очевидна [16].
Рисунок 2. Распределение по типам мишеней: среди 667 мишеней (а) и среди 1194 зарегистрированных лекарств (б). Интересно, что если посмотреть, как типы мишеней соотносятся с болезнями, против которых имеются лекарства, воздействующие на эти мишени, то оказывается, что GPCR задействованы практически во всех болезнях, а киназы сосредоточены главным образом в онкологических и аутоиммунных заболеваниях. Ионные каналы чаще всего служат мишенями при заболеваниях ЦНС, дыхательной, сердечно-сосудистой систем и ЖКТ. Наиболее распространенные лекарства, действующие на GPCR — это бета-адреномиметики (агонисты бета-адренорецепторов), назначаемые при астме и ХОБЛ. Среди ингибиторов киназ можно назвать иматиниб, который используется для лечения лейкемии, и сунитиниб, применяющийся для терапии рака почки. Один из самых известных блокаторов ионных каналов — местное обезболивающее лидокаин, ингибирующий натриевые каналы. Самые распространенные лиганды ядерных рецепторов — это стероидные противовоспалительные препараты, например, преднизолон, активатор глюкокортикоидного рецептора.
иллюстрация Ирины Ефремовой по данным [58]
В прикладном — биомедицинском — аспекте достаточно упомянуть, что значительная часть сигналов боли и прочих «телесных» ощущений проходят именно через GPCR. Стал осязаемо близок «святой Грааль» хирургии и многих других разделов медицины — высокоэффективные обезболивающие препараты без побочных эффектов и привыкания. Удивительно, что создание некоторых прототипов лекарственных молекул проходит в наши дни без капли реактива — в полностью «сухих» экспериментах и виртуальных скринингах [17], [18]. Например, специалисты порою обладают настолько обстоятельными знаниями о соответствующих биохимических каскадах и работе вовлеченных в них белков, что ухитряются предсказать препараты, сразу показывающие на практике — в тестах на животных — отсутствие побочных эффектов [19]. Это самый что ни на есть яркий пример «рациональности» в конструировании, аккуратной «инженерии», лекарств.
Клинические исследования
Вместе с тем никакие лабораторные тесты и испытания на животных не могут гарантировать, что препарат окажется достаточно безопасным и эффективным у людей. При переходе к клиническим исследованиям 90% препаратов проваливается, что беспристрастно высвечивает ограниченность наших знаний и подходов. Это происходит по разным причинам, как правило, связанным с более высокими уровнями организации живого — клеточным, тканевым и организменным. Даже если мишень выбрана идеально, и создан препарат, который с ней взаимодействует, — это только начало пути. Затем требуется проведение доклинических исследований эффективности и безопасности у животных [20], а затем — три фазы клинических исследований, которым на «Биомолекуле» посвящен отдельный спецпроект. Причины провалов разнообразны: пойти не так может всё, что угодно. Например, лекарство в любой момент может проявить неожиданную токсичность, или будет слишком быстро выводиться из организма, или не будет проникать в целевые ткани, или попросту окажется слишком дорогим при промышленном производстве.
Другие популярные классы мишеней — это ферменты и транспортные белки, в первую очередь, ионные каналы [21] (15% и 29% одобренных лекарств, соответственно). Наиболее известный пример рациональной разработки ингибитора фермента — онкологический препарат «Гливек» (иматиниб), история которого уже была подробно рассказана на «Биомолекуле» [22]. Как и множество других таргетных препаратов, «Гливек» ингибирует киназу BCR-ABL. Киназы (ферменты, присоединяющие остаток фосфорной кислоты к белковой молекуле) играют ключевую роль во внутриклеточной передаче сигналов, поэтому неудивительно, что против них разработано так много лекарств, особенно в области онкологических и аутоиммунных заболеваний [23].
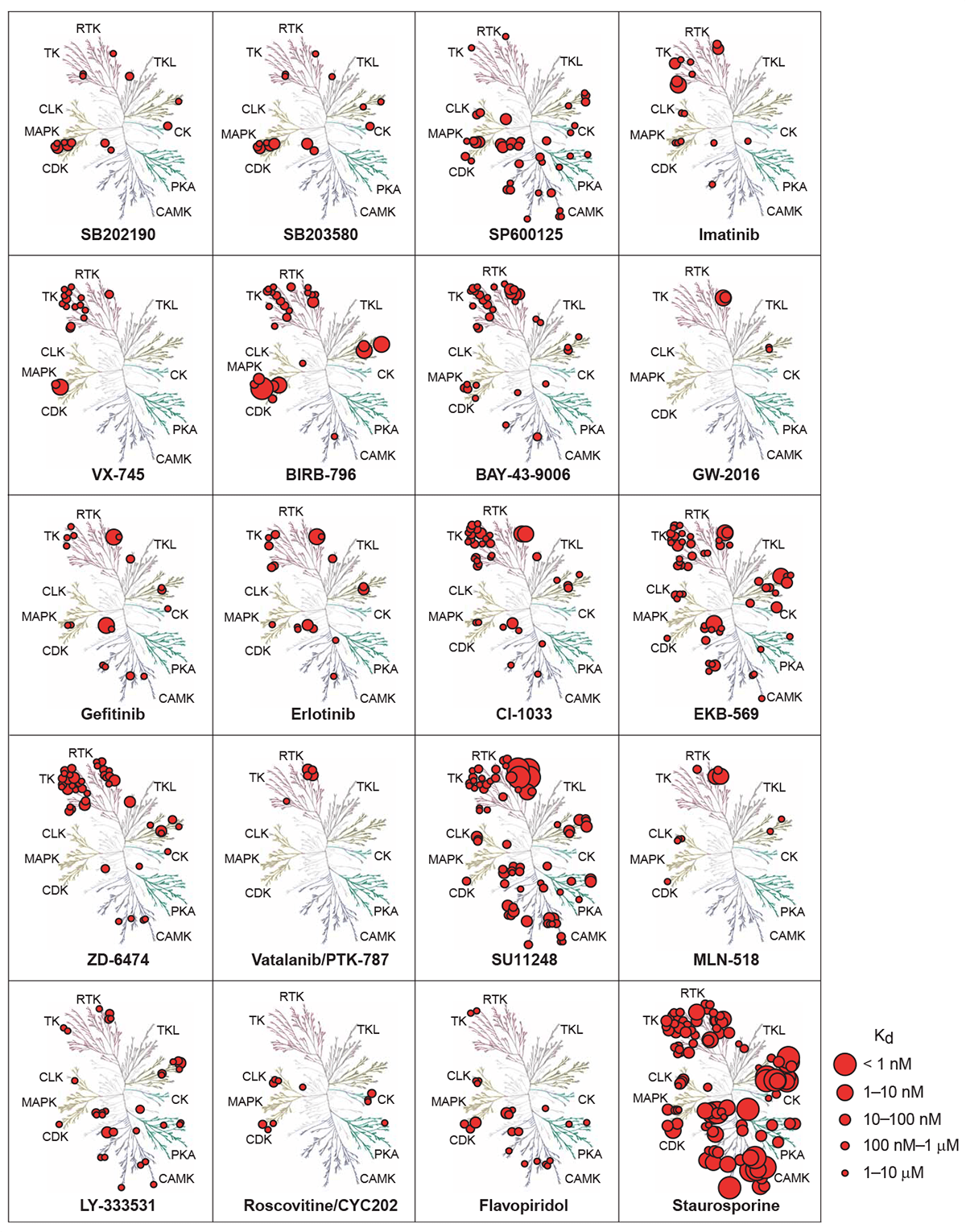
Между тем, открытие новых поколений лекарств — биопрепаратов и препаратов передовой терапии, о которых мы говорили в предыдущей статье [24], позволило подобраться и к undruggable targets. Этот тип белков отличает отсутствие достаточно глубокого сайта связывания, куда могла бы «сесть» малая молекула, потому что их лигандами, как правило, являются другие белки. Но это не препятствие для антител и пептидов: они способны связываться с высокой аффинностью даже с достаточно «гладкими» белками и мешать их взаимодействию с лигандами. Антителам также доступны растворимые белки, например, цитокины или факторы роста. Самый известный пример — антитела против TNFα [25] (инфликсимаб, адалимумаб), долгое время удерживающие пальму первенства как самые продаваемые лекарства. Еще одно преимущество антител перед низкомолекулярными лекарствами — их специфичность. Малая молекула редко связывается с одним белком: уже упоминавшиеся ингибиторы киназ ингибируют целый спектр киназ, как правило, родственных (рис. 3). Антитела же исключительно специфичны и не связываются ни с какими мишенями, кроме своей собственной.
Рисунок 3. Активность различных ингибиторов киназ, наложенная на дерево родства этих ферментов в организме. Размер красного кружка пропорционален силе ингибирования. В правом верхнем углу — «Гливек» (иматиниб).
Передовая генная и РНК-терапия идут еще дальше: вместо того, чтобы взаимодействовать с самой мишенью, они модулируют ее транскрипцию или трансляцию. Так, первый одобренный FDA антисенс-олигонуклеотид нусинерсен связывается с мРНК гена SMN2 и исправляет дефекты его сплайсинга [26]. Однако ко многим препаратам передовой терапии понятие мишени вообще неприменимо. Так, генная терапия редких заболеваний предполагает внесение в организм нормального гена вместо дефектного, то есть восстановление функции, а не прерывание. Клеточная терапия подразумевает использование живых клеток в качестве медицинского продукта, и хотя в этом случае речь идет, конечно, также о физических взаимодействиях, но терапевтический эффект определяется таким количеством взаимодействий, что выделить какую-то одну мишень невозможно.
Мишень и лиганды
Собирая пазл: как подобрать лиганд
Следующим этапом рационального дизайна стало появление так называемого фармакофорного подхода (рис. 4) [27], [28].
Фармакофор набор пространственных и электронных признаков молекулы, необходимых для оптимального взаимодействия (активации или блокирования) ее со специфической мишенью (тоже молекулой).
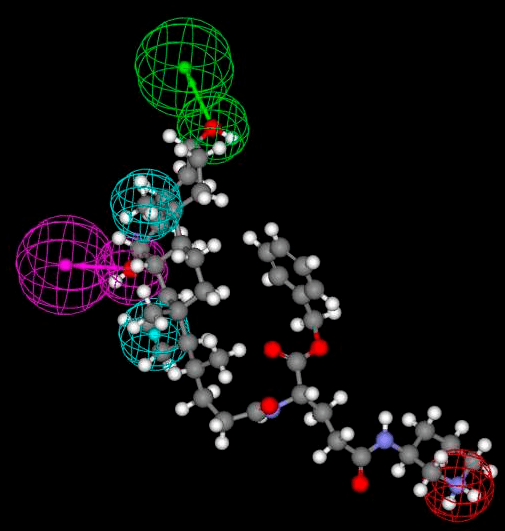
Рисунок 4. Фармакофор транспортера желчных кислот (ТЖК). Цветные сферы поверх структуры предсказанного методом фармакофоров ингибитора этого белка обозначают химические группы с заданными свойствами, определяемые исходя из строения белкового сайта связывания. Зеленым обозначен акцептор водородной связи, фиолетовым — донор, голубым — два гидрофобных остатка, красным — положительно заряженная группа. ТЖК играет важную роль в холестериновом гомеостазе, а также — что главное для нашего обсуждения! — является важнейшим переносчиком низкомолекулярных веществ в тонкой кишке. Соответственно, его ингибирование может повысить биодоступность многих предшественников лекарств (pro-drugs), а значит, позволит снизить дозу лекарства.
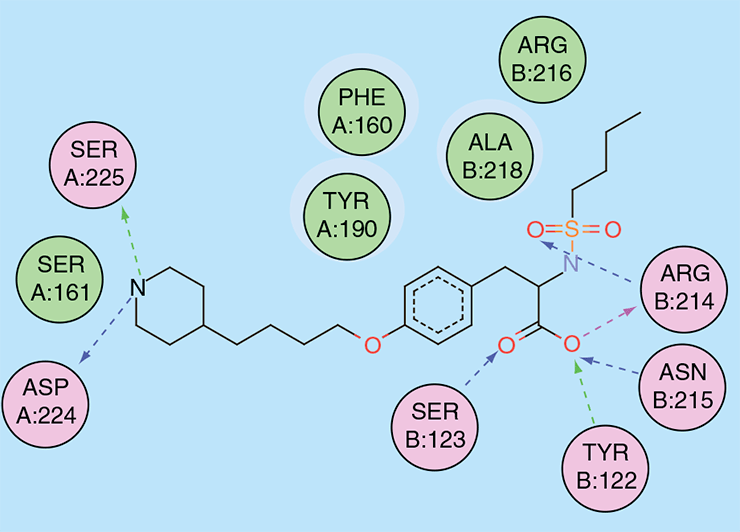
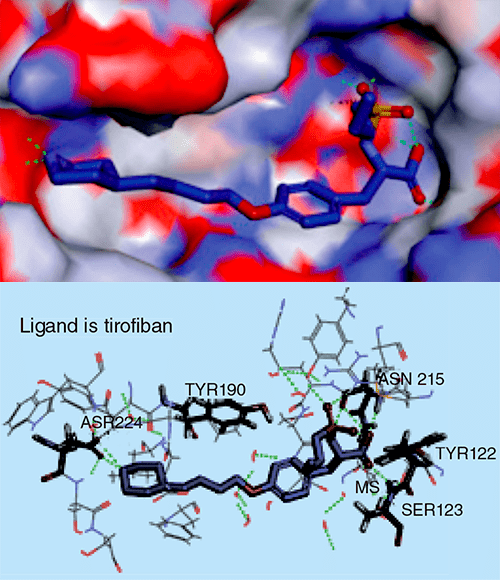
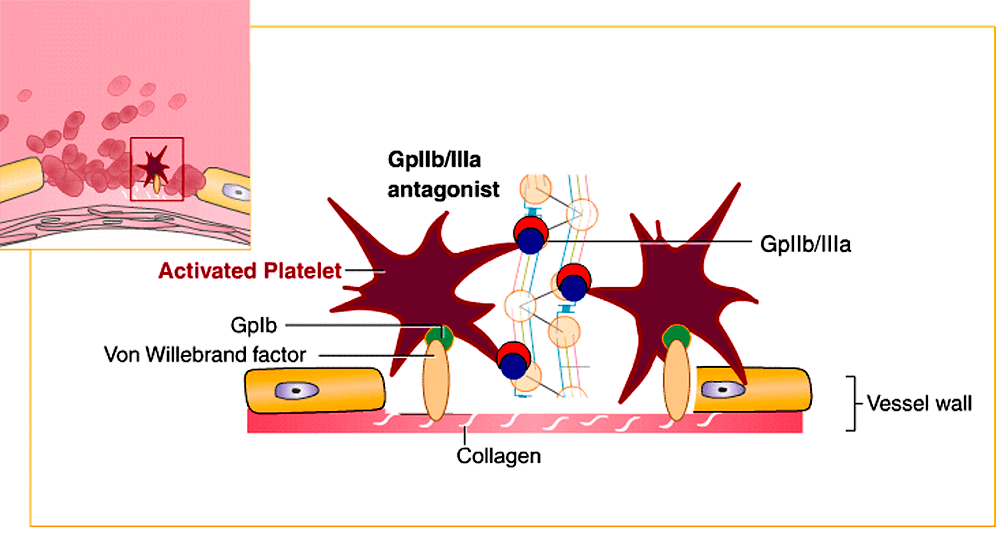
При фармакофорном подходе ищут соответствие между фармакофором и молекулами из базы данных [17], [18], [29]. Этот подход показывает самую суть рационального дизайна и поиска лекарств: мы настолько хорошо понимаем структурные, физические и химические нюансы белка-мишени как молекулярного объекта, что можем аккуратно подобрать новую молекулу, идеально соответствующую этой мишени (читай — обладающую высоким сродством к ней). Первым препаратом, созданным с использованием фармакофорного подхода, стал тирофибан, одобренный FDA в 1999 году. Это ингибитор взаимодействий между фибриногеном и интегриновым рецептором GP IIb/IIIa (рис. 5 и 6) на поверхности тромбоцитов, предназначенный для снижения тромбозов у людей с острым коронарным синдромом.
Рисунок 5а. Структура тирофибана. Кислотная «голова», содержащая алкилсульфатную группу, и основный хвост с пиперидиновой группой — ключевые особенности антагонистов GP IIb/IIIa. Ароматическое кольцо в середине необходимо для сохранения плоской конформации молекулы.
Рисунок 5б. Взаимодействие тирофибана с активным центром GP IIb/IIIa
Рисунок 6. Тирофибан (обозначен красным полумесяцем), антагонист GP IIb/IIIa, препятствует образованию тромба, блокируя взаимодействие рецептора на поверхности тромбоцита с фибриногеном.
На смену статике — динамика
Отдельные примечательные случаи воплощения принципов RDD на практике — использование представлений не просто о структуре мишеней, а о динамике работы всей системы. Ведь во многих процессах в живых организмах на молекулярном уровне не существует «отлитой в бронзе» структуры взаимодействующих объектов, а, напротив, происходит непрерывное, динамическое изменение структуры [30]. Изучив такие изменения, можно подобрать и соответствующую молекулу-регулятор. Замечательный — и недавний — тому пример: ингибитор молекулярных нуклеотидных «насосов», встроенных в капсид вируса иммунодефицита человека (ВИЧ) [31]. Оказалось, что в капсиде есть особые каналы, которые нужны вирусу для «закачки» внутрь нуклеотидов (как оказалось, именно внутри вируса, под оболочкой капсида, происходит обратная транскрипция, превращающая РНК-материал этого ретровируса в ДНК-копию для последующей встройки в геном клетки-хозяина). Изучив, как эти поры открываются/закрываются, исследователи догадались, какой должна быть форма блокатора этой поры (видео 1).
Видео 1. Ингибитор нуклеотидных «насосов» ВИЧ. На видео показано, как в капсиде вируса открывается и закрывается канал (вирусу он нужен для прокачки нуклеотидов), формируемый шестью симметрично расположенными остатками аргинина из субъединиц особого белка (этот белок, как и механизм работы канала в целом, и исследовали ученые). Анимация демонстрирует, как именно похожая на диафрагму фотоаппарата структура канала изменяется за счет конформационных подвижек боковых радикалов остатков аргинина. Именно симметрия этого канала — и симметричная динамика его работы — подсказала исследователям мысль о том, что небольшая симметричная же молекула сможет надежно закрыть канал. В итоге, лучшим вариантом такой молекулы стал гексакарбоксибензол (меллитовая кислота), который просто идеально координируется взаимодействием с шестью аргининовыми остатками. Правда, как это часто бывает, идеальный лиганд совершенно не годится в качестве лекарства, потому что он не проходит через мембраны зараженных вирусом клеток. Возможно, в будущем удастся создать более подходящие вещества на основе этой концепции.
Столь тщательный и точный подбор структуры лиганда, позволившего ингибировать мишень, не был бы возможен без изучения именно динамических изменений, происходящих и на уровне отдельных молекул белков, составляющих пору в оболочке вируса, и в контексте их взаимного движения при открытии/закрытии этой поры. Также примечательно, сколь «незамысловатой» оказалась структура итоговой молекулы — а ведь на практике она показала очень хорошую специфичность к выбранной мишени. Есть основания считать, что столь же эффективный и простой ингибитор невозможно было бы разработать, руководствуясь только статическими свойствами белка-мишени.
Антагонист главного героя
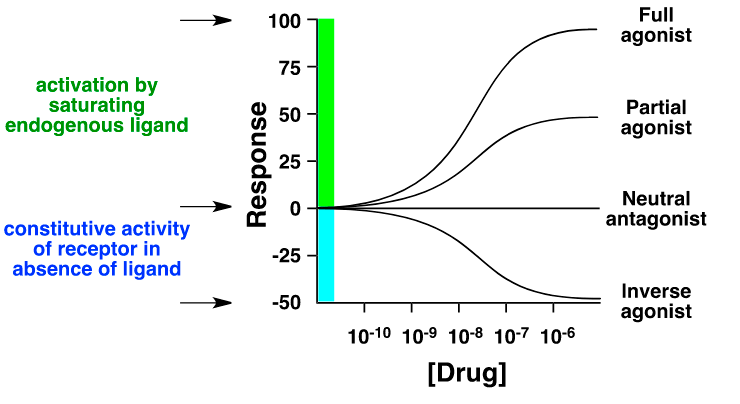
В данной статье речь идет в основном об ингибиторах (или, что то же самое, блокаторах, антагонистах) мишеней. Однако взаимодействие лекарства с мишенью может приводить не только к ее блокированию, но и, наоборот, к активации. Такие лекарства называются агонистами. Причем агонисты могут быть полными, частичными и обратными (!). Полный агонист активирует мишень в той же степени, как это делает «природный» лиганд, частичный — в меньшей степени, а обратный агонист связывается там же, где природный лиганд, но не активирует, а снижает базовую активность рецептора (рис. 7).
Рисунок 7. Кривые доза—ответ для полного агониста, частичного агониста, нейтрального антагониста и обратного агониста. Для того чтобы был возможен обратный агонизм, у мишени (рецептора или ионного канала) должен быть базовый уровень активности. Тогда нейтральный антагонист отменяет действие лиганда и возвращает уровень к базовому, а обратный агонист снижает этот уровень. Обратными агонистами являются большинство антигистаминных препаратов, таких как цетиризин и лоратадин, действующих на H1-гистаминовые рецепторы.
С ингибиторами тоже не все так просто. Их можно разделить на конкурентные, которые связываются в том же месте, что и природный лиганд, и вытесняют его, и неконкурентные (аллостерические), которые связываются в другом месте и так влияют на структуру мишени, что блокируют действие лиганда. Подробнее эти вопросы разобраны в статье «Аллостерические регуляторы GPCR: ключи от всех замков» [6].
Сумма технологий: как собирают данные для выбора мишеней
Мишени, как и сами лекарства — это молекулы, а значит, и изучать их нужно молекулярными методами. «Биомолекула» уже много писала про самые разнообразные методы изучения молекул, так что тут мы их приведем лишь тезисно, субъективно упорядочив по важности для характеризации лекарственных мишеней:
- Методы структурной биологии[5] — рентгеноструктурного анализа, ЯМР, криоэлектронной микроскопии — позволили обнаружить функциональные сайты и участки непосредственного взаимодействия биомолекул, а это прямой путь к аккуратному и осознанному выбору мишеней.
- Благодаря удешевлению секвенирования нуклеиновых кислот[32] мы получили возможность изучать геномы большого количества образцов с близкими фенотипами, что позволяет:
- находить выраженные взаимосвязи генотип—фенотип — например, широкомасштабные геномные исследования (genome-wide associations studies, GWAS) [33] выявляют болезнетворные мутации;
- изучать эволюцию на молекулярном уровне [34] в патогенезах с высокой мутабельностью — например, вирусные и бактериальные антигены, адаптирующиеся к лекарствам, или гены в раковых клетках, находящиеся под сильнейшим отбором во время онкогенеза и/или терапии.
- Благодаря развитию протеомных технологий[35] — масс-спектрометрии, хроматографии, двумерного электрофореза — стало возможным сравнивать наборы белков в опухолевых и нормальных тканях, идентифицировать аберрантные формы белков, выявлять биомаркеры патологических процессов.
- Успехи флуоресцентной микроскопии[36] (в том числе на уровне единичных клеток и даже молекул) позволяют определять положение отдельных белков внутри клеток и тканей и, тем самым, их роль в патологическом процессе.
- Развитие вычислительных методов биологии[17] — в первую очередь моделирования структуры [37] и динамики [38] биомолекул — позволяет всё бóльшую часть разработки проводить in silico. Более того, некоторые конкретные мишени и механизмы регуляции их активности можно неплохо «смоделировать» и без трудоемких (и очень дорогостоящих) экспериментальных исследований.
- Открытие ранее неизвестных механизмов регуляции биологических процессов — РНК-интерференции, CRISPR и пр. — позволяет выявлять новые классы мишеней (ранее бывшие недоступными для терапевтического воздействия).
Возможно, сейчас самый лучший момент, чтобы подчеркнуть мысль, важнейшую для рационального дизайна лекарств в целом: никакого однозначного ответа на вопрос «как искать хорошие лекарственные мишени?» нет. Подчеркнув в этом разделе, что в распоряжении биологов есть самые разнообразные технологии, открывающие для нас мир генов и белков, мы, тем не менее, констатируем, что нет (и, вероятно, никогда не будет) протокола поиска мишеней «на заказ».
Тем не менее рассмотрев отдельные методы, которыми пользуются исследователи, перейдем к стратегиям поиска мишеней, которые, хоть и не дают гарантированного результата, всё же позволяют иногда находить новые мишени и создать новые лекарства.
Иголка в стоге сена: поиск и валидация мишеней
Скрининг и открытие мишеней
Помимо биоинформатических подходов, о которых говорится в предыдущем разделе, поиск новых мишеней, конечно, осуществляется и экспериментальными методами. Современные методы позволяют перебрать множество потенциальных мишеней и выделить среди них наиболее перспективные — это называется скринингом. Один из основных методов скрининга новых мишеней — дифференциальный анализ экспрессии генов, осуществляемый, например, с помощью ДНК-микрочипов [39]. Этот метод позволяет достаточно наглядно сравнивать уровни синтеза мРНК, выделенной из клеток здорового и больного организма (рис. 8). Если выяснится, что какие-то гены в болезни особенно активны (или, наоборот, «молчаливы»), закономерно предположить, что кодируемые ими белки принимают участие в патогенезе.
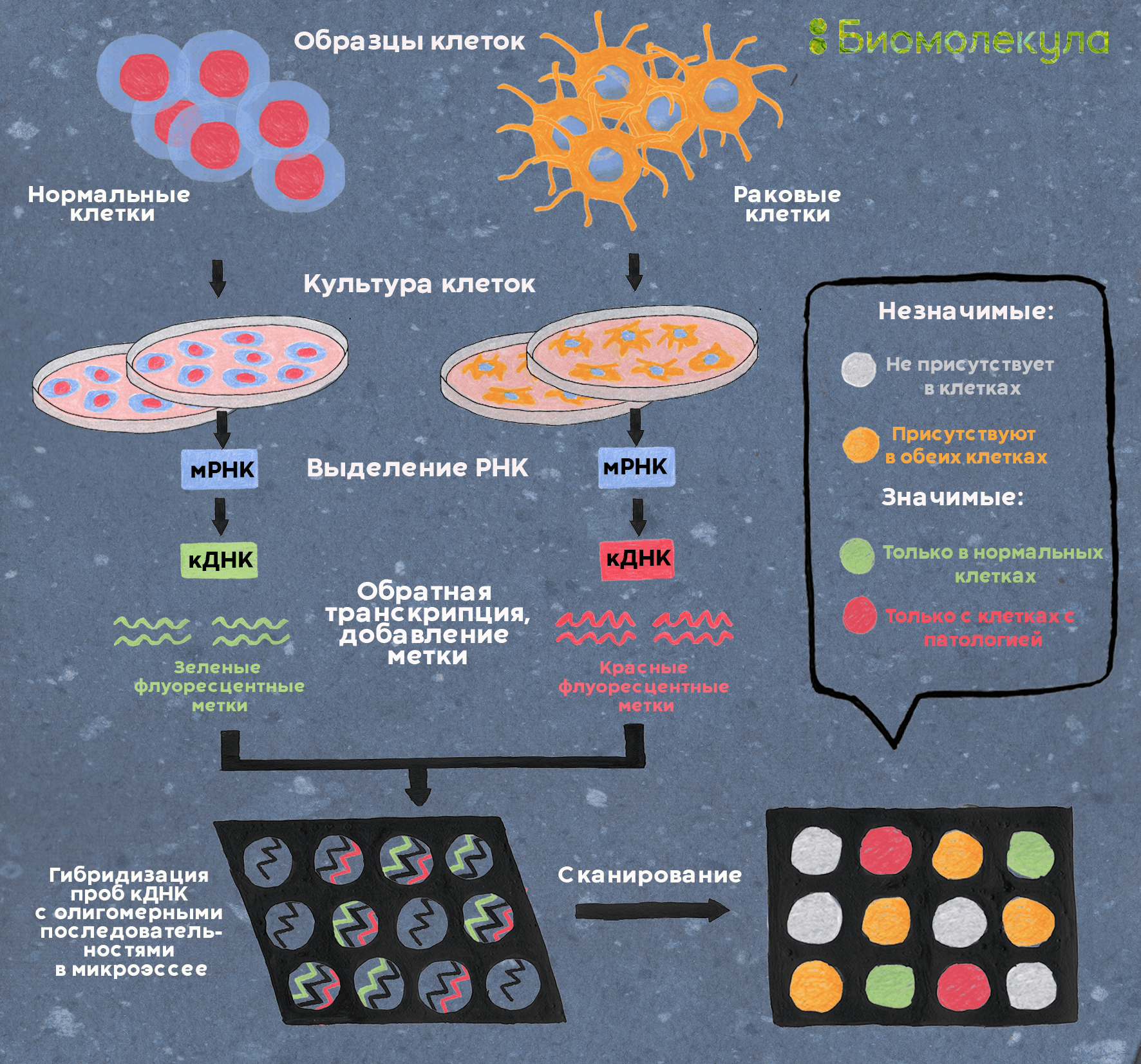
Рисунок 8. Сравнение экспрессии генов нормальной и раковой клеток. Клетки культивируют, выделяют из них мРНК, затем методом обратной транскрипции получают кДНК, меченную флуоресцентными метками (в данном случае зеленой для нормальной клетки и красной — для раковой). Смесь меченых кДНК наносят на заранее подготовленный микрочип, где в формате микромассива закреплены фрагменты генов, экспрессию которых требуется проанализировать. Меченая кДНК гибридизуется с комплементарными фрагментами генов на планшете, заставляя отдельные ячейки светиться одним из двух цветов — или их смесью. Затем интенсивность флуоресценции в каждой точке микрочипа считывают (попросту говоря, фотографируют чип) и строят тепловые карты отличия экспрессии генов в нормальных и раковых клетках (рис. 9).
Полученные данные по тысячам генов обрабатывают статистически и кластеризуют, в результате чего эволюционно родственные гены располагаются неподалеку друг от друга на так называемой тепловой карте (рис. 9). Это позволяет быстро визуализировать отличия в экспрессии отдельных генов между образцами и сделать предположения о генах, связанных с болезнью.
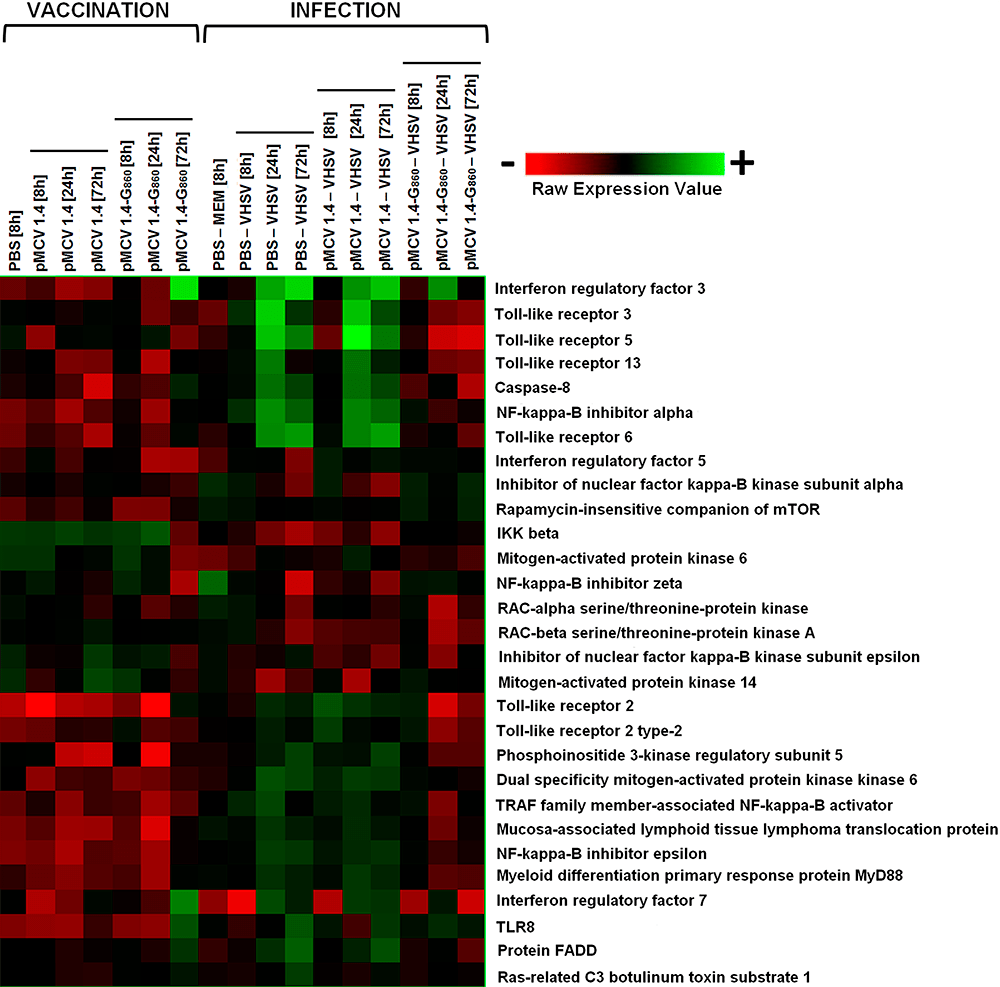
Рисунок 9. Тепловая карта, наглядно изображающая экспрессию набора генов (строки) в образцах, где изучали их экспрессию (столбцы). Из карты, например, видно (ярко-зеленая область в правом верхнем углу), как после инфекции повышается экспрессия Toll-like рецепторов 3, 5 и 13 и других белков, участвующих во врожденном иммунном ответе.
Однако анализ синтеза мРНК далеко не идеально показывает уровень и работу белков, поэтому на помощь исследователям новых мишеней спешат протеомные методы, такие как двумерный белковый электрофорез, масс-спектрометрия, многомерная хроматография и белковые микрочипы [35].
Важное видится издалека: как эволюционная биология помогает выбирать мишени
Перспективный метод поиска мишеней, особенно для противораковой, антибактериальной или антивирусной терапий, — сравнительный анализ скорости эволюции генетических последовательностей, кодирующих белки в норме и патологии. Этот метод построен на той идее, что в упомянутых патологиях гены белков, отвечающих за патогенез, будут находиться под давлением отбора. Если случайные мутации делают ген или белок эффективнее (например, катализируемая ферментом реакция идет быстрее и клетка быстрее делится), то несущие эти мутации клетки приобретают конкурентное преимущество при отборе, а такие мутации с большей вероятностью передаются по наследству. Примечательно, что отбор может быть не просто разной «силы», но еще и идти в разных направлениях [34].
В случае рака достоверно усилившийся или ослабленный отбор в образцах, взятых у отдельного пациента, можно интерпретировать как проявление обсуждаемым белком новых, не наблюдавшихся для него прежде, качеств в раковых клетках [40]. Это дает надежду, что воздействие на такой белок как на мишень изменит ход онкогенеза [41].
Такой подход предвосхищает новую эру персонализированной медицины и видится крайне эффективным для тех видов патогенеза, при которых велика скорость естественных (эволюционных) процессов и разнообразие затрагиваемых ими биохимических каскадов — но и объемы данных, доступных нам для анализа, также достаточно большие. Так как стоимость секвенирования и других методов анализа образцов неуклонно уменьшается, персонализированные генетический и биохимический анализы становятся все более распространенными.
Итак, допустим, мы выявили белки, произведенные в патологии выше (или ниже), чем в норме, или мутированные по сравнению с обычной последовательностью. Но большинство из них нельзя считать хорошей мишенью — ведь для этого белок должен играть в патогенезе прямо-таки ключевую роль: его «выключение» должно заметно тормозить развитие заболевания, ну или хотя бы облегчать симптомы. Поэтому на «тепловых картах» биоинформатика не кончается: далее определяют сигнальные каскады и сети взаимодействий, в которых участвуют выявленные белки, в попытках отыскать так называемые «мастер-регуляторы». Правда, поскольку наши знания о молекулярных механизмах патологий еще весьма фрагментарны, для разработки лекарств приходится прибегать и к различным экспериментальным подходам, не предполагающим знаний о мишенях с самого начала (см. врезку).
Фенотипический скрининг
Еще один распространенный подход, при котором поиск мишени — следствие более ранних экспериментов — фенотипический скрининг. Например, панель новых веществ, выделенных из какого-то экзотического организма, тестируют на антибактериальную активность на панели бактериальных клеток. Выявленные «хиты» (вещества, проявившие такую активность) отправляют в дальнейшую лекарственную разработку. Сейчас практически обязательным стало определение мишени для новых препаратов: регуляторы и инвесторы относятся недоверчиво к препаратам с неизвестным механизмом действия. Однако и до сих пор регистрируются препараты с недостаточно изученными мишенями, если они очень нужны пациентам, а в клинических исследованиях убедительно показана их эффективность. В конце концов, какая разница, на что воздействует лекарство, если оно действительно помогает?
Валидация — начало
Случается и так, что новый белок идентифицируют прямо в ходе скрининга (а не открывают в ходе изучения патогенеза), как это произошло с киназами семейства Jak [42]. Исследователи искали белки с последовательностями, похожими на киназы, и обнаружили новые ферменты этого семейства. На момент скрининга было понятно, что это какие-то киназы, участвующие в передаче сигналов внутри клетки, но что конкретно они делают — было неизвестно. Дальше мы на примере Jak проследим, как валидируется мишень и как в конце концов появилось лекарство тофацитиниб против ревматоидного артрита, воздействующее на нее [43].
После того как предположение о мишени было сделано (биоинформатически, или в ходе скрининга, или экспериментов по изучению патогенеза), мишень обязательно нужно валидировать — то есть доказать, что лекарственное воздействие на нее может изменить течение заболевания. Рассмотрим, как происходит валидация мишени от ее открытия до появления на рынке лекарства.
Валидация на клетках
Первый шаг — валидация мишени in vitro: доказательство, что «выключение» мишени даст желаемый эффект (например, приведет к гибели раковой клетки или остановит ее деление). Здесь удобнее всего выключить мишень на уровне трансляции с помощью малой интерферирующей РНК — это так называемый нокдаун. Также можно вообще удалить (или повредить) ген мишени в клетке или организме — это называется нокаутом. Последнее время нокауты получают с помощью системы генного редактирования CRISPR-Cas9 [44], о которой «Биомолекула» не раз писала [45–47].
Amersham Typhoon — лазерные сканеры для биомолекул
Компания Cytiva предлагает Amersham Typhoon Biomolecular Imager — лазерный сканер для визуализации и количественного анализа белков и нуклеиновых кислот, в том числе меченных флуоресцентными и радиоактивными метками.
Amersham Typhoon обеспечивает исключительное качество данных ввиду чрезвычайно чувствительной детекции, высокого разрешения и очень широкого линейного динамического диапазона. Эти универсальные системы поддерживают несколько режимов визуализации, включая ауторадиографию, флуоресценцию в красной/зеленой/синей (RGB) областях и в ближней ИК-области спектра, а также оптическую денситометрию (ОД) белков в окрашенных гелях. Для осуществления всех этих режимов визуализации в модели Amersham Typhoon 5 предлагается пятилазерная конфигурация с передовыми трубками фотоэлектронного умножителя.
Видео 2. Система Typhoon
Сканеры Amersham Typhoon обеспечивают:
- Универсальность. Одна система используется для визуализации образцов, меченных мультифлуоресцентыми и радиоизотопными метками, и колориметрических образцов на гелях, мембранах, многолуночных плашках, культуральных чашках, стеклах и тканевых срезах.
- Точное количественное определение. Позволяют обнаруживать сигналы от 3 пикограммов (пг) белка с различиями по динамическому диапазону более чем на 5 порядков величины.
- Высокое разрешение. Позволяют различать мелкие детали в образце с минимальным пиксельным разрешением в 10 мкм.
- Высокую производительность. Большая площадь сканирования (40×46 см) позволяет одновременно визуализировать до 20 гелей или блотов размером 10×8 см. Также за один сеанс сканирования можно проанализировать до 9 многолуночных плашек.
Сильные стороны этих систем визуализации — высокая чувствительность и широкий динамический диапазон для измерения в одном цикле сканирования белков малой и большой распространенности — делают их очень подходящими для анализа 2D DIGE-гелей (DIGE — differential gel electrophoresis, дифференциальный гель-электрофорез), позволяя обнаруживать и проводить точное количественное определение небольших изменений синтеза того или иного белка. За счет создания многослойного многоканального изображения для каждого геля с минимальными перекрестными помехами сканеры Typhoon 5 и Typhoon RGB позволяют использовать мультиплексный потенциал флуоресцирующих веществ CyDye DIGE для устранения экспериментальной вариабельности между анализируемыми гелями (рис. 10).
Рисунок 10. Компоненты системы DIGE и пример получаемого результата. Накладываемое изображение геля после двумерного градиентного гель-электрофореза (2D DIGE) с контрольным (лизат клеток E. coli) и обработанным бензойной кислотой образцами и внутренним стандартом. Контрольный и обработанный образцы помечены красителями Cy3 и Cy5 DIGE Fluors по протоколу маркировки минимальным красителем). Внутренним стандартом был образец, меченный красителем Cy2 DIGE Fluor.
Материал предоставлен партнёром — компанией Cytiva
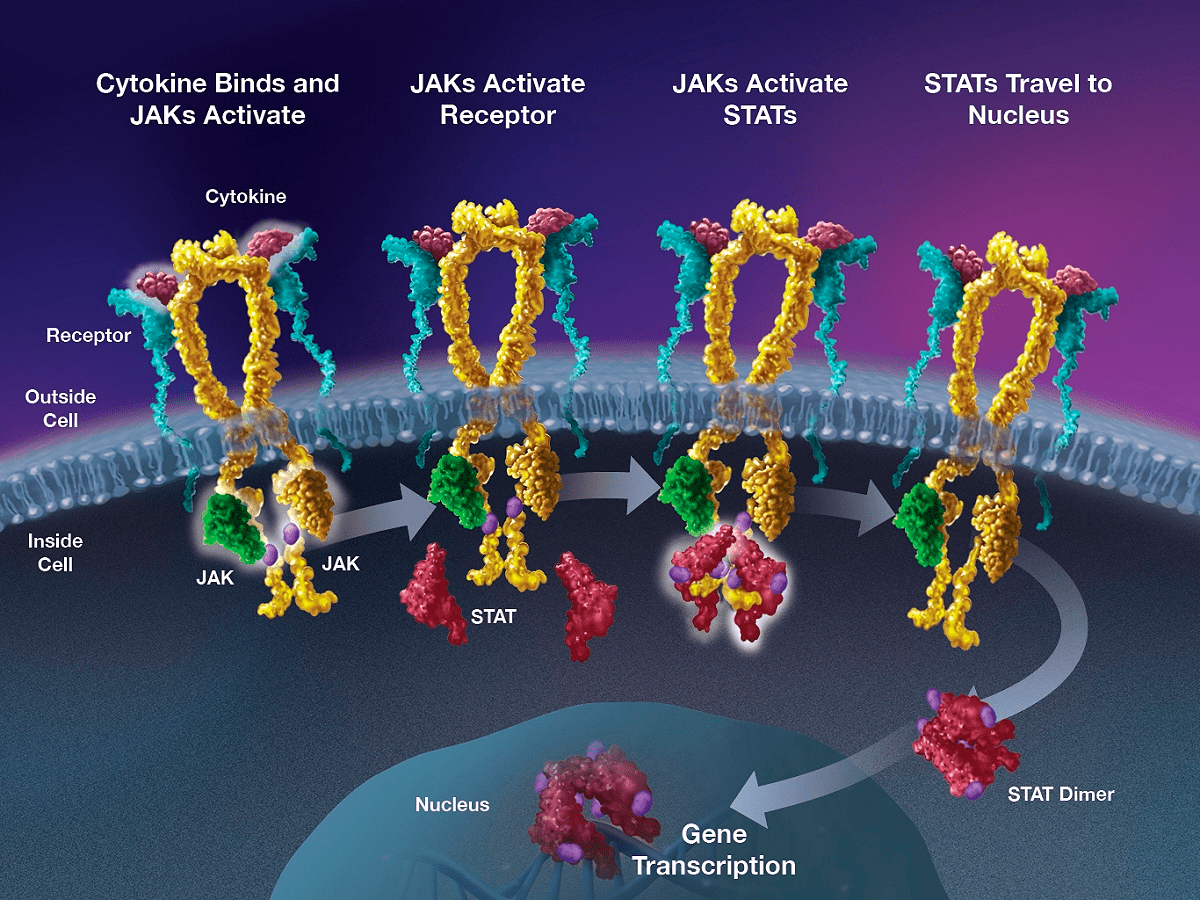
Кроме того, обязательно изучается профиль экспрессии и функция мишени в норме и патологии. Например, если мишень представлена в каждой клетке организма и выполняет какие-то важные функции, трудно будет подобрать лекарство, которое бы не задевало ее в здоровых клетках, поражая лишь больные. Jak-киназы синтезируются в основном в клетках иммунной системы и играют роль в передаче сигналов от рецепторов воспалительных цитокинов внутрь клетки (рис. 11) [48], [49].
Рисунок 11. Последовательность событий при активации сигнального каскада Jak. Воспалительный цитокин связывается со своим рецептором, что приводит к активации Jak. Активированный Jak фосфорилирует рецептор, и к нему теперь могут присоединиться две молекулы транскрипционного фактора STAT, активного только в качестве димера. Jak фосфорилирует STAT, после чего тот димеризуется и мигрирует в ядро, где включает различные гены, связанные с воспалением.
Валидация in vivo
После валидации in vitro мишень пытаются валидировать in vivo. Для этого используют модельные организмы, имитирующие те или иные аспекты человеческих болезней, — чаще всего мышей, крыс, кроликов, собак, свиней и обезьян [50], [51]. К сожалению, физиология животных в большинстве случаев отличается от человеческой, поэтому такие эксперименты не всегда предсказывают поведение мишени в человеческом организме. Однако они всё равно дают ценную информацию по сравнению с экспериментами in vitro, потому что позволяют в динамике проследить, как воздействие на мишень сказывается на течении заболевания. Воздействовать на мишень можно, как было сказано выше, с помощью нокаутов и нокдаунов. Также на этом этапе уже могли быть синтезированы низкомолекулярные вещества, связывающиеся с мишенью. Даже если они не годятся в качестве лекарств, они могут быть полезны для валидации мишени. Если мишень находится снаружи клетки, на нее также можно воздействовать антителами (аналитические антитела стараются получить как можно раньше, чтобы было удобно изучать локализацию и экспрессию мишени в клетке или организме). В случае Jak-киназ была показана эффективность ингибирования Jak3 в модели ревматоидного артрита [52].
На этапах in vitro и in vivo ученые сразу пытаются понять, какие безусловные минусы связаны с изучаемой мишенью. Так, если нокдаун мишени приводит к тяжелым побочным эффектам у мыши, есть все основания подозревать, что и лекарственное воздействие на нее у человека вызовет похожую токсичность.
Клиническая валидация
До этой стадии доходит только тогда, когда для мишени уже получен лекарственный кандидат, и он вошел в клинические исследования. По мере того, как лекарство проходит фазы исследований, мишень валидируется всё надежнее. Впрочем, провал лекарства по эффективности или безопасности не всегда означает, что мишень плохая — может быть, виноваты характеристики самого лекарства. Так, воздействие лекарства на мишень могло быть недостаточно сильным, и тогда исследователям имеет смысл вернуться на несколько шагов назад и попробовать создать более специфичный препарат. Если в клинических исследованиях лекарство оказалось токсичным, надо разбираться: идет речь об on-target-токсичности, обусловленной воздействием на мишень, или об off-target-эффекте, вызванном действием препарата на другие мишени в организме.
Мишень можно считать полностью валидированной только тогда, когда лекарство вышло на рынок и уже в реальном применении доказало приемлемую эффективность и безопасность. Так и вышло в случае Jak-киназ: тофацитиниб, преимущественно ингибирующий Jak3, доказал свою эффективность в клиническом исследовании по ревматоидному артриту [43], [53] и в 2012 году был зарегистрирован в США — через 23 года после открытия мишени.
После того как весь этот сложный путь проделала одна компания, другие фирмы начинают выпускать me-too («я-тоже») препараты. Это не дженерики и не биоаналоги, так как их структура отличается от первого препарата в классе, но они воздействуют на ту же мишень — уже валидированную путем горьких проб и ошибок первооткрывателями. Иногда второй или третей компании удается создать не просто me-too, а лучший в классе препарат, который учитывает недостатки «пионерского» лекарства.
Заключение
Связь между мишенью на молекулярном уровне и патогенезом на уровне целого организма играет ключевую роль, почему мишени можно разделить на «удобные» и «неудобные». Вот самые яркие примеры:
- Вирусы устроены очень просто — у них обычно крайне мало белков, и почти все они не похожи на человеческие. Поэтому ингибирование вирусных мишеней не грозит заметными побочными эффектами. Но, увы, эти белки (а точнее, кодирующие их гены) настолько вариабельны в силу естественных эволюционных процессов (и накопление точечных мутаций, и перестройка генетического материала в целом в вирусах идет с ошеломляющей скоростью), что практически любой высокоспецифичный ингибитор вирусного белка очень быстро теряет эффективность [54]. Становясь, по сути, еще один фактором эволюционного отбора для быстро размножающегося и меняющегося вируса, такой препарат буквально «выводит» штаммы вируса, устойчивые к этому лекарству. Примерно так же возникает резистентность бактерий к антибиотикам [55].
- Похожая ситуация складывается с ингибированием киназ при лечении рака. Найдена, казалась бы, хорошая мишень, которая необходима раковой клетке и отсутствует у нормальных. Но под давлением терапии раковые клетки начинают очень быстро эволюционировать, и появляются либо клоны с мутациями, нечувствительные к лекарству, либо умеющие обходиться совсем без мишени — возникает резистентность.
- При некоторых заболеваниях (яркий пример — отдельные виды рака) для лечения достаточно ингибировать конкретный белок — например, антителами. А в других, напротив, сразу много белков работают неправильно, что затрудняет простое целевое воздействие.
- В нейродегенеративных заболеваниях, видимо, важны надмолекулярные (например, тканевые) сложные и долгосрочные процессы. Значит ли это, что мишени для целевого воздействия в таких патогенезах просто трудно найти — или же их вовсе невозможно подобрать? Окончательного ответа на этот вопрос пока нет.
И потому, завершая обсуждение, хотелось бы сделать следующую ремарку: будет ли мишень «хорошей» или «плохой», зависит не только (и не сколько!) от этого белка «самого по себе», но должно рассматриваться в контексте процессов патогенеза (в частности) и всего организма (в целом). Еще один пример из обсуждаемой области: вариативность цитохромов и их влияния на метаболические превращения малых молекул — обстоятельство, уже учитываемое в назначении конкретных лекарств. Но формально для абсолютного большинства лекарств цитохромы — не прямые мишени, а лишь «дополнительные» белки [56].
По-настоящему хорошая мишень и надежный способ воздействия на нее могут быть выбраны только при глубоком изучении всего многообразия процессов — в первую очередь на уровне молекул, — происходящих при патогенезе. Эта ремарка насколько проста, настолько же и всеобъемлюща для принципов выбора мишеней. Учитывая, насколько малую часть процессов в живом мы (пока) хорошо изучили, но отмечая также стремительный прогресс биологии и других естественных наук, мы надеемся не подорвать оптимизм читателя в отношении перспектив биомедицины и убедить, что нас ждет еще множество больших и замечательных открытий в фармацевтике будущего.
Источник