- Механизмы всасывания лекарственных веществ
- Библиотека
- Механизмы всасывания нутриентов
- Начальные стадии усвоения жиров
- Всасывание витаминов
- Транспорт воды
- Применение знания механизмов всасывания в клинике
- Современный подход к тестированию биоптатов кишки на спектр Na + -зависимого транспорта нутриентов
- Заключение
Механизмы всасывания лекарственных веществ
Всасывание (абсорбция) — это перенос лекарственного вещества из места введения в системный кровоток. Естественно, что при энтеральном способе введения ЛС, высвобождающееся из лекарственной формы, через эпителиальные клетки ЖКТ попадает в кровь, а затем уже распределяется по организму. Однако и при парентеральных путях введения ЛС, чтобы попасть к месту реализации своего фармакологического эффекта, должно, как минимум, пройти через эндотелий сосудов, т. е. при любом способе введения для достижения органа-мишени препарату необходимо проникнуть через разнообразные биологические мембраны эпителиальных и (или) эндотелиальных клеток.
Мембрана представлена бислоем липидов (фосфолипидов), пронизанных белками. Каждый фосфолипид имеет 2 гидрофобных «хвостика», обращенных внутрь, и гидрофильную «головку».
Существует несколько вариантов прохождения лекарственного вещества через биологические мембраны:
Фильтрация через поры.
Пассивная диффузия — основной механизм всасывания лекарств. Перенос лекарственных веществ осуществляется через липидную мембрану по градиенту концентрации (из области большей концентрации в область меньшей концентрации). При этом размер молекул не столь существенен как при фильтрации (рис. 2).
Рис. 2. Пассивная диффузия
Факторы, влияющие на скорость пассивной диффузии :
Поверхность всасывания (основным местом всасывания большей части ЛС является проксимальная часть тонкого кишечника).
Кровоток в месте всасывания (в тонком кишечнике он больше, чем в желудке, поэтому и всасывание больше).
Время контакта ЛС с всасывательной поверхностью (при усиленной перистальтике кишечника всасывание ЛС уменьшается, при ослабленной — увеличивается).
Степень растворимости ЛС в липидах (так как мембрана содержит липиды, то лучше всасываются липофильные (неполярные) вещества).
Степень ионизации ЛС. Если ЛС при значениях рН, свойственных средам организма, находится главным образом в неионизированном виде, оно лучше растворимо в липидах и хорошо проникает через биологические мембраны. Если вещество ионизировано, оно плохо проникает через мембраны, но обладает лучшей водорастворимостью.
Жидкости организма в физиологических условиях имеют рН 7,3–7,4. Иной рН имеют содержимое желудка и кишечника, моча, воспаленные ткани и ткани в состоянии гипоксии. рН среды определяет степень ионизации молекул слабых кислот и слабых оснований (слабых оснований среди ЛС больше, чем слабых кислот) согласно формуле Гендерсона-Хассельбаха.
Для слабых кислот :

для слабых оснований :
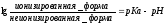
Зная рН среды и рКа вещества (табличные данные) можно определить степень ионизации лекарства, а значит, и степень его всасывания из ЖКТ, реабсорбции или экскреции почками при разных значениях рН мочи.
Рассчитать всасываемость атропина (рКа 9,7) в желудке (рН 2,0). Атропин — это слабое основание.
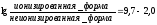
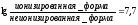

Отсюда следует, что неионизированных форм атропина в кислой среде желудка значительно меньше, чем ионизированных (на 1 неионизированную форму приходится 10 7,7 ионизированных), а значит, в желудке он всасываться практически не будет.
Определить, будет ли фенобарбитал (рКа 7,4) реабсорбироваться в «кислой» моче (рН 6,4). Фенобарбитал — слабое основание.
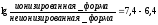
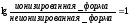
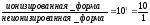
Отсюда следует, что неионизированных молекул фенобарбитала в этих условиях в 10 раз меньше, чем ионизированных, следовательно, он будет плохо реабсорбироваться в «кислой» моче и хорошо выводиться.
При передозировке фенобарбитала подкисление мочи является одним из методов борьбы с интоксикацией.
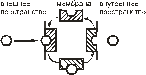
Фильтрация осуществляется через поры, имеющиеся между клетками эпидермиса слизистой оболочки ЖКТ, роговицы, эндотелия капилляров и так далее (большинство капилляров мозга не имеет таких пор (рис. 3)). Эпителиальные клетки разделены очень узкими промежутками, через которые проходят только небольшие водорастворимые молекулы (мочевина, аспирин, некоторые ионы).
Рис. 3. Фильтрация
Активный транспорт — это транспорт ЛС против градиента концентрации. Для этого вида транспорта необходимы энергетические затраты и наличие специфической системы переноса (рис. 4). Механизмы активного транспорта высокоспецифичны, они сформировались в процессе эволюции организма и необходимы для реализации его физиологических потребностей. В силу этого ЛС, проникающие через клеточные мембраны посредством активного транспорта, близки по своей химической структуре к естественным для организма веществам (например, некоторые цитостатики — аналоги пуринов и пиримидинов).
Рис. 4. Активный транспорт
Пиноцитоз. Суть его состоит в том, что переносимое вещество контактирует с определенным участком поверхности мембраны и этот участок прогибается внутрь, края углубления смыкаются, образуется пузырек с транспортируемым веществом. Он отшнуровывается от внешней поверхности мембраны и переносится внутрь клетки (напоминает фагоцитоз микробов макрофагами). Лекарственные вещества, молекулярная масса которых превышает 1000, могут войти в клетку только с помощью пиноцитоза. Таким образом переносятся жирные кислоты, фрагменты белков, витамин В12. Пиноцитоз играет незначительную роль во всасывании лекарств (рис. 5).
Рис. 5. Пиноцитоз
Перечисленные механизмы «работают», как правило, параллельно, но преобладающий вклад вносит обычно один из них. Какой именно — зависит от места введения и физико-химических свойств ЛС. Так, в ротовой полости и желудке, главным образом, реализуются пассивная диффузия, в меньшей степени — фильтрация. Другие механизмы практически не задействованы. В тонком кишечнике нет препятствий к реализации всех вышеуказанных механизмов всасывания. В толстом кишечнике и прямой кишке преобладают процессы пассивной диффузии и фильтрации. Они же являются основными механизмами всасывания ЛС через кожу.
Вариант 2. (неточно)
Ингаляционным путем вводят следующие лекарственные формы :
газообразные вещества (летучие анестезирующие средства);
мелкодисперсные порошки (натрия кромогликат).
Данный способ введения обеспечивает как местное (адреномиметики), так и системное (средства для наркоза) действие. Ингаляции лекарств производят с помощью специальной аппаратуры (от простейших спрей-баллончиков для самостоятельного применения больным до стационарных аппаратов). Учитывая тесный контакт вдыхаемого воздуха с кровью, а также огромную альвеолярную поверхность, скорость резорбции лекарств очень высока. Ингаляторно не применяют лекарственные средства, обладающие раздражающими свойствами. Нужно помнить, что при ингаляциях вещества сразу поступают в левые отделы сердца через легочные вены, что создает условия для проявления кардиотоксического эффекта.
быстрое развитие эффекта;
возможность точного дозирования;
отсутствие пресистемной элиминации.
необходимость использования сложных технических устройств (наркозные аппараты);
Источник
Библиотека
С.Т. Метельский
( доктор биологических наук, главный научный сотрудник ГУ НИИ Общей патологии и патофизиологии РАМН; контактная информация для переписки — S.T.Metelsky@gmail.com ; Москва, 125315, Балтийская 8.
Ключевые слова:
Всасывание, ионы, натрий, нутриенты, жиры, витамины, вода, желудочнокишечный тракт, простая диффузия, облегченная диффузия, осмос, фильтрация, околоклеточный транспорт, активный транспорт, сопряженный транспорт, вторичноэнергизованный транспорт, спектр всасывания, эндоцитоз, трансцитоз, Ргликопротеин.
Механизмы всасывания нутриентов
Активный, или вторично-энергизованный, сопряженный с натрием транспорт водорастворимых веществ в живых организмах широко распространен. Это наиболее высокоспецифичный и наиболее быстрый процесс транспорта нутриентов и других соединений через щеточную кайму энтероцитов; его скорость зависит от концентрации переносимого нутриента с насыщением. Источником энергии для него является электрохимический градиент Na + (или других тонов) через щеточную кайму клетки. Натрий-зависимым образом транспортируются многие нутриенты – большой класс разнородных веществ, поступающих в живые организмы из внешней среды, в частности, глюкоза.
Механизмы или модели сопряженного транспорта натрия и нутриентов (сахара, аминокислоты) представлены на рис. 1 и 2 на примере транспортера SGLT1 для глюкозы. Модель общего переносчика для натрия и глюкозы (см. рис. 1, слева) следует признать маловероятной. Появление многочисленных моделей сопряжения транспорта натрия и нутриентов такого типа было обусловлено убедительной демонстрацией механизма действия антибиотика валиномицина на бислойных липидных мембранах. При этом валиномицин, способный передвигаться внутри мембраны, действовал в роли переносчика или челнока между двумя сторонами бислоя, переносившего через мембрану ионы калия в обоих направлениях. За все время исследования молекулярных механизмов сопряженного всасывания не было обнаружено ни одного переносчика для нутриентов типа валиномицина.
Модель общего канала для натрия и глюкозы (см. рис. 1, справа) позволяет объяснить практически все особенности сопряженного транспорта веществ, однако и она имеет свои недостатки. В частности, трудно себе представить общий канал, обладающий одновременной высокой селективностью для натрия и высоким сродством для глюкозы – эти требования, по-видимому, противоречат друг другу. 
Транспортеры для различных аминокислот хорошо охарактеризованы, установлены гены, отвечающие за их синтез. Приведем несколько примеров. Так, для транспорта нейтральных аминокислот через мембрану щеточной каймы кишечника существуют две Na + -зависимые системы – система АТB(0) и система B(0,+) и одна Na + -независимая система – АТВ(0,+). Большей частью всасывание нейтральных аминокислот можно объяснить функционированием системы АТВ(0). Система транспорта аминокислот, обозначаемая как АТВ(0), или ASCT2, по своим функциональным характеристикам близка системе В(0).
Для всасывания аминокислоты глутамина в энтероцитах ворсинок и крипт существует не только Na + -независимая система L, но и две Na + -зависимые системы – ASC и дополнительная высокоспецифическая система. По-видимому, в кишечнике имеется еще одна Na + -зависимая транспортная система для анионных аминокислот. Однако ввиду того, что глутаминовая и аспарагиновая кислоты в кишке быстро трансаминируются, изучение транспорта этого класса аминокислот крайне затруднено.
Итак, клетки слизистой оболочки обладают чрезвычайно сложной для классификации системой для активного Na + -зависимого транспорта аминокислот. Эта система обладает органной и видовой специфичностью. Характерной чертой транспорта аминокислот в энтероците является высокая степень дублирования системы, что, по-видимому, повышает надежность ее функционирования и адаптируемость к различным пищевым рационам. Например, глицин как нейтральная аминокислота может поступать в энтероциты с помощью переносчиков трех типов и в то же время разделять соответствующий механизм для транспорта аминокислот. Аналогичным является пример, когда L-аланин всасывается Na + -зависимым образом с помощью двух систем – A и ASC.
Транспорт других соединений. Неорганический фосфат через мембрану щеточной каймы человека активно всасывается с помощью специального Na + /фосфатного котранспортера (тип IIb). Для этого транспортера обнаружен специфический ингибитор – фосфофлоретин. Флавоноидные глюкозиды всасываются в тонкой кишке Na + -зависимым образом с помощью транспортера SGLT1, в этом процессе, очевидно, принимает участие лактазная флоридзин-гидролаза. Обнаружен также активный Na + -зависимый транспорт через мембрану щеточной каймы нуклеооснований (гипоксантин). Кроме того, показано, что Na + -зависимый транспортер для нуклеозидов выявляется на мембране щеточной каймы энтероцитов по всей длине тонкой кишки эмбрионов и взрослых особей.
Натрий-зависимый транспортер желчных кислот с молекулярной массой 48 кДа (SLC10A2 – ASBT) в подвздошной кишке человека играет решающую роль как в нормальных физиологических условиях, так и при патологии; специфическим ингибитором для него является аналог димеров желчных кислот S 0960. Стехиометрия транспорта натрий:желчная кислота равна 2:1. Циклоспорин А увеличивает реабсорбцию желчных кислот в кишечнике, снижает синтез холата. Участие везикулярного транспорта в трансклеточном переносе желчных кислот считается маловероятным.
Вдоль ворсинок энтероцитов млекопитающих и птиц экспрессированы транспортеры креатина (азотсодержащая органическая кислота, входящая в состав фосфокреатина – запасного энергетического вещества в клетках мышц и мозга), осуществляющие
Механизмы, контролирующие скорости и пути всасывания небольших соединений, все еще остаются неясными. Так, эффективная кишечная проницаемость для воды и мочевины в несколько раз выше, чем можно предсказать исходя из их физико-химических свойств.
Начальные стадии усвоения жиров
Липидный состав пищи человека – триглицериды, фосфолипиды, свободные и этерифицированные стерины. Подготовительная стадия утилизации жиров – образование мицелл. Анатомическая основа данной стадии – общий желчный проток, расположенный в двенадцатиперстной кишке выше протока поджелудочной железы (рис. 3).
Соли желчных кислот обладают способностью к самоагрегации и формируют макромолекулярные структуры, называемые мицеллами. Их гидрофильная поверхность соприкасается с водным раствором, а гидрофобная область образует ядро. Размер мицелл ≈100 Å, часто они имеют сферическую или цилиндрическую форму и в отличие от везикул не содержат заполненной водой полости.
Переваривание жиров начинается в желудке под действием лингвальной липазы (ее вклад в суммарный процесс составляет не более 10%). В результате механических процессов (взбалтывания и перемешивания) жиры эмульгируются в желудке до мелких капель. Далее вследствие воздействия природных эмульгаторов – солей желчных кислот и фосфолипидов образуется мелкодисперсная эмульсия микрочастиц жира размером менее 1 мм.
Поджелудочная колипаза, функционирующая на поверхности появившейся жировой микрокапли, гидролизует эфирные связи в 1-й и 3-й позициях глицерина, в результате чего образуются свободные жирные кислоты и 2-моноглицерид. Кроме того, в процессе участвуют поджелудочные гидролаза эфиров холестерина и фосфолипаза А2. В итоге пищеварения указанных жиров образуются свободные жирные кислоты, глицерин, свободный холестерин и лизолецитин.
Жирные кислоты (длина цепи более 8 атомов углерода), 2-моноглицериды, фосфолипиды, холестерин и жирорастворимые витамины (A, D, E, K) всасываются в связанном с мицеллами солей желчных кислот виде (рис. 4). Всасывание в основном происходит в тощей и проксимальном отделе подвздошной кишки. Сначала мицеллы доставляют липиды к мембране щеточной каймы, где те пассивно или, возможно, по механизму эндоцитоза проникают в ткань. Затем соли желчных кислот абсорбируются слизистой оболочкой или по механизму пассивной диффузии (деконъюгированные соли), или активно с помощью Na + -зависимого транспорта – в дистальном отделе подвздошной кишки. Жирные кислоты с короткой цепью (менее 8 атомов углерода) преимущественно водорастворимы и 
Всасывание витаминов
Некоторые витамины могут всасываться за счет ионов, отличных от натрия. Так, для витамина В1(тиамина) в кишечнике человека обнаружен рН-зависимый, блокируемый амилоридом, нейтральный переносчик. Для транспорта витамина С в тонкой кишке существуют две системы – аскорбиновая кислота транспортируется с помощью специальной системы, а дегидроаскорбиновая кислота переносится в основном глюкозным котранспортером.
Девять водорастворимых витаминов являются участниками различных ферментативных реакций. Все они, кроме витамина В12, легко абсорбируются в пищеварительном тракте. Для всасывания витамина В12 в задних отделах подвздошной кишки имеется собственный механизм. Существенной частью такого механизма является стадия, когда этот комплекс вначале связывается с внутренним фактором (intrinsic factor) – гликопротеином, образующимся в обкладочных клетках желудка, после чего с помощью рецепторного белка попадает в клетки, где, пройдя митохондрии, комплекс витамина В12 с транскобаламином II поступает в кровь и почти сразу же поглощается печенью.
Жирорастворимые витамины усваиваются организмом вместе с продуктами расщепления липидов (см. рис. 4). Один из жирорастворимых витаминов – витамин К также образуется бактериями-резидентами, но всасывается в толстой кишке. Для всасывания витаминов существует несколько путей, в частности энергозависимое всасывание и Na + -зависимый механизм.
Транспорт воды

В тонкой кишке вода всасывается даже при отсутствии каких-либо внешних движущих сил. Установлено, что такое всасывание воды является вторичным по отношению к активному транспорту натрия и глюкозы – стехиометрия транспорта Nа + :глюкоза:Н2О составляет 2:1:210 (рис. 5). Такой мощный механизм может обеспечить половину суточного количества всасывания воды из тонкой кишки. Этот механизм является недостающей физиологической основой для обоснования применения метода частичного купирования секреторной диареи (см. ниже). Натрий, вошедший в клетки вместе с глюкозой через мембрану щеточной каймы (транспортер SGLT1), выкачивается в кровь через базолатеральную мембрану 3Na + /2K + -насосом, а глюкоза через базолатеральную мембрану транспортируется в кровь за счет облегченной диффузии. В итоге через эпителиальный пласт проходят и глюкоза, и натрий, и вода.
Применение знания механизмов всасывания в клинике
Современный подход к тестированию биоптатов кишки на спектр Na + -зависимого транспорта нутриентов
В единичных случаях биоптаты залуковичного отдела тонкой кишки человека сразу без обработки формалином исследуются биохимическими методами; при этом исследуемый кусочек ткани слизистой оболочки рассматривается как аморфный катализатор
Две стороны сопряженного транспорта натрия и глюкозы (влияние натрия на транспорт глюкозы и влияние глюкозы на транспорт натрия) могут изучаться совершенно разными и мало контактирующими между собой методами (рис. 6). Так, можно измерять влияние добавления натрия на всасывание нутриента (например, глюкозы) биохимическими методами, а влияние добавления глюкозы на транспорт натрия через эпителий – электрофизиологическими методами (например, методом тока короткого замыкания). Оба метода дают эквивалентные результаты, но второй метод проще и позволяет регистрировать сопряженный транспорт глюкозы в режиме реального времени и в этом смысле является уникальным.
Сегодня опубликовано лишь несколько десятков работ, выполненных с помощью метода тока короткого замыкания и посвященных изучению транспортных процессов и всасывания на биоптатах больных. Дело это для гастроэнтерологов новое: им, несомненно, нужно привыкнуть к терминологии в этой области знаний, понять границы возможностей метода. Следует признать, что пока обе стороны – клиницисты (гастроэнтерологи) и экспериментаторы (биофизики, физиологи) только нащупывают взаимные контакты.
С 1987 г. существует практика применения электрофизиологического метода для изучения спектра и кинетических констант Na + -зависимого транспорта нутриентов через эпителий кишечника в экспериментах на животных. С 2003 г. этот метод используется и в 
Заключение
Транспортные свойства однослойного эпителия тонкой кишки обусловлены не только свойствами отдельных клеток, но и способом организации клеток, образующих данный эпителий, а также взаимодействием между клетками; эти свойства эпителия тонкой кишки уникальны и ни отдельные клетки, ни их мембраны не обладают ими.
Понимание механизмов всасывания в кишечнике сахаров, липидов, витаминов, аминокислот и дипептидов, некоторых микронутриентов, желчных кислот, воды является основой для изучения путей увеличения эффективности всасывания лекарств (увлечение с потоком) и разработки новых типов лекарственных веществ, всасывающихся по естественным физиологическим механизмам.
Секреторная диарея, вызываемая микроорганизмами, может в некоторой степени купироваться пероральной регидратационной терапией. Этот метод лечения недавно получил физиологическое обоснование.
Таким образом, расшифровка и понимание физиологических механизмов всасывания в кишечнике оказывает мощное влияние на практическую гастроэнтерологию уже сейчас. В дальнейшем это влияние будет только возрастать.
Работа поддержана грантом РФФИ 09-04-01698
Список литературы:
1. Метельский С.Т. Транспортные процессы и мембранное пищеварение в слизистой оболочке тонкой кишки. Электрофизиологическая модель. – М.: Анахарсис, 2007. – 272 с.
2. Общий курс физиологии человека и животных. – Кн. 2. Физиология висцеральных систем / Под ред. А.Д. Ноздрачева. – М.: Высшая школа, 1991. – С. 356–404.
3. Перова Н.В., Метельская В.А. Биохимия атеросклероза // Руководство по атеросклерозу и ишемической болезни сердца / Под ред. Е.И. Чазова, В.В. Кухарчука, С.А. Бойцова. – М.: Медиа медика, 2007. – С. 50–77.
4. Membrane digestion. New facts and concepts / Ed. A.M. Ugolev. – M.: MIR Publishers, 1989. – 288 p.
5. Tansey T., Christie D.A., Tansey E.M. Intestinal absorption. – London: Wellcome Trust, 2000. – 81 p.
статья взята с сайта Русского журнала Гастроэнтерологии, Гепатологии, Колопроктологии
Источник