Борьба с лекарственной устойчивостью: порядок действий
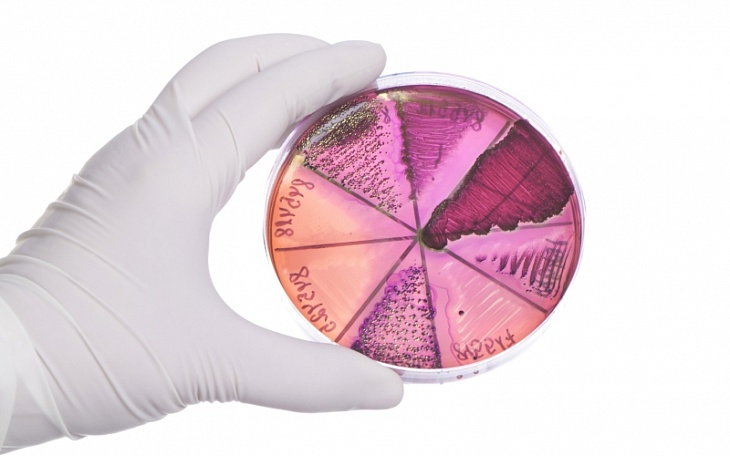
Своевременная диагностика антибиотикорезистентности — важнейшая задача современного мира: лекарственно устойчивые микроорганизмы убивают как минимум 25000 человек ежегодно только в Евросоюзе. При инфекционном заболевании необходимо прежде всего выявить инфекционный агент и показать, какой антибиотик будет против него эффективным, затем выявить механизмы резистентности и определить, какие меры позволят контролировать распространение инфекции. (См. предложенную авторами заявления схему классификации инфекций: порядок вопросов, которые должен ставить клиницист, и пути получения ответов.)
На современном этапе лекарственную устойчивость можно выявить с помощью секвенирования ДНК — это метод быстрый, довольно точный и сравнительно простой методически. Однако могут быть и ошибки, связанные с появлением до сих пор не известного гена устойчивости. По сути, генотипирование — суррогат, а точный ответ об устойчивости дают только методы, связанные с культивированием, но они не везде доступны и отнимают много времени. Поэтому, отмечают авторы, важно ускорить методы фенотипического тестирования (один из вариантов с использованием MALDI-TOF см. в нашей новости). Время до результата (TTR, time to result) — это один из самых важных факторов: задержка адекватного лечения антибиотиками при тяжелых инфекциях увеличивает смертность.
Большинство клинических микробиологов не готовы принять системы, которые не идентифицируют микроорганизмы, а только определяют лекарственную устойчивость: врачам трудно принимать решения о терапии без точной информации о видовой принадлежности. В этом плане также перспективна спектрометрия MALDI-TOF — она дает информацию и о виде.
Особая группа проблем связана с государственным регулированием медицинских услуг. В каждой стране существуют свои правила и процедуры регистрации, поэтому разработчикам трудно удовлетворить всем требованиям одновременно. Здесь необходимы коммуникация между представителями государств и стандартизация требований. Кроме того, процедуры регуляции зачастую занимают много времени и оказываются слишком дорогостоящими для среднего и малого бизнеса.
Сейчас, как заявляет Европейский центр по предотвращению и контролю заболеваний, от трети до половины антимикробных препаратов назначается без необходимости, что способствует росту лекарственной устойчивости. Важная задача — просвещение населения и медработников, сокращение безответственного использования антибиотиков. Но тут тоже необходимы быстрые тесты, поскольку как пациенты, так и врачи склоняются к тому, чтобы начать прием антибиотиков как можно скорее.
Еще одна задача — сбор и представление информации о резистентных штаммах и эффективности антибиотиков. Хотелось бы предоставлять ее в режиме реального времени и для максимального количества образцов, тогда у больного будет больше шансов своевременно получить эффективное лечение.
Возможно, самая большая проблема на сегодняшний день — высокая стоимость современных быстрых диагностических тестов, которая не компенсируется их преимуществами и мешает им выйти на рынок.
Авторы перечислили основные барьеры для разработки и внедрения усовершенствованных систем тестирования на антимикробную чувствительность и предложили способы их преодоления. Кроме того, они представили общую схему разработки и внедрения диагностического продукта, от бизнес-предложения и изучения вопросов интеллектуальной собственности до коммерциализации, с комментариями к каждому этапу. «Несмотря на то, что малые и средние предприятия могут предлагать инновационные и гибкие подходы, крупным компаниям по диагностике, с необходимой критической массой и финансовой поддержкой, намного проще накопить опыт в области клинического развития, регуляторных аспектов и коммуникации и провести обширные (а значит, дорогостоящие) клинические исследования. Это важный барьер для проникновения на рынок новых продуктов, разработанных небольшими компаниями. Поэтому некоторые небольшие компании преуспели, наладив партнерские отношения с более крупными компаниями на заключительных этапах разработки. Следовательно, необходимы новые пути финансирования доклинических исследований и спонсорства для покрытия расходов, связанных с более формальными этапами развития», — говорится в заявлении.
Источник
Методы преодоления лекарственной устойчивости микроорганизмов
Применение антибиотиков строго по показаниям.
Осторожно применять антибиотики с профилактической целью.
Через 10-15 дней антибиотикотерапии производить смену препарата одной группы на препарат другой группы.
Использование по возможности антибиотиков узкого спектра действия.
Через определенное время проводить смену антибиотиков в отделении, больнице, регионе.
Ограниченно применять антибиотики в ветеринарии, растениеводстве и пищевой промышленности.
Изыскание новых антибиотиков с иным механизмом действия и иной молекулярной структурой.
Побочное действие антибиотиков
Не смотря на то, что антибиотики являются прекрасными этиотропными препаратами, многие из них оказывают на макроорганизм не желаемое отрицательное воздействие – побочное действие. Основные побочные эффекты, возникающие на фоне антибиотикотерапии:
1. Токсические реакции – зависят от свойств препарата, его дозы, способа введения, состояния больного.
Гепатотоксическое действие – поражение печени (тетрациклины, аминогликозиды);
Нефротоксическое действие – поражение почек;
Нейротоксическое действие – поражение нервной системы, в частности ототоксическое действие – поражение органа слуха (аминогликозиды);
Гематотоксическое действие – поражение органов кроветворения: лейкопения, анемия, тромбоцитопения;
Кардиотоксическое действие – поражение миокарда, эпикарда и эндокарда.
Эмбриотоксическое действие – действие на плод (левомицетин).
2. Дисбиозы и дисбактериозы – нарушение количественного и качественного состава нормальной микрофлоры макроорганизма. Погибают чувствительные к антибиотикам микроорганизмы и размножаются резистентные микроорганизмы и грибы, т.е. изменяется «микробный пейзаж». Нарушается антагонистическая функция микрофлоры по отношению к условно-патогенной микрофлоре и патогенным микробам.
Для предупреждения развития дисбиоза применяют: антибиотики узкого спектра действия; назначают противогрибковые препараты; назначают эубиотики для восстановления нормальной микрофлоры.
3. Аллергические реакции – зуд, гиперемия кожных покровов, крапивница, слезотечение, в том числе токсико-аллергические реакции: отек Квинке, анафилактический шок, синдром Лайела, синдром Стивенса-Джонса.
4. Иммунодепрессивное действие – угнетающее действие на иммунитет:
левомицетины угнетает антителообразование, тетрациклин – фагоцитоз, циклоспорин (противогрибковый препарат) избирательно подавляет Т-систему иммунитета. За счет гибели микроорганизмов и снижения антигенной нагрузки на иммунную систему не формируется длительный эффективный полноценный иммунный ответ. Поэтому возникают рецидивы и реинфекции.
5. Развитие лекарственной устойчивости.
Существуют определенные условия, при которых антибиотик может оказать бактериостатическое или бактерицидное действие на микробную клетку:
Антибиотик должен проникать в клетку;
Антибиотик должен вступить во взаимодействие с структурой-мишенью, которая выполняет жизненно важную для жизнедеятельности бактерий функцию, и подевить эту функцию;
Антибиотик должен сохранять свою структуру.
При нарушении одного из этих условий формируется лекарственная устойчивость микроорганизмов.
Эндотоксический шок – при применении бактерицидных препаратов при инфекционном процессе, вызванном грамотрицательной флорой, происходит массовая гибель микроорганизмов и массовый выход эндотоксина, который оказывает выраженное негативное влияние на различные органы и системы макроорганизма.
Методы оценки эффективности действия антимикробных препаратов.
количественное определение чувствительности бактерий к антимикробным препаратам методом серийных разведений.
Данный метод применяют для определения минимальной подавляющей концентрации (МПК) – наименьшей концентрации антибиотика, полностью подавляющей рост исследуемых бактерий.
Готовят основной раствор АБ, содержащий препарат в определенной концентрации, используют для приготовления серийных (2-ух кратных) разведений АБ в питательной среде – бульоне или агаре. Из исследуемой бактериальной культуры готовят суспензию стандартной плотности и засевают по 0,1 мл на среды с разной концентрацией АБ, а также на среду без препарата (контроль)
«+» метода – может использоваться для любых микроорганизмов, включая прихотливых и медленно растущих, внутриклеточных паразитов.
К чувствительным относятся штаммы бактерий, рост которых подавляется при концентрации препарата, обнаруживаемых в сыворотки крови при использовании среднетерапевтических доз АБ.
К умеренно устойчивым – для подавления роста которых требуются концентрации, создающиеся в сыворотке крови пи введении максимальных лечебных доз препаратов.
Устойчивыми – рост не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Микротест-системы – предназначены для быстрого определения клинической чувствительности к АБ. Определяют чувствительность к двум стандартным концентрациям: средней терапевтической и максимальной. В среде присутствует индикатор. Результаты определяют через 4 часа инкубации с помощью спектрофотометра.
Метод дисков (диффузионный тест). Метод основан на подавлении роста бактерий на плотной питательной среде под действием АБ, содержащегося в бумажном диске. В результате диффузии препарата в агар вокруг диска образуется градиент концентрации АБ. Среда Мюллера-Хинтона.
Применение метода имеет ряд ограничений: не может быть использован для всех медленно растущих и большинства прихотливых бактерий; не дает надежных результатов к препаратам, плохо диффундирующим в агар.
Количественное определение чувствительности бактерий к АБ с помощью Е-теста. Вместо дисков используется стандартные полимерные полоски, содержащие АБ, нанесенные в виде непрерывного градиента концентрации.
Источник
Способы преодоления лекарственной устойчивости
Под резистентностью (устойчивостью) понимают способность микроорганизма переносить значительно большие концентрации препарата, чем остальные микроорганизмы данного штамма (вида), или развиваться при таких концентрациях, которые превышают достигаемые в макроорганизме при введении антибиотиков, сульфаниламидов и нитрофуранов в терапевтических дозах.
Резистентные штаммы микроорганизмов возникают при изменении генома бактериальной клетки в результате спонтанных мутаций. Последние не связаны с направленным действием на ДНК бактерии антибактериальных препаратов, которые играют роль лишь селективных агентов. В процессе селекции в результате воздействия химиотерапевтических соединений чувствительные микроорганизмы погибают, а резистентные сохраняются, размножаются и распространяются в окружающей среде. Приобретенная резистентность закрепляется и передается по наследству последующим генерациям бактерий.
Скорость развития и степень выраженности устойчивости связаны с видом и даже штаммом возбудителя. Наиболее быстро и часто резистентность к антибактериальным препаратам возникает у стафилококков, эшерихий, микоплазм, протея, синегнойной палочки. Среди пастерелл, эризипелотриксов, клостридий, стрептококков группы А, сибиреязвенных и гемофильных полочек резистентные штаммы выделяют сравнительно редко.
Наиболее частой генетической основой резистентности служит наличие в бактериях внехромосомных факторов устойчивости к лекарственным веществам – плазмид и транспозонов.
Бактериальные плазмиды, связанные с переносом маркеров лекарственной устойчивости в процессе конъюгации клеток, получили название R-факторов. Плазмиды резистентности R (конъюгирующие) состоят из двух компонентов – фактора переноса устойчивости RTF, обеспечивающего передачу генетической информации, и r-фактора, отвечающего за резистентность к антибиотикам. В отдельных случаях r-факторы (неконъюгирующие плазмиды) существуют в бактериальных клетках самостоятельно. Межбактериальный перенос таких r-факторов может осуществляться посредством их мобилизации и коинтеграции с конъюгирующими плазмидами. R-фактор одновременно может содержать 1-10 и более детерминант устойчивости к различным антибактериальным соединениям.
Транспозонные элементы — это фрагменты ДНК, которые свободно перемещаются от одного репликона к другому. Транспозоны определяют различные фенотипические признаки бактериальной клетки, в частности антибиотикорезистентность, и способствуют переносу детерминант устойчивости к антибиотикам между хромосомой, плазмидами и фагами. Они не подчиняются rec-системам клетки, которые ограничивают передачу хромосомных маркеров между неродственными видами. Гены, входящие в состав транспозонов, окружены особыми нуклеотидными последовательностями (IS-элементами), которые и обеспечивают их включение в негомологичный геном. Вхождение детерминант устойчивости в состав транспозонов при постоянно действующем в условиях производства селективном давлении антимикробных препаратов на бактериальные популяции может привести к образованию гибридных плазмид, обусловливающих новые комбинации устойчивости к химиотерапевтическим веществам.
Транспозоны могут перемещаться в пределах одного вида, а также попадать в новые виды и роды микроорганизмов. Установлено, что транспозоны Т 1699 и Т 1700, присутствующие в неконъюгативных плазмидах S. marcescens, первоначально проникают в конъюгативную плазмиду этого вида, вместе с которой перемещаются в другие роды семейства Enterobacteriaceae.
Способность R-факторов передаваться от клетки к клетке путем конъюгации или трансдукции объясняет быстрое распространение их по микробной популяции. Нередко в результате автономной репликации в одной клетке находятся десятки копий плазмид, что способствует быстрому развитию внехромосомной резистентности.
При трансдукции детерминанты устойчивости к антимикробным препаратам переходят от клетки к клетке с помощью бактериофага, играющего роль переносчика. Фаговая ДНК встраивается в бактериальный геном и при репликации, высвобождаясь из хромосомы или плазмиды, может захватывать генетические элементы, отвечающие за резистентность. Фаговая трансдукция играет важную роль в распространении лекарственной устойчивости у грамположительных микроорганизмов, особенно стафилококков и стрептококков.
Перенос плазмид при конъюгации осуществляется посредством половых пилей при установлении контакта между двумя клетками. При этом в донорской клетке (R+) происходит репликация плазмидной ДНК, одна цепь которой проникает в реципиентную клетку (R-), где образует новую плазмиду. Если плазмиды интегрированы с хромосомой, то при конъюгации возможен захват генетического материала из хромосомы плазмидной ДНК. При этом могут передаваться детерминанты резистентности, локализованные в хромосоме.
Передача генетической информации между микроорганизмами с помощью трансформации имеет значение только для лабораторных исследований и не принимает участия в распространении лекарственной устойчивости в условиях производства.
В то же время R-плазмидная передача устойчивости к лекарственным веществам является наиболее важным механизмом возникновения резистентности в бактериальной популяции, особенно в семействе энтеробактерий. С эпизоотической точки зрения наиболее опасна передача детерминант устойчивости от одного вида микроорганизмов к другому.
Циркуляция плазмид от животных к животным, от животных к человеку и от человека к животным способствует быстрому распространению лекарственной резистентности во всем мире. Плазмиды резистентности распространяются в результате контактного перезаражения лекарственно-устойчивыми микроорганизмами больших групп животных, сконцентрированных на ограниченных площадях животноводческих помещений. Отмечена передача R-факторов от животных к человеку. Так, у персонала, работающего в животноводстве, количество резистентной микрофлоры в несколько раз выше, чем у людей, не контактирующих с животными. Высокая обсемененность туш забитых животных и птицы лекарственно-устойчивыми микроорганизмами способствует распространению R-факторов среди работников мясокомбинатов, а также лиц, занятых переработкой мясопродуктов и употребляющих в пищу мясо, не подвергнутое необходимой термической обработке.
Большинство штаммов Е. coli — комменсалы кишечника, которые легко перемещаются как внутри популяции животных и человека, так и между ними, о чем свидетельствует сходный набор плазмид резистентности. Основная масса этих штаммов устойчива к большинству антибактериальных соединений. Апатогенные эшерихии служат постоянным резервуаром плазмид резистентности, в котором попадающий в организм возбудитель, сам по себе не несущий R-фактор, при конъюгации может приобрести детерминанты устойчивости к лекарственным препаратам.
Использование антимикробных средств в заниженных дозах, увеличение интервалов между введением препарата приводят к созданию в организме субтерапевтических концентраций антибактериальных соединений и, как следствие этого, к селекции резистентных форм микроорганизмов.
Применение антибиотиков, предназначенных для этиотропной терапии, с целью повышения продуктивности животных привело к селекции микрофлоры, резистентной к лечебным препаратам. В результате широкого употребления в животноводстве тетрациклиновых антибиотиков в качестве кормовой добавки большинство штаммов сальмонелл и эшерихий приобрело резистентность к препаратам этой группы.
Устойчивость микроорганизмов к антимикробным препаратам в случае как плазмидной, так и хромосомной локализации детерминант резистентности может быть обусловлена несколькими механизмами.
Наиболее часто лекарственная устойчивость связана со способностью микроорганизмов вырабатывать ферменты, инактивирующие антибактериальные препараты. Характерный пример устойчивости этого типа — способность ?-лактамаз (пенициллиназ) бактерий гидролизировать ?-лактамные кольца пенициллинов и цефалоспоринов. В результате разрыва ?-лактамной связи антибиотики теряют свою специфическую активность в отношении микроорганизмов.
Другой важный механизм, обусловливающий антибиотикорезистентность, заключается в нарушении проницаемости микробных клеток для антибиотика. Так, изменение у стафилококков и синегнойной палочки липидного состава клеточной стенки нарушает ее проницаемость соответственно для фузидиевой кислоты и левомицетина. Появление неспецифических белков в наружной мембране Е. coli снижает ее чувствительность к антибиотикам. Резистентность к полимиксину у синегнойной палочки связана с изменением структуры наружной мембраны, что предотвращает проникновение антибиотика в микробную клетку.
Резистентность к тетрациклинам чаще всего носит индуктивный характер. При контакте с антибиотиком у микроорганизмов начинается синтез специфических белков, которые в основном локализуются на наружной мембране и ограничивают поступление тетрациклина в клетку. По другим данным, индуцированные белки нарушают взаимодействие антибиотика с 30S-субчастицей рибосом или, изменяя проницаемость клеточной мембраны, обеспечивают свободный выход тетрациклина из бактериальной клетки.
Модификация чувствительных к антибиотику участков также приводит к развитию резистентности у микроорганизмов. Изменение белка S12, входящего в состав 30S-субчастицы рибосомы, или белков L4 и L12, входящих в состав 50S-субчастицы, уменьшает связывание соответственно аминогликозидов или макролидов с рибосомами, что предотвращает ингибирующее действие антибиотиков на синтез белка. Этот механизм устойчивости обычно обусловлен хромосомными мутациями.
Возможный механизм развития резистентности — это синтез соединений, не инактивирующихся под действием антибактериальных веществ. Так, устойчивость к сульфаниламидам и триметоприму связана с выработкой нечувствительных к действию этих препаратов дигидроптероатсинтетазы и дигидрофолатредуктазы.
Широкое распространение лекарственно-устойчивых микроорганизмов требует разработки комплекса мероприятий, ограничивающих циркуляцию резистентных бактерий среди сельскохозяйственных животных. Меры по ограничению распространения лекарственно-устойчивых микроорганизмов должны быть направлены, во-первых, на предупреждение формирования резистентных популяций и, во-вторых, на подавление уже сформировавшихся популяций.
Один из возможных способов преодоления лекарственной устойчивости микроорганизмов — химическая трансформация молекул антимикробных веществ, в частности антибиотиков, направленная на создание новых препаратов, активных в отношении антибиотико-устойчивых микроорганизмов. Путем трансформации были синтезированы полусинтетические пенициллины и цефалоспорины, нечувствительные к действию ?-лактамаз: метициллин, оксациллин, дик-локсациллин, цефамандол, цефуроксим, цефсулодин и ряд других.
Практически любая молекула антибиотика может инактивироваться в микробной клетке за счет определенного механизма резистентности, поэтому спустя некоторое время после начала использования нового препарата отмечают распространение детерминант резистентности к этому соединению в плазмидах и транспозонах. В связи с этим эффективность каждого антибиотика начинает уменьшаться, что обусловливает необходимость синтеза все новых антимикробных препаратов.
Перспективными методами в борьбе с лекарственно-устойчивыми микроорганизмами служит использование соединений, подавляющих определенные механизмы резистентности в бактериальной клетке. Наибольшие успехи в этом направлении достигнуты в результате применения неконкурентных ингибиторов ?-лактамаз, первый представитель — клавулановая кислота. Она обладает слабой антибактериальной активностью, и как антибактериальный препарат ее не используют. Основное ее свойство — способность необратимо ингибировать пенициллиназы грамположительных и грамотрицательных микроорганизмов.
Перспективное направление в борьбе с резистентностыо бактерий — использование фосфогликолипидпых антибиотиков. Препараты этой группы взаимодействуют с половыми пилями микроорганизмов, в связи с чем в первую очередь подавляют R+-клетки, несущие детерминанты резистентности. Среди фосфогликолипидов широко используют в животноводстве и птицеводстве флавомицин и макарбомицин, которые в желудочно-кишечном тракте сельскохозяйственных животных значительно снижают количество антибиотико-резистентной микрофлоры.
Другим подходом к решению проблемы воздействия на лекарственно-устойчивую популяцию микроорганизмов является использование соединений, обеспечивающих элиминацию плазмид из резистентных бактерий и действующих на детерминанты лекарственной устойчивости. Одним из способов, ведущих к элиминации плазмид из микробной клетки, стало применение ДНК-тропных веществ. Акрифлавин и хинакрин вызывают элиминацию R-факторов из сальмонелл, шигелл и эшерихий.
Помимо непосредственного влияния на R-факторы, ДНК-тропные соединения за счет снижения мутаций замедляют развитие резистентности микроорганизмов к антимикробным препаратам. Так, акрихин и акрифлавин подавляют развитие антибиотико-устойчивых штаммов бактерий к пенициллину, ампициллину, неомицину, рифампицину и стрептомицину.
Еще один путь предупреждения распространения плазмид резистентности — это использование соединений, эффективно подавляющих процессы переноса детерминанты устойчивости при конъюгации бактерий. Наиболее интенсивно ни этот процесс воздействуют рифампицин, бромистый этидий, кофеин, протамин, неомицин и нитрофураны. Некоторые из этих соединений обладают относительно низкой токсичностью и могут оказаться перспективными при использовании в ветеринарной практике. Так, введение цыплятам протамина и фуразолидона подавляет передачу плазмид резистентности у эшерихий.
Нарушение трансдукции химиотерапевтическими веществами, подавляющими перенос фагами детерминант устойчивости к лекарственным веществам, может ограничивать распространение устойчивых штаммов. Бромистый этидий и рифампицин подавляют частоту передачи R-фактора у эшерихий в 100 раз, что связано с подавлением адсорбции бактериофага на поверхности реципиентной клетки. Роккал и хлоргексидин предупреждают появление и накопление канамицин-резистентных микроорганизмов за счет антифагового действия в отношении трансдуцирующих бактериофагов.
Наиболее перспективный и реальный метод, ограничивающий появление и накопление устойчивых бактерий в организме животных — это повышение эффективности химиотерапии за счет использования комбинаций различных антимикробных препаратов. Так, быстрого приобретения устойчивости золотистого стафилококка к новобиоцину удается избежать благодаря его применению с тетрациклином. Использование изониазида со стрептомицином предупреждает развитие резистентных к антибиотику штаммов микобактерий туберкулеза. Метициллин и бензилпенициллин предотвращают быстрое формирование устойчивости к фузидину у стафилококков.
Помимо предупреждения развития резистентности, рационально подобранные сочетания антибактериальных препаратов могут воздействовать на устойчивые штаммы микроорганизмов с помощью подавления ферментов, инактивирующих один из компонентов смеси.
При комбинировании левомицетина с ампициллином и окситетрациклина с пенициллином удается воздействовать на ?-лактамазопродуцирующие штаммы Haemophilus influenzae и стафилококка за счет ингибирования бактериостатическими антибиотиками процесса ?-лактамазообразования в микробной клетке, в связи с чем резистентные микроорганизмы становятся чувствительными к ?-лактамазолабильным антибиотикам.
Для предотвращения развития лекарственной резистентности и воздействия на устойчивую микрофлору наиболее широко используют комбинированную химиотерапию.
Источник


