Мониторинг льготного лекарственного обеспечения.
Программа ведения учёта и подготовки отчётности по ДЛО.
Информационная система «Мониторинг льготного лекарственного обеспечения» предназначена для автоматизации процесса ввода и обработки карт учета льготного отпуска лекарственных средств.
Программа создаётся В целях реализации Федерального закона РФ от 22.08.2004 №122, для обеспечения прав граждан на получение необходимых лекарственных средств при оказании амбулаторной медицинской помощи .
 | Презентация программы. (823 кб.) |
| Сертификат Федерального фонда ОМС. | |
|---|---|
 | Информационная система «Мониторинг льготного лекарственного обеспечения» имеет сертификат соответствия требованиям нормативных документов Федерального фонда ОМС. Сертификат действителен до 22 декабря 2008 года. |
 | Сертификат ( 295 кб.). |
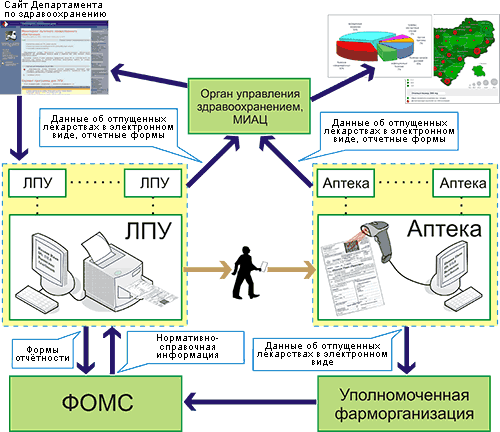 |
Комплекс программных средств «Мониторинг льготного лекарственного обеспечения» предназначен для решения задач, связанных с автоматизацией процессов дополнительного лекарственного обеспечения на уровне территории.
Целью создания комплекса является получение баз данных, содержащих информацию о выписанных и отпущенных лекарственных средствах, позволяющую проводить оперативный анализ и получать отчетные документы по предметно-количественному, стоимостному и персонифицированному учету лекарственных средств, выписанных и отпущенных гражданам, в отношении которых действуют меры социальной поддержки.
Для автоматизации процессов льготного лекарственного обеспечения на территориальном уровне комплекс позволяет консолидировать информацию в соответствии с перечнем лечебных и аптечных учреждений территории, участвующих в процессе ДЛО, и получать необходимые отчетные формы уже по территории в целом.
Комплекс работает с двумя группами льготных категорий граждан, имеющих право на получение набора социальных услуг:
- Федеральные (граждане, обладающие правом на ДЛО в соответствии с Федеральным законом №122-ФЗ от 22.08.2004);
- Региональные (граждане, обладающие правом на льготное лекарственное обеспечение в соответствии с законодательными актами, принятыми в регионе проживания).
В соответствии со своим назначением подсистема для лечебных учреждений обеспечивает выполнение следующих функций:
- Работа с картами учета льготного отпуска и рецептами по форме №148-1/у-06(л) (ввод, редактирование, удаление);
- Поиск рецептов и карт учета льготного отпуска;
- Формирование и печать на бланк рецепта и копии рецепта машиночитаемого штрих-кода, содержащего данные по выписанному рецепту (Идентификационный номер врача, Идентификационный номер ЛПУ, Серия и номер рецепта, Код нозологической формы, Источник финансирования, Процент льготы рецепта, Код МНН, СНИЛС гражданина, Дозировка, Количество единиц, Код категории гражданина, Срок действия рецепта и др.);
- Статистика по рецептам и картам учета льготного отпуска;
- Формирование отчетов;
- Выгрузка реестра выписанных льготных рецептов в соответствии с форматами, утвержденными Методическими рекомендациями Федерального фонда обязательного медицинского страхования (Приказ №38 от 21.03.06) и базы данных;
- Загрузка регионального сегмента Федерального регистра, регистра застрахованных ФОМС, нормативно-справочной информации, базы данных в централизованную базу данных.
Подсистема для пунктов отпуска обеспечивает выполнение следующих функций:
- Считывание данных штрих-кода согласно спецификации ПДФ417 и автоматизированная проверка соответствия данных штрих-кода рецепта и данных нормативно-справочной информации;
- Статистика по отпущенным лекарствам;
- Формирование отчетов;
- Выгрузка реестра отпущенных по льготным рецептам лекарств в соответствии с форматами, утвержденными Методическими рекомендациями Федерального фонда обязательного медицинского страхования (Приказ №38 от 21.03.06) и базы данных;
- Загрузка регионального сегмента Федерального регистра, регистра застрахованных ФОМС, нормативно-справочной информации, базы данных в централизованную базу данных.
При формировании штрих-кода применяется двухмерный штрих-код согласно ГОСТ Р 51294.9-2002 (ИСО/МЭК 15438-2001) «Автоматическая идентификация. Кодирование штриховое. Спецификация символики PDF417 (ПДФ417)».
Программа позволяет задавать сложные критерии поиска карт учета льготного отпуска и создавать собственные виды отчетов, имеет поддержку штрих-кодового кодирования рецепта и считывание полученного штрих-кода сканером штрих-кода. Программа функционирует как в автономном режиме рабочей станции, так и в составе локальной сети (с использованием одной из рабочих станций в качестве сервера БД).
Для работы комплекса требуется:
- Компьютер с процессором класса Pentium III или выше, объемом оперативной памяти, определяемым требованиями используемой операционной системы, и свободным местом на жестком диске не менее 100 Мб (в зависимости от объема загружаемых в информационную подсистему справочников и регистров).
- Монитор с разрешением экрана 800х600 или выше и глубиной цвета 256 или больше.
- Актуальная версия операционной системы Windows. Для сервера (компьютера, на котором в случае многопользовательской работы будет находиться база данных) рекомендуется серверная версия ОС Windows.
- FireBird версии 1.5.3.
- Для получения отчетных выходных форм необходимо наличие на компьютере пользователя любого текстового редактора, поддерживающего формат RTF — Rich Text Format (рекомендуется MS Word 6.0 или выше), и тип файлов RTF должен быть сопоставлен этому редактору.
Вариант программы для ЛПУ.
 | Если у загруженного файла расширение .ex_ измените его расширение на .exe! |
| Название и версия | тип файла | размер, кб |
|---|---|---|
| Обновления: | ||
 | Пакет обновления программы «Мониторинг льготного лекарственного обеспечения» до версии 16.0.2.332 от 30 марта 2021 года. |
: 
! Внимание. Эта версия программы предназначена для работы с данными только 2021 года.
1 815

! Все обновления регистров (федерального, врачей, лекарственных препаратов и т.д.) для программы распространяются ОГAУЗ СОМИАЦ.
1

: 
: 
653

2

: 
: 
: 
: 
! Внимание. Эта версия программы предназначена для работы с данными только 2021 года.
5 761

Установочный пакет СУБД «FireBird» версии 1.5.6.5026 Win32 (для установки в устарешие ОС).
:
 FAQ по FireBird.
FAQ по FireBird.Нормативно-правовые документы.
| дата | Название | кб. |
|---|---|---|
| 29 . 12 .200 5 | Приказ №131. | |
 | «О внесении изменений и дополнений в приказ ФОМС от 30.12.2004 г. №91 «Об организации информационного взаимодействия по обеспечению необходимыми лекарственными средствами отдельных категорий граждан» (в редакции приказов ФОМС от 24.05.2005 г. №51 и от 02.08.2005 г. №79)». | 114 |
| 24 . 05 .200 5 | Приказ №51. | |
 | «О внесении изменений и дополнений в приказ ФОМС от 30.12.2004 г. №91 «Об организации информационного взаимодействия по обеспечению необходимыми лекарственными средствами отдельных категорий граждан»». | 55 |
| 30.12.2004 | Приказ №91. | |
 | «Об организации информационного взаимодействия по обеспечению необходимыми лекарственными средствами отдельных категорий граждан». | 65 |
Дата изменения страницы: 17 мая 2016 г. 10:38:20
Источник
Мониторинг качества лекарственных препаратов в аптечной организации
Термины, виды мониторинга (внутренний и внешний), схема проведения, нормативная документация.
Эта статья в формате видеолекции здесь.
Согласно Федеральному закону №61-ФЗ «Об обращении лекарственных средств», качество лекарственного средства – это соответствие лекарственного средства требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации или нормативного документа. Нормативная документация – документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества лекарственного средства, методов контроля его качества, установленные его производителем. В свою очередь недоброкачественное лекарственное средство – это лекарственное средство, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа.
Обратите внимание, что понятие несоответствия нормативной документации или фармакопейной статье (ФС) подразумевает под собой не только несоответствие по каким-то показателям качества (упаковка, маркировка), но и в целом несоответствие условиям, указанным в нормативной документации и ФС: условиям хранения (температура и влажность), несоответствие сроков годности, которые установлены производителем или указаны в ФС. В этом случае лекарственный препарат будет недоброкачественным.
Также Федеральный закон №61-ФЗ дает определение таким понятиям, как фальсифицированное лекарственное средство — лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе, и контрафактное лекарственное средство — лекарственное средство, находящееся в обороте с нарушением гражданского законодательства.
В соответствии с приказом №647н, обеспечение населения качественными, эффективными и безопасными лекарственными препаратами является одной из составляющих системы качества аптечной организации в целом. Согласно Решению Совета Евразийской экономической комиссии от 03.11.2016 N 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза», обеспечение качества лекарственных средств — совокупность всех организационных мероприятий, проведенных в целях удовлетворения требованиям качества лекарственных средств в соответствии с их назначением.
Каким образом осуществляются организационные мероприятия по мониторингу качества лекарственных препаратов?
В первую очередь в аптечной организации должна быть разработана стандартная операционная процедура (СОП) – «Мониторинг качества лекарственных препаратов» (на текущий момент нет конкретных утвержденных наименований СОП, поэтому указанное наименование приведено для примера и может отличаться в разных аптечных организациях, но согласно п. 37 приказа 647н, все процессы деятельности субъекта розничной торговли, влияющие на качество, эффективность и безопасность товаров аптечного ассортимента, осуществляются в соответствии с утвержденными стандартными операционными процедурами).
Каким образом осуществляется отслеживание качества лекарственных препаратов?
Соблюдение температурного режима, влажности в аптечной организации, недопущение реализации лекарственных препаратов с истекшим сроком годности – показатели, отвечающие за соответствие лекарственных препаратов утвержденной нормативной документации. Кроме этого, аптечная организация получает информацию о выявлении новых серий и партий недоброкачественных лекарственных препаратов.
Подробнее рассмотрим основные этапы, на которых осуществляется мониторинг качества.
Если на этапе приемки выявляется несоответствие лекарственного препарата (и невозможность возвращения его в реализацию), препарат помещают в зону фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов и далее направляют на уничтожение. Если применение препарата приостановлено (и возможно возобновление его обращения), его помещают в карантинную зону, где обеспечиваются надлежащие условия хранения (в соответствии с требованиями производителя, ФС или нормативной документации), т.к. из карантинной зоны препарат может снова вернуться в обращение. В этом заключается основное различие карантинной зоны и зоны фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов. Согласно п. 66 приказа 647н, руководитель субъекта розничной торговли должен обеспечивать идентификацию товаров аптечного ассортимента, не соответствующих требованиям нормативной документации, в целях предотвращения непреднамеренного их использования или продажи. Фальсифицированные, недоброкачественные, контрафактные товары аптечного ассортимента должны быть идентифицированы и изолированы от остальных товаров аптечного ассортимента в соответствии со стандартными операционными процедурами. Маркировка, место и способы выделения карантинной зоны, а также лицо, ответственное за работу с указанными товарами аптечного ассортимента, устанавливаются приказом руководителя субъекта розничной торговли.
Это касается и заключительного этапа – места осуществления отпуска и реализации лекарственных препаратов.
Каким образом проводить внутренний мониторинг качества лекарственных препаратов?
Для учета показателей воздуха необходимо ежедневно вести регистрацию параметров температуры и влажности (журнал регистрации температуры как в помещении, так и внутри холодильного оборудования; может быть на бумажном носителе или в электронном виде с архивацией (для электронных гигрометров); журнал ведется ответственным лицом и хранится в течение одного года, не считая текущего).
Помещения для хранения лекарственных средств должны быть оснащены необходимым количеством поверенных в установленном порядке средств измерений (термометрами, гигрометрами, психрометрами и др.) для контроля и регистрации температуры и влажности, осуществляемых не реже одного раза в сутки.
Непрерывный контроль температурного режима при хранении термочувствительных (термолабильных) лекарственных средств в холодильных камерах, шкафах, холодильниках осуществляют с помощью термографов и терморегистраторов, показания которых, в случае иммунобиологических лекарственных препаратов, регистрируют не реже двух раз в сутки. Обязательно должны быть оформлены внутренние приказы: об учете показателей воздуха и об ответственном за ведение журналов.
Что касается учета сроков годности, согласно государственной фармакопее должна быть внедрена установленная в организации система учета лекарственных средств с ограниченным сроком годности. Если на хранении находятся нескольких серий одного наименования лекарственного средства, то для использования в первую очередь должно быть взято лекарственное средство, срок годности которого истекает раньше, чем у других.
В соответствии с приказом №706н, в организациях и у индивидуального предпринимателя необходимо вести учет лекарственных средств с ограниченным сроком годности (журнал) на бумажном носителе или в электронном виде с архивацией. Порядок ведения учета указанных лекарственных средств устанавливается руководителем организации или индивидуальным предпринимателем (приказ о порядке ведения учета лекарственных средств с ограниченным сроком годности). При выявлении лекарственных средств с истекшим сроком годности они должны храниться отдельно от других групп лекарственных средств в специально выделенной и обозначенной (карантинной) зоне.
Согласно п. 55 приказа №646н, лекарственные препараты, предназначенные для уничтожения, в соответствии со стандартными операционными процедурами должны быть маркированы и изолированы от лекарственных препаратов, допущенных к обращению (направляются в зону фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов).
Каким образом проводить внешний мониторинг качества лекарственных препаратов?
Внешний мониторинг подразумевает под собой ежедневную работу с сайтом Росздравнадзора. С главной страницы сайта необходимо перейти в раздел «Лекарственные средства» подраздел «Контроль качества лекарственных средств», после чего откроется страница электронных сервисов, обновляющихся ежедневно.
Сервис «Поиск писем по контролю качества лекарственных средств» содержит сведения о письмах Росздравнадзора о выявленных недоброкачественных, фальсифицированных лекарственных средствах; об отзыве лекарственных средств; об изменении дизайна упаковок лекарственных препаратов для медицинского применения; о подлежащих изъятию из оборота лекарственных средствах; о результатах проверок соответствия лекарственных средств, проведенных Росздравнадзором, а также о решениях Росздравнадзора о соответствии лекарственных средств установленным требованиям к их качеству и решениях Росздравнадзора, принятым по результатам выборочного контроля качества лекарственных средств.
В сервис включены сведения о письмах, опубликованных с 01.08.2018 года на интернет-портале Росздравнадзора.
Параметрами поиска являются: торговое наименование лекарственного средства, номер серии, название производителя, страна производства, тип решения Росздравнадзора, номер решения или период времени.
Для осуществления поиска необходимо внести один из перечисленных параметров в строку поиска или использовать «Расширенный поиск».
В сервисе «Поиск изъятых из обращения лекарственных средств» представлена информация о лекарственных средствах, которые изъяты из обращения в связи с несоответствием их качества.
Параметрами поиска являются: торговое наименование лекарственного средства, номер серии, название производителя, страна производства, статус лекарственного средства, номер информационного письма или период времени.
Для осуществления поиска необходимо внести один из перечисленных параметров в строку поиска или использовать «Расширенный поиск».
Сервис «Сведения о лекарственных средствах, поступивших в гражданский оборот в РФ» отражает информацию о сериях, партиях лекарственных средств, поступивших в гражданский оборот в Российской Федерации.
Параметрами поиска также являются: торговое наименование лекарственного средства, номер серии, название производителя, страна производства, статус лекарственного средства, номер информационного письма или период времени.
Каждое письмо несет в себе информацию о конкретном лекарственном препарате и дальнейших действиях, если такой препарат был выявлен в вашей аптечной организации.
Рассмотрим пример такого письма с типом решения: «О поступлении информации о выявлении недоброкачественного лекарственного средства». Был выявлен недоброкачественный лекарственный препарат «Урсосан» серии 0Е30418, и предложено (по конкретному субъекту – Воронежской области) обеспечить контроль за изъятием из обращения и уничтожением указанной партии недоброкачественного лекарственного средства (т.е. если указанный препарат был выявлен в аптечной организации, его необходимо направить в зону фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов). Что касается других субъектов РФ и иных партий указанной серии лекарственного препарата, в абзаце ниже говорится о приостановлении реализации и помещении в карантинную зону.
Другие типы решения:
— О необходимости изъятия лекарственного препарата
— О прекращении обращения серии лекарственного препарата
— Об отзыве из обращения лекарственного препарата (с возвратом производителю/с изъятием и уничтожением; действие, которое направлено на изъятие из цепи поставки лекарственных средств в случае выявления их ненадлежащего качества или выявления серьезных нежелательных реакций)
— О возобновлении реализации (если ранее реализация была приостановлена; препарат из карантинной зоны возвращается в основную зону хранения)
— Решение о соответствии лекарственного препарата требованиям нормативной документации (препарат также из карантинной зоны возвращается в основную зону хранения для последующей реализации)
Что касается документации системы качества, согласно п.4 приказа 647н, она ведется уполномоченными руководителем субъекта розничной торговли работниками на бумажных и (или) электронных носителях и включает в том числе документы, касающиеся приостановления (возобновления) реализации товаров аптечного ассортимента, отзыва (изъятия) из обращения лекарственных препаратов, выявления случаев обращения незарегистрированных медицинских изделий.
Ключевые наименования документов:
— приостановление
— отзыв
— изъятие
В соответствии с п. 30 приказа 646н, лекарственные препараты, в отношении которых субъектом обращения лекарственных препаратов не принято решение о дальнейшем обращении, или лекарственные препараты, обращение которых приостановлено, а также возвращенные субъекту обращения лекарственные препараты должны быть помещены в отдельное помещение/зону или изолированы с применением системы электронной обработки данных, обеспечивающей разделение (речь идет о карантинной зоне).
Лекарственные препараты, в отношении которых субъектом обращения лекарственных препаратов принято решение о приостановлении применения или об изъятии из обращения, а также фальсифицированные, недоброкачественные и контрафактные лекарственные препараты должны быть изолированы и размещены в специально выделенном помещении/зоне (речь идет о зоне фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов).
Предпринятые меры изоляции указанных лекарственных препаратов должны гарантировать исключение их попадания в обращение.
Подведем итог.
Аптечная организация обязана обеспечивать качество лекарственных препаратов в соответствии со схемой мониторинга, который делится на внутренний (температура, влажность, сроки годности) и внешний (отслеживание информации в соответствии с письмами Росздравнадзора), а вся процедура мониторинга качества должна быть прописана в соответствующей стандартной операционной процедуре (СОП)!
Следует обратить внимание, что тема мониторинга качества лекарственных средств в аптечной организации обязательно должна входить в сертификационный курс для провизоров и фармацевтов!
Источник












