- Как создать новую лекарственную молекулу?
- Путь к тысячам аптек начинается с одной молекулы
- Клинические исследования
- От идеи до готового препарата
- Молекулярная генетика против рака
- Откуда берутся новые лекарства?
- Факторы роста, их рецепторы и возникновение таргетной терапии
- Паучий яд против инсульта
- Кастинг и предварительная проверка
- Клинические исследования
- Кто и за чей счет проводит клинические исследования?
- Что такое протокол клинического исследования?
- Строго по закону
- Типы клинических исследований
- Фундамент, без которого никак
- Принцип собаки Павлова
- По воле случая
Как создать новую лекарственную молекулу?
Как создаются новые лекарства и что они из себя представляют, рассказала Ольга Рыбалкина, кандидат биологических наук, научный сотрудник НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга Томского НИМЦ.
Что вы представляете, когда слышите о разработке нового лекарственного препарата? Возможно, ученых-ботаников, собирающих в поле различные растения, или алхимиков, запертых в маленькой лаборатории? Как же на самом деле создаются новые лекарства и что они из себя представляют?
Под новым лекарством ученые-фармакологи понимают новое активное вещество (фармацевтическую субстанцию), которое может помочь человеку избавиться от какого-либо недуга. Цветные таблетки, мази или порошки, которые вы можете купить в аптеках, представляют собой комплекс активного вещества с разнообразными химическими добавками. Говоря о лекарствах, ученые имеют в виду их активные вещества.
Работа любого активного вещества, обладающего фармакологическим действием, заключается в том, что оно связывается с различными мишенями (например, бактерии, вирусы или с другие молекулы организма), благодаря чему происходит улучшение состояния человека. Поэтому одним из первых и самых важных этапов в разработке нового лекарственного средства является поиск потенциальных мишеней. Как это происходит? Многие из вас знают, что в нашем организме протекает множество химических процессов. Они представляют собой каскад очень больших и сложных реакций. В этих процессах выделяют ключевых участников (различные белки), нарушения в работе которых приводит к развитию различных заболеваний. Они и являются мишенями для новых лекарственных средств.
Представьте замок и ключ. Говоря о взаимодействии лекарства с белком-мишенью, ученые-фармакологи имеют в виду закрывание или открывание замка (белок-мишень) ключом (лекарство). Ключ всегда должен подходить к замку. Чтобы лекарственная молекула могла взаимодействовать с необходимым белком, она должна соответствовать множеству требований: физических, химических, геометрических. Эти параметры рассчитывают ученые-химики с помощью различных компьютерных методов, а взаимодействие «замок-ключ» моделируют в специальных программ. Этот сложный процесс называется молекулярным докингом.
Это метод молекулярного моделирования, который позволяет предсказывать наилучшее положение молекулы лекарства относительно белка-мишени. При молекулярном докинге используются трехмерные структуры. После этого запускается синтез новой молекулы.
Итак, новое лекарственное средство, способное подавлять какое-либо заболевание, должно связываться белком-мишенью. Это взаимодействие приводит к исправлению ошибки в каскаде реакций. Таким образом, человек избавляется от болезни.
- Какой путь проходит лекарство от лаборатории до аптечной витрины? Смотрите интервью на канале Россия 24. Гость студии – Светлана Крылова, доктор биологических наук, ведущий научный сотрудник НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга Томского НИМЦ.
Источник
Путь к тысячам аптек начинается с одной молекулы
Клинические исследования — очень важный, но далеко не единственный этап жизненного цикла лекарственного препарата
Автор
Редактор
Рецензент
В первой статье цикла, посвященного клиническим исследованиям, рассматривался долгий и непростой исторический процесс, в ходе которого сформировалась четкая и надежная, но вместе с тем весьма сложная система разработки и вывода на рынок новых лекарственных препаратов. Клинические исследования — важная, но не единственная часть этой системы. В этой статье мы коснемся каждого этапа и попробуем разобраться, как молекула «из пробирки» превращается в официально зарегистрированное лекарство. В основном речь пойдет о клинических исследованиях.
Клинические исследования
В статьях спецпроекта мы подробно расскажем о том, что такое клинические исследования, кто и как их проводит и с какими трудностями можно столкнуться при выводе нового лекарства на фармацевтический рынок.
Независимый рецензент спецпроекта — Алексей Водовозов, врач-терапевт высшей категории, медицинский журналист. Регулярно выступает с научно-популярными лекциями и ведёт блог «Смотровая военврача».
Партнер спецпроекта — компания «Атлант Клиникал»: международная контрактно-исследовательская организация, занимающаяся проведением клинических исследований.
В первой статье цикла — «С миру по нитке: как соединились компоненты клинического исследования» — мы рассказали о том, как постепенно выкристаллизовывалась современная концепция клинических исследований, формировались их методологическая и этическая составляющие [1]. В современной фармацевтике существует такое понятие как «жизненный цикл лекарственного препарата». Оно включает в себя не только клинические исследования, но и другие важные этапы:
- Разработка. На этом этапе исследователи в лабораториях ищут молекулы, которые могли бы решать те или иные терапевтические задачи и стать в будущем лекарством.
- Доклинические исследования (ДИ). Полученные на предыдущем этапе молекулы тестируют на животных и клеточных культурах, моделируют эксперименты на компьютерах.
- Получение патента. Этот документ защищает новый препарат от копирования, дает компании эксклюзивное право на его производство.
- Клинические исследования (КИ). Отобранные молекулы тестируют на здоровых добровольцах и пациентах.
- Регистрация. Фармкомпания получает разрешение на продажи препарата.
- Производство. После того как новое лекарство прошло необходимые исследования и было зарегистрировано, начинают его массовый выпуск.
- Маркетинг и продажи. Препарат, наконец, поступает в аптеки и становится доступен для всех пациентов. Лишь на этом этапе фармацевтическая компания начинает получать прибыль, окупая прежние вложения.
- Создание и вывод на рынок дженериков. Патентная защита распространяется на препарат в течение 20 лет, после чего другие фармацевтические компании получают возможность выпускать аналоги — дженерики.
Будем разбираться с самого начала.
От идеи до готового препарата
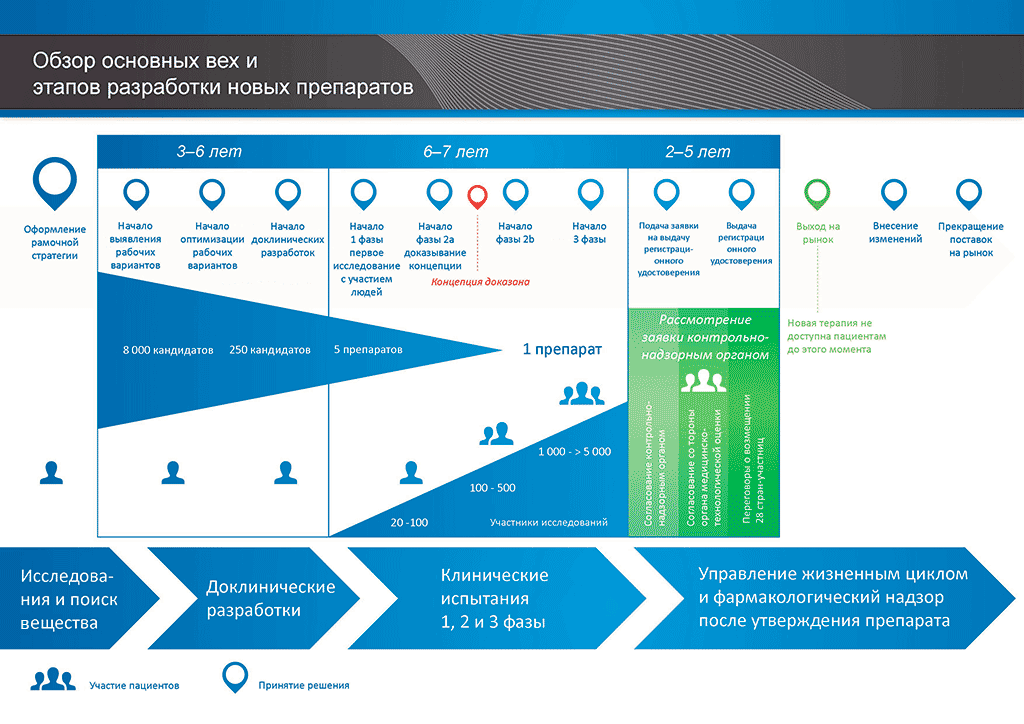
Путь от молекулы в лабораторной пробирке до препарата, который продается под разными названиями в каждой аптеке, невероятно тернист и долог. Он может прерваться на любом этапе, и чаще всего прерывается: из всех веществ, участвующих в доклинических разработках, лишь 2% становятся зарегистрированными препаратами. Остальные оказываются недостаточно эффективными или вызывают слишком тяжелые побочные эффекты.
Но даже кандидаты, успешно прошедшие жесткий «кастинг», далеко не сразу попадают в клиники и на аптечные витрины. По данным Европейской академии пациентов (EUPATI), для того чтобы новый препарат стал доступен покупателям, в среднем требуется 12 лет и затраты в размере миллиарда евро [2]. Такая сложность и дороговизна делают разработку новых лекарственных препаратов весьма рискованным бизнесом. Но если такие звезды зажигают — значит, это кому-то очень нужно.
Обычно на создание нового лекарства исследователей толкает так называемая неудовлетворенная потребность: если против какого-либо заболевания нет эффективных препаратов либо существующие лекарства недостаточно эффективны или вызывают тяжелые побочные эффекты. Стимулом может стать появление новых технологий, открытия в этиологии и патогенезе заболеваний [2], [3]. Например, сочетание неудовлетворенной потребности с появлением новых технологий в последние годы привело к появлению многих новых противоопухолевых препаратов.
Молекулярная генетика против рака
Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности. По данным Всемирной организации здравоохранения, в 2015 году онкологические заболевания убили 8,8 миллиона человек [4]. Зачастую злокачественные опухоли диагностируются на поздних стадиях, когда лечение может носить лишь паллиативный характер.
Одновременно за последние десятилетия сильно шагнули вперед технологии. Многие открытия сделаны в сфере молекулярной генетики. Ученые узнали о молекулярных механизмах, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
Это дало толчок к появлению сразу двух перспективных направлений в лечении онкологических заболеваний: таргетной терапии и иммунотерапии [4], [5].
Так, в конце 2014 года американское FDA (Food and Drug Administration, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) в ускоренном порядке одобрило сразу два иммунопрепарата из группы моноклональных антител : ниволумаб («Опдиво») и пембролизумаб («Китруда») [5], [9–12].
В реалиях современного мира есть еще два фактора, влияющие на принятие решения о разработке новых лекарственных препаратов: коммерческая целесообразность и политические интересы. Яркий пример — вакцина против вируса Зика, о которой шла речь в первой статье цикла «С миру по нитке: как соединились компоненты клинического исследования» [14], [15]. Правительства разных стран пытаются бороться с этой проблемой. Например, на территории Европейского Союза предусмотрена система наград и стимулов для компаний, разрабатывающих педиатрические препараты [16]. В России действует программа «Фарма-2020», задействованы институты развития и поддержки инноваций, различные фонды [17].
Этапы разработки новых лекарственных препаратов показаны на рисунке 1. В этой статье мы попытаемся проследить весь путь, разберемся, что происходит на каждом этапе, кто это регулирует и с какими сложностями сталкиваются стороны, принимающие участие.
Рисунок 1. Основные этапы разработки новых препаратов.
Откуда берутся новые лекарства?
Чаще всего поиск новых препаратов ведут «от болезни». Каждое заболевание характеризуется определенным патогенезом: некие процессы в организме происходят неправильно. Определенные молекулы вырабатываются в чрезмерно большом или малом количествах, их функция нарушена из-за «поломок» в генах, или в ткани проник патоген и вызвал ответную реакцию. Так или иначе, есть молекулы-мишени, воздействие на которые помогает исправить ситуацию. Задача ученых — выявить эти мишени и найти вещества, с помощью которых на них можно воздействовать.
Чаще всего мишенью для нового препарата становится рецептор — белок на поверхности клетки, который при активации вызывает определенные биохимические и физиологические эффекты, либо лиганд — сигнальная молекула, которая связывается с рецептором (или ДНК) и меняет его активность [18]. Один из примеров таких рецепторов-мишеней — подсемейство белков ErbB из семейства рецепторных тирозинкиназ.
Факторы роста, их рецепторы и возникновение таргетной терапии
В 1986 году два исследователя — Стэнли Коэн (рис. 2а) и Рита Леви-Монтальчини (рис. 2б) — получили Нобелевскую премию за открытие факторов роста [19]. В дальнейшем это сыграло колоссальную роль в развитии науки онкологии.
Ранее мы рассказывали об истории открытия факторов роста в статье «Повелевающая ростом» [20]. — Ред.
Рисунок 2а. Первооткрыватели факторов роста. Стэнли Коэн.
Рисунок 2б. Первооткрыватели факторов роста. Рита Леви-Монтальчини.
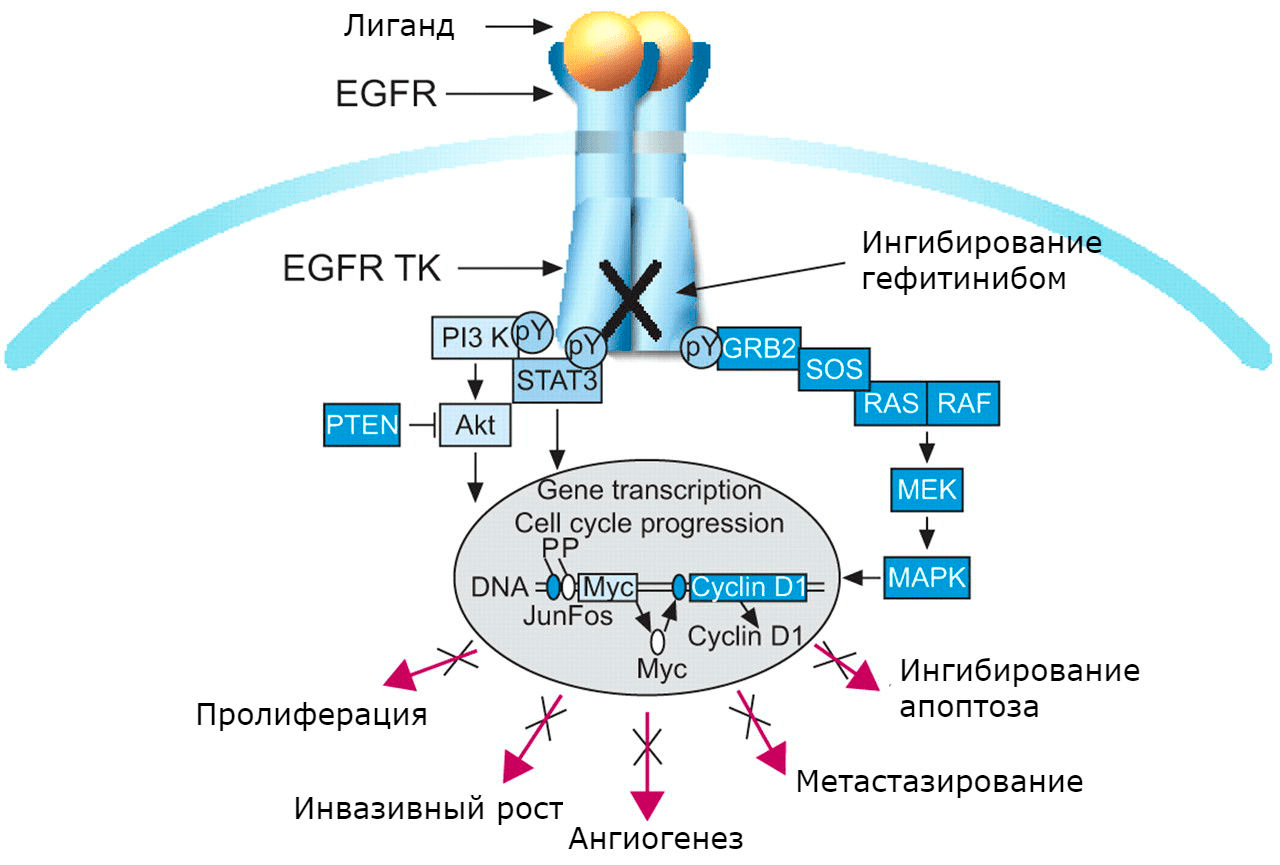
Оказалось, что повышенная активность трансмембранных белков из семейства рецепторных тирозинкиназ (EGFR, HER2) играет важную роль в развитии и прогрессировании рака [21].
Мишень была найдена, и вскоре появились способные поражать ее препараты. В 2002 году в Японии одобрили первый таргетный препарат, способный ингибировать «неправильный» EGFR — гефитиниб («Иресса») (рис. 3). В 2003 году его одобрило и FDA [22]. Сегодня у врачей уже есть большой выбор ингибиторов факторов роста и других «молекул-мишеней».
Рисунок 3. Сигнальный путь EGFR и механизм действия гефитиниба.
Другая стратегия предполагает движение «от потенциального препарата». Есть вещество, обладающее свойствами, которые могут быть полезны в медицине. Задача — найти точки приложения. Один из примеров недавно обнаруженного потенциального препарата — соединение в составе яда паука Hadronyche infensa.
Паучий яд против инсульта
Когда ученые проанализировали яд паука Hadronyche infensa, оказалось, что в нем содержится белок Hi1a. Дальнейший анализ показал, что этот белок блокирует ионные каналы ASIC1a, работа которых играет важную роль в повреждении клеток головного мозга при инсульте. В ходе экспериментов на лабораторных мышах Hi1a помог предотвратить повреждение мозга при остром нарушении мозгового кровообращения, восстановить неврологические функции. Результаты исследования опубликовали в апреле 2017 года, и есть надежда, что на основе «паучьего» белка удастся создать новые препараты [23].
Есть и третья «стратегия» — непредсказуемая. Иногда лекарства создают случайно. Пожалуй, самый показательный случай — тот, что произошел с ученым, не любившим наводить порядок в лаборатории, Александром Флемингом (рис. 4) . 3 сентября 1928 года, вернувшись из отпуска, микробиолог заметил, что в некоторых чашках со стафилококками выросли плесневые грибы, а сами бактерии погибли. Так был открыт пенициллин, и наступила эра антибиотиков [24].
Краткая биография Александра Флеминга и история открытия пенициллина изложены в нашей статье «Победитель бактерий» [25]. А еще на «Биомолекуле» есть интересный спецпроект «Антибиотики и антибиотикорезистентность».
Рисунок 4. Александр Флеминг — ученый, который не любил убирать в лаборатории, благодаря чему стал «отцом» первого антибиотика.
Кастинг и предварительная проверка
Итак, потребность в новом препарате налицо, найдены мишени и соединения, которые могут на них воздействовать. Что дальше? Среди потенциальных лекарственных веществ отбирают наиболее подходящие, их химическую структуру оптимизируют, стараются максимально повысить эффективность и безопасность, оценивают фармакодинамику и фармакокинетику. Проводят эксперименты на клеточных культурах «в пробирке» (in vitro), на лабораторных животных (in vivo) и с помощью компьютерного моделирования (in silico). И на каждом этапе нужно ответить на вопросы: «Стоит ли двигаться дальше?» и «Стоит ли инвестировать в разработку нового препарата время, деньги, ресурсы?». Если ответы отрицательные, работу прекращают [26–28].
Все перечисленные мероприятия — это доклинические исследования. Прежде чем начинать испытания с участием людей, нужно тщательно оценить все минусы нового препарата: системные и местные токсические эффекты, влияние на мужскую и женскую репродуктивные функции, способность вызывать реакции гиперчувствительности, генотоксичность, канцерогенность. Оценивают процесс попадания препарата в организм, распределение, особенности метаболизма, процесс выведения.
Впрочем, не всегда удается заранее проанализировать все нюансы. Например, оценка канцерогенности занимает длительное время и может продолжаться параллельно с клиническими исследованиями [28].
Важно, чтобы все процессы на стадии доклинических исследований были четко спланированы и соответствовали некоторым стандартам:
- Для того чтобы провести опыты над клеточными культурами и животными, нужно произвести достаточное количество экспериментального препарата. Обеспечить соответствующее качество помогает стандарт GMP (Good Manufacturing Practice, «Надлежащая производственная практика»). В этом документе указаны требования к персоналу, оборудованию, технологическому процессу, рекомендации по предотвращению загрязнения, смешивания разных веществ и совершения ошибок [28], [33]. На территории России действуют: ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств», приказ Министерства промышленности и торговли РФ от 14.06.2013 г. № 916 (в ред. от 18.12.2015 г.) «Об утверждении правил надлежащей производственной практики» (фактически перевод GMP Евросоюза), приказ Минпромторга РФ № от 12.12.2013 г. № 1997 «Об утверждении рекомендаций по организации производства и контроля качества лекарственных средств» и «Правила надлежащей производственной практики Евразийского экономического союза». В дальнейшем при производстве лекарственного препарата все эти нормативные акты также нужно соблюдать.
- Доклинические исследования на животных (рис. 5) проводят в соответствии со стандартом GLP (Good Laboratory Practice, «Надлежащая лабораторная практика»). На территории России действует идентичный ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики».
Рисунок 5. Лабораторная мышь — один из главных героев доклинических исследований [79]. Ей даже установили памятник в новосибирском Академгородке, около Института цитологии и генетики (ИЦиГ) Сибирского отделения РАН.
Клинические исследования
Теперь будущий лекарственный препарат уже прошел большой путь: его отобрали, возможно, среди тысяч других кандидатов, всячески изучили, проверили на лабораторных животных. Но самое интересное только начинается.
Мы, наконец, добрались до главной темы нашей статьи. Пришло время проверить новое лекарство на людях.
Кто и за чей счет проводит клинические исследования?
В качестве организатора КИ могут выступать разработчик лекарственного препарата или уполномоченное им лицо, образовательные организации (высшего или дополнительного профессионального образования — различные вузы), научно-исследовательские организации. Организатор может проводить клинические исследования за свой счет либо с привлечением средств различных фондов. Чаще всего организатором и спонсором является частная компания, которая планирует производить препарат и представлять его на рынке [34].
Естественно, фармкомпании хочется, чтобы ее детище показало себя только с лучшей стороны. В конце концов, тратятся огромные суммы, и их нужно окупать. Это может повлиять на непредвзятость результатов, стать причиной смещения в пользу преимуществ препарата и замалчивания недостатков, побочных эффектов.
Важно, чтобы в процессе принимала участие независимая контролирующая структура, которая могла бы гарантировать честность и прозрачность. В США эта функция возложена на FDA, в Европе — на EMA (European Medicines Agency) [35]. В России аналогичную функцию выполняют Департамент государственного регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) [36].
Раньше фармкомпании зачастую проводили исследования самостоятельно. Хотя в качестве исполнителя могли задействовать медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям [37]. В современном мире в роли исполнителя все чаще выступают профессиональные контрактные исследовательские организации — CRO (Contract research organization) [38], [39]. От такого аутсорсинга выигрывают все. С одной стороны, процесс для фармкомпании сильно упрощается и ускоряется. Сотрудничество с CRO открывает доступ к современным технологиям и помогает завершать клинические исследования в среднем на 30% быстрее [38]. В то же время результаты таких исследований являются более надежными и непредвзятыми.
В России дело обстоит несколько иначе. Многие фармкомпании предпочитают проводить клинические исследования своими силами. Так, в 2013 году Минздрав России выдал 791 разрешение на проведение клинических исследований, и лишь в каждом третьем из них были задействованы CRO. Однако ситуация постепенно меняется. Очевидно, что аутсорсинг с участием CRO — это удобно и выгодно, а значит, он все больше будет набирать обороты [40].
Что такое протокол клинического исследования?
Составление протокола клинического исследования — один из самых сложных и трудоемких этапов. Протокол — это особый документ, и от того, насколько корректно он сформулирован, зависит достоверность результатов исследования. Вот основные данные, которые должен содержать этот документ [41]:
- дизайн исследования (о нем речь пойдет ниже);
- цель и значение исследования;
- место и время проведения;
- размер выборки пациентов, критерии включения и исключения;
- методология, процедуры, которые планируется использовать;
- методы сбора и анализа данных;
- график процедур;
- этические вопросы;
- необходимые технические, финансовые, научные и прочие ресурсы.
Без протокола нельзя получить разрешение на проведение клинического исследования и пройти этическую экспертизу [42], [43]. Протокол исследования просто так изменить нельзя, для этого придется подавать в уполномоченный государственный орган заявление по установленной форме [42].
Строго по закону
Основной стандарт, регулирующий проведение клинических исследований в мире — GCP (Good Clinical Practice, «Надлежащая клиническая практика»). Он составляет научную, этическую и организационную основу. О нем уже рассказано в первой статье цикла.
Регулирующие документы в России:
Соблюдение установленных правил в России контролирует Министерство здравоохранения, на территории Евросоюза — EMA, в США — FDA.
Типы клинических исследований
В ходе клинических исследований можно изучать не только новые лекарственные препараты, но и методы профилактики, диагностики, скрининга, способы улучшения качества жизни пациента, эпидемиологию, связь между генетическими дефектами и различными заболеваниями.
В первой статье цикла уже говорилось о двух типах клинических исследований: обсервационных (наблюдательных) и клинических интервенционных. В свою очередь, они делятся на подтипы [44].
Наблюдательные исследования бывают описательными, когда описывают какое-либо явление (клиническую картину, заболеваемость, смертность), и аналитическими, когда на основе описательных данных делают вывод о причинных факторах.
Еще исследования бывают ретроспективными, в ходе которых изучают исходы, полученные до начала исследования (по архивным данным), и проспективными, когда исходы у участников наступают в ходе или по завершении исследования.
В зависимости от длительности наблюдения и количества участников, наблюдательные исследования делят на три разновидности:
- Одномоментные эпидемиологические исследования (исследования распространенности) представляют собой, по сути, «моментальный снимок». Их проводят в течение короткого времени. У участников исследования констатируют наличие заболевания и определенных факторов и делают вывод о взаимосвязи между ними.
- Когортные исследования занимают больше времени, они помогают оценить ситуацию в динамике, вклад, который вносят различные факторы в развитие и прогрессирование заболеваний. За испытуемыми наблюдают в течение некоторого времени, исследование может предполагать периодические обследования и осмотры врачей, заполнение опросников и анкет. В конечном итоге регистрируют исходы, например, случаи развития заболеваний, осложнений, выздоровления и смертность.
- Исследование случай—контроль предполагает сравнение людей, страдающих теми или иными заболеваниями, со здоровыми людьми из той же популяции [44–47].
Для нас сейчас наибольший интерес представляет вторая группа — клинические интервенционные исследования. Именно они позволяют наиболее эффективно установить причинно-следственные связи и оценить работу нового препарата на людях. В таких исследованиях большое значение имеют три принципа: плацебо-контроль, рандомизация и двойное ослепление. Поговорим о них подробнее, и тут самое время вспомнить о том, что такое дизайн клинического исследования.
Фундамент, без которого никак
Дизайн клинического исследования — это описание того, как исследование будет проводиться. Важно заранее продумать каждую мелочь. Если дизайн исследования некорректен, вся работа будет загублена на корню.
Принцип собаки Павлова
В своей книге «Лекции о работе больших полушарий головного мозга» Иван Петрович Павлов описал эксперимент, во время которого собакам под кожу вводили морфий. Первой реакцией при этом была рвота, затем наступал сон. Регулярно повторяя процедуру, исследователи добились того, что рвоту у животных вызывало введение под кожу любой индифферентной жидкости [48].
Это явление известно как эффект плацебо. Представителям псевдомедицины оно помогает успешно вести бизнес, а ученым — проверять, обусловлены ли положительные эффекты препарата реальным действием или условным рефлексом, силой внушения. Пациентов делят на две группы, одним дают новое лекарство, другим — «пустышку». Спустя некоторое время оценивают результат. Схема простая, удобная и эффективная, но есть одна сложность. Иногда, если пациент получает вместо препарата плацебо, это приводит к фатальным последствиям. В таких случаях применять плацебо-контроль неэтично. Но есть альтернативы:
- В некоторых случаях исследуемый препарат и плацебо можно назначать в сочетании со стандартным лечением.
- Пациенты из контрольной группы могут получать вместо плацебо другой препарат. Таким образом, исследование превращается в сравнение эффективности двух лекарств. Такой контроль называется активным или позитивным, в отличие от негативного плацебо-контроля. Если исследуемый препарат оказывается эффективнее контрольного, в дальнейшем это можно использовать в маркетинговых целях. Зачастую регулирующие организации требуют в третьей фазе КИ именно такой активный контроль.
- Когда внешний вид двух препаратов при активном контроле сильно различается, прибегают к маскированию. Например, если исследуемый препарат представляет собой таблетки, а контрольный — ингалятор, то пациент и врач могут легко догадаться, что это за лекарство, и ослепления не получится. Поэтому одни пациенты получают лекарство в таблетках и плацебо в ингаляторе, а другие — лекарство в ингаляторе и «пустышку» в таблетках. Таким образом, комбинация препаратов в каждой из двух групп выглядит совершенно одинаково.
- Если других препаратов для лечения заболевания нет или лекарство нужно сравнить с иными методами лечения (например, хирургическим), можно использовать контроль по архивной статистике (исторический контроль). Исходы пациентов, которые получают новый препарат, сравнивают с уже имеющимися статистическими данными [45].
По воле случая
Делить участников исследования на группу лечения и контрольную группу нужно правильно. Крайне утрированный, но наглядный пример: представим себе фармкомпанию, которая решила вывести на рынок новый препарат для улучшения памяти. В исследовании принимают участие 100 пациентов, их поделили на две группы по 50 человек, одним дают чудо-лекарство, другим — таблетки из мела. Так получилось, что в группу лечения попали преимущественно здоровые молодые люди. В контрольной же оказалось много пожилых людей, у некоторых есть первые симптомы болезни Альцгеймера. Вопрос на засыпку: окажется ли новый препарат «эффективнее», чем плацебо?
В реальной жизни, конечно же, ситуация далеко не всегда настолько проста и очевидна . Иногда кажется, что никакой разницы между группами нет, но из внимания ускользают нюансы, в итоге сильно искажающие картину. Зачастую люди, которые проводят исследования, «отбирают» в группы «нужных» участников неосознанно, особенно когда очень хочется получить положительный результат. Интересный пример с крысами и телепатией приводит в своем блоге популяризатор науки Александр Панчин.
О том, почему в клинических исследованиях предпочитают задействовать мужчин, а не женщин, рассказывает статья «Муж и жена — одна сатана?» [81]. — Ред.
Для того чтобы избежать ошибок, нужно «бросить кости» — распределить участников исследования по группам случайно, вслепую. Этот процесс называется рандомизацией. И она бывает разной (рис. 6) [49]:
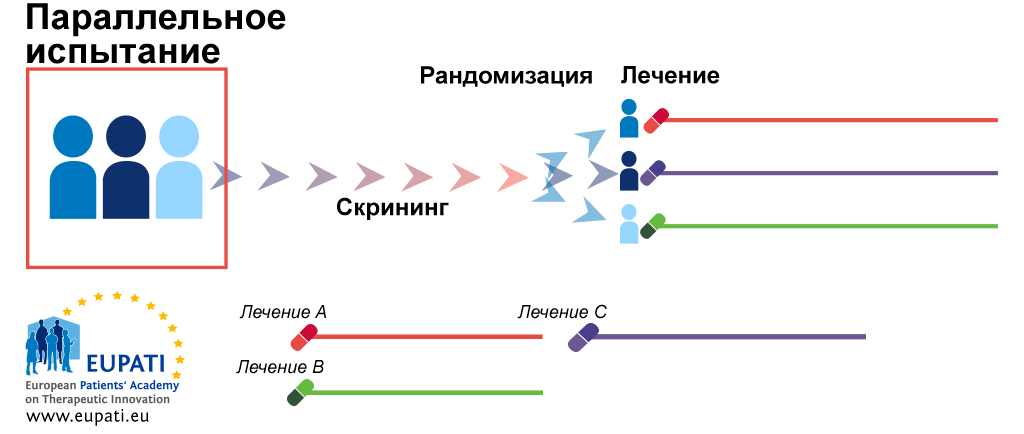
- Параллельная рандомизация — самый простой вариант (рис. 6а). Участников делят на две (или больше) группы. Каждой группе делают свои назначения, и они не меняются до конца исследования.
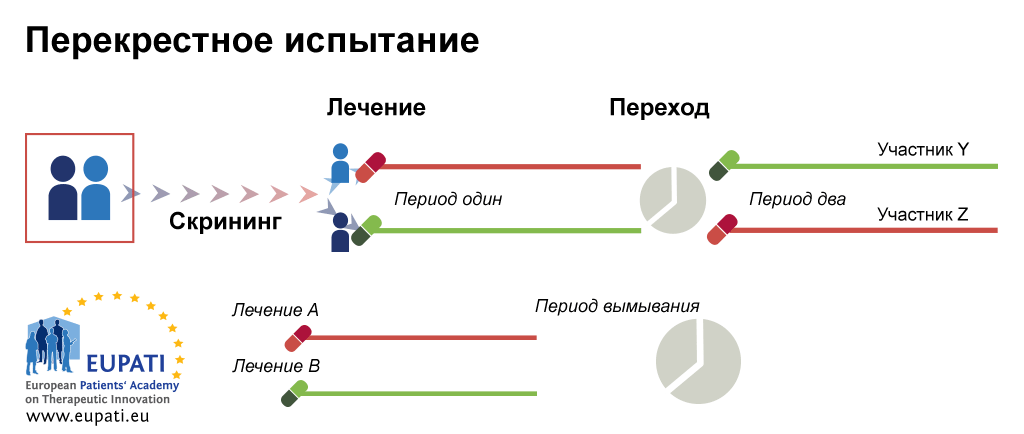
- Перекрестная рандомизация. Снова рассмотрим самый простой случай, когда есть две группы участников: одна получает препарат А, другая — препарат Б. При перекрестной рандомизации на определенном этапе их «меняют местами». Пациентам, прежде получавшим препарат А, начинают вводить препарат Б, а те, кого лечили препаратом Б, отныне получают препарат А (рис. 6б).
- Рандомизация со связанными парами. В начале участников исследования разбивают на пары, при этом в пару попадают похожие люди. Одному из них случайным образом назначают препарат А, другому — препарат Б (рис. 6в).
- Стратификация — процесс, в ходе которого участников исследования делят на группы, объединенные определенными признаками: возраст, пол, характер питания, образ жизни, вредные привычки. Затем членов каждой группы рандомизируют. Это помогает проверить, как разные виды лечения действуют на людей, объединенных общими признаками.
- Выборочное исследование. Выбирают определенные географические области — например, регион, или город, — в каждой из которых делают выборку участников, затем все выборки объединяют в общую группу.
- Исследование с отменой лечения. В течение некоторого времени все участники исследования получают лечение одним препаратам. Затем их рандомизируют, и в одной из групп лечение отменяют (рис. 6г).
- Факториальный дизайн предполагает исследование с участием разных препаратов. Например, первая группа получает препараты А и Б, вторая — А и В, третья — Б и В. Это дает возможность оценить эффективность комбинированной терапии и взаимодействие между препаратами (рис. 6д).
Рисунок 6а. Виды рандомизации. Параллельное испытание.
Рисунок 6б. Виды рандомизации. Перекрестное испытание.
Источник