- Желудочно-пищеводный разрывно-геморрагический синдром (K22.6)
- Общая информация
- Краткое описание
- Автоматизация клиники: быстро и недорого!
- Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран 1 место — 800 RUB / 4500 KZT / 27 BYN в месяц
- Классификация
- Этиология и патогенез
- Эпидемиология
- Факторы и группы риска
- Клиническая картина
- Клинические критерии диагностики
- Cимптомы, течение
- Диагностика
- Лабораторная диагностика
- Дифференциальный диагноз
- Осложнения
- Лечение
- Синдром маллори вейсса причины диагностика лечебная тактика
- Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
- МКБ-10
- Общие сведения
- Причины синдрома Меллори-Вейса
- Патогенез
- Классификация
- Симптомы синдрома Меллори-Вейса
- Осложнения
- Диагностика
- Лечение синдрома Меллори-Вейса
- Прогноз и профилактика
Желудочно-пищеводный разрывно-геморрагический синдром (K22.6)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 4500 KZT / 27 BYN — 1 рабочее место в месяц
Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Признак распространенности: Распространено
Соотношение полов(м/ж): 2
Среди причин кровотечений из верхних отделов желудочно-кишечного тракта с индром Маллори-Вейсса встречается с частотой 4-4,5% у детей и 6,4% у взрослых. Чаще возникает у мужчин.
Данный синдром превалирует среди пациентов в возрасте 40-50 лет, но может возникать и в другом возрасте.
Факторы и группы риска
Факторами риска выступают:
— хронические воспалительные заболевания верхнего отдела пищеварительного тракта (эзофагит, хронический гастрит, язвы пищевода и кардиального отдела желудка);
— употребление алкоголя;
— беременность;
— булимия Булимия — патологическое, резко усиленное чувство голода, нередко сопровождающееся общей слабостью и болями в животе.
;
— сильный кашель;
— частые приступы сильной икоты;
— грыжа пищеводного отверстия диафрагмы.
Заболевание чаще возникает среди пациентов, у которых отмечается повышенное давление и застой крови в венах, идущих к печени, — такое состояние называется портальной гипертензией (Портальная гипертензия — K76.6).
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Основное клиническое проявление синдрома Мэллори-Вейсса — наличие светлой или темной крови в рвотных массах, которая обычно появляется после предшествующей многократной рвоты или сильного кашля. При выраженном кровотечении у больных могут отмечаться бледность, слабость и снижение артериального давления.
В дальнейшем наблюдается черный дегтеобразный стул или мелена Мелена — выделение кала в виде липкой массы черного цвета; обычно признак желудочно-кишечного кровотечения.
Подробно (в зависимости от количества и темпа продвижения проглоченной крови по желудочно-кишечному тракту).
Диагностика
Лабораторная диагностика
Дифференциальный диагноз
Осложнения
Осложнения могут быть связаны с кровопотерей, инфицированием, нарушением питания.
Лечение
Немедикаментозное лечение. После купирования пищеводно-желудочного кровотечения назначают диета №1а по Певзнеру. Пища не должна быть очень холодной или горячей. Рекомендуется 4-5-разовый прием пищи, в процессе еды следует медленно и тщательно пережевывать пищу. Больным необходимо избегать переедания, горизонтального положения тела после приема пищи, а также предпочтителен сон в полусидячем положении. Диета расширяется постепенно.
Медикаментозное лечение. Используется кровоостанавливающая и кровозаместительная терапия. Основной целью является стабилизация АДсист. Абсолютное показание к переливанию крови — гемоглобин ниже 80 г/л. После купирования кровотечения назначают секретолитики (ИПП, блокаторы Н2-гистаминовых рецепторов), препараты коллоидного висмута, невсасывающиеся антациды и другие.
Хирургическое лечение. Применяют эндоскопические методы остановки кровотечения (лазеротерапия, мультиполярная электрокоагуляция, термокоагуляция, введение сосудосуживающих средств и др.), выполняющиеся немедленно после стабилизации гемодинамики.
Источник
Синдром маллори вейсса причины диагностика лечебная тактика
Введение
Актуальность проблемы пищеводно-желудочного разрывно-геморрагического синдрома (синдрома Маллори — Вейсса) остается довольно значимой и по сей день, несмотря на достижения современной медицины [1,2,6]. Разрывно-геморрагический синдром относится к числу неотложных состояний в абдоминальной хирургии [4,6]. Несмотря на значительные успехи в эндоскопическом лечении гастродуоденальных кровотечений, известные традиционные способы местного гемостаза не дают желаемых результатов [1,7]. Анатомическая локализация источника кровотечения при синдроме Маллори — Вейсса сопряжена с определенными техническими трудностями оперативного гемостаза, прежде всего сложностью ушивания стенки пищевода из гастротомической раны, наличием множественных дефектов и обширной интрамуральной гематомы. Надежность гемостаза обеспечивается использованием оптимального для данного вида кровотечения способа его остановки [5]. Применяя современные эндоскопические технологии, можно осуществить гемостаз, дать прогноз риска рецидива кровотечения. Неприменение методов эндоскопического гемостаза приводит к необходимости хирургического лечения 7,8-46,2 % больных с СМВ [5,8].
Рецидивы кровотечения при СМВ отмечаются в 20-30 % наблюдений, послеоперационная летальность составляет 10-17 %, общая — 0,4-1,8 %. Эндоскопическое оборудование открывает новые возможности лечения таких больных, поэтому продолжается поиск новых и модернизация уже известных методик остановки кровотечения при синдроме Маллори — Вейсса путем комбинированного воздействия на очаг кровотечения различных способов эндоскопического гемостаза с параллельным применением общих мероприятий гемостатического, антисекреторного, кровезамещающего действия.
Возникает необходимость дальнейшего изучения действенности применяемых методов эндоскопических вмешательств, которые позволяют осуществлять гемостаз и профилактику рецидивов внутриполостных кровотечений на всех этапах лечения. Это позволит значительно снизить процент экстренных операций и улучшить конечные результаты лечения больных с синдромом Маллори — Вейсса.
Цель настоящего исследования. Оптимизация лечебно-диагностического алгоритма у больных с синдромом Маллори — Вейсса.
Материал и методы исследования
В исследование вошло 332 пациента с СМВ, госпитализированных в НХЦ МЗ КР в период 2009-2012 гг. Мужчины в группе составили 87,9 %, женщины — 12,1 %. Возрастной состав исследуемой группы пациентов с СМВ был следующим: в возрасте 21-60 лет было 83,7 %; лица до 20 лет — 3,1 %, старше 60 лет — 13,2 %. За последние 12 лет СМВ был причиной кровотечений в 28,7 % наблюдений, причем за последние 3 года прослеживалась отчетливая тенденция к росту количества таких наблюдений. Необходимо также отметить, что большинство больных (84,9 %) были госпитализированы в состоянии алкогольного опьянения. Данное обстоятельство является отягощающим в плане организации экстренной диагностики, выбора более сложных методов интенсивной терапии.
Особенностью больных с СМВ является также высокая частота сопутствующих заболеваний — до 88,6 %, причем у 37,6 % выявлено 3 заболевания и более: грыжи пищеводного отверстия диафрагмы (41,1 %), заболевания печени (хронический гепатит, цирроз) и желчных путей (54,3 %), хронический панкреатит (45,4 %), хронические гастриты, язвенная болезнь желудка (по 26,1 %), заболевания сердечно-сосудистой системы (43,4 %). Необходимо отметить особенности СМВ в последние годы — нередкое сочетание нескольких причин кровотечения: с варикозным расширением вен пищевода и желудка, эрозивным эзофагитом и гастритом, язвой кардиального отдела желудка. В такой ситуации возникают особые сложности в диагностике ведущей причины кровотечения и соответственно в выборе способа гемостаза.
Результаты исследования и их обсуждение
Диагностические мероприятия на этапе госпитализации при СМВ осуществлялись в следующей последовательности. После оценки степени тяжести кровопотери больным выполнялась эзофагогастроскопия. Ее выполнение нередко усугубляет состояние больного за счет возобновления уже остановившегося кровотечения, появления новых разрывов (судорожные позывы к рвоте во время эндоскопии) или увеличения уже имеющегося разрыва пищевода. Поэтому больным с клинической картиной СМВ такое исследование необходимо выполнять после введения противорвотных препаратов и внутривенной седатации.
По клинико-анатомическим признакам мы используем классификацию Ш. В. Тимербулатова и соавт. [4], в которой выделяют следующие стадии синдрома Маллори -Вейсса:
I. Разрыв (трещины) слизистой нижней трети пищевода, кардиоэзофагеального перехода;
II Разрыв (трещина) слизистой, подслизистого слоя;
III. Разрыв (трещина) с вовлечением циркулярного мышечного слоя. Зона разрыва не спазмируется, не смыкается, наблюдается интенсивное кровотечение;
IV. Разрыв всех слоев пищевода, кардиоэзофагеального перехода, сопровождается пневмотораксом, пневмомедиастинумом, медиастинитом — при разрыве грудного отдела и перитонитом — при разрыве абдоминального отдела пищевода.
В отличие от классификации В. Bellmann выделение дополнительной стадии (III) считаем принципиально важным как с точки зрения клинико-морфологической оценки глубины повреждения стенки пищевода и желудка, так и для обоснования возможностей использования различных методов гемостаза. Как было отмечено выше, в диагностике СМВ основное значение имеет эндоскопическое исследование.
При СМВ диагностические мероприятия сводятся к установлению: 1) факта кровотечения; 2) продолжения или его остановки; 3) источника кровотечения. Эти вопросы, а также необходимость дифференцированного подхода к выбору из множества консервативных, эндоскопических, хирургических методов наиболее надежного способа требуют большей детализации эндоскопических критериев кровотечения по классификации J. Forrest. По аналогии с классификацией гастродуоденальных язвенных кровотечений В. Ю. Подшивалова [3] считаем целесообразным дополнение степени активности кровотечения при СМВ двумя характеристиками:
F-lc — фиксированный сгусток в области дна разрыва или по краю разрыва (разрывов) с подтеканием крови из-под сгустка;
F-ld — интенсивное кровотечение без возможности локализовать, визуализировать источник кровотечения.
По нашим наблюдениям, стабильность гемостаза и опасность возобновления кровотечения зависят от величины сосудов по краям разрывов: чем крупнее сосуды (>1 мм), тем вероятнее опасность рецидива. Риск повторного кровотечения велик при свежем рыхлом кровяном сгустке, а также при больших (>5 см) и множественных разрывах.
При эндоскопической картине остановившегося кровотечения (F-2a, F-2b, F-2c) или при эндоскопическом надежном гемостазе больных госпитализировали в отделение реанимации и интенсивной терапии для проведения инфузионно-трансфузионной терапии.
При осуществлении гемостаза придерживались следующих положений:
- Показания к хирургическому лечению (продольная гастротомия с ушиванием разрывов) устанавливали (3,7 %) при кровотечениях F-ld, при невозможности (неудачных попытках) эндоскопического гемостаза при F-la и рецидивах кровотечения при F-lc.
- Основными методами эндоскопического гемостаза явились: инфильтрационный — субмукозное введение этоксисклерола, этанола, разведенного адреналина — с обеих сторон трещины (до 4 точек). Доза 1 % этоксисклерола составляла от 2 до 15 мл, а при множественных трещинах — до 25 мл. При неуверенности в окончательном гемостазе дополнительно в края разрывов вводили один из инъекционных препаратов. Учитывая довольно высокий риск рецидива кровотечения при СМВ, для профилактики рецидива и при F-2a, F-2b применяли инфильтрационный метод.
Необходимо отметить, что тактика ведения больных при СМВ в различных клиниках разная и во многом зависит от принятой доктрины, решения организационных вопросов (например, наличие круглосуточной эндоскопической помощи), материально-технического оснащения эндоскопических отделений, накопленного клинического опыта диагностики и лечения и др.
Из общего числа больных консервативное лечение было проведено у 71,3 %, местное орошение раствором нитрата серебра у 14,3 %, препаратом «Капрофер» у 5,8 %, инфильтрационный метод у 49,1 %, хирургическое лечение — у 3,7 %. Местное орошение использовалось при кровотечениях активности F-1b и СМВ I и II стадий. Рецидивы кровотечения после хирургического лечения отмечены у 2 (15,3 %) из 13 больных, после местного орошения области разрывов — у 14,6 %. Общая летальность после использования всех способов лечения составила 3,4 %.
Заключение
Таким образом, выделение клинико-анатомических стадий синдрома Маллори -Вейсса и детализация степени активности кровотечения позволяют более дифференцированно выбрать методы лечения больных.
Рецензенты:
Ниязов Б.С., д.м.н., профессор, заведующий кафедрой хирургии ФУВ, Кыргызский государственный медицинский институт переподготовки и повышения квалификации, г. Бишкек.
Алыбаев Э.У., д.м.н., профессор кафедры госпитальной хирургии с курсом оперативной хирургии, Кыргызская государственная медицинская академия, г. Бишкек.
Источник
Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
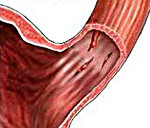
Синдром Меллори-Вейса — линейные разрывы слизистой кардиоэзофагеальной зоны, возникшие на фоне рвоты, позывов на рвоту, икоты. Проявляется наличием крови в рвотных массах, эпигастральными или загрудинными болями, артериальной гипотензией, тахикардией. Диагностируется с помощью эзофагогастроскопии, обзорной рентгенографии брюшной полости. Для лечения применяется гемостатическая, кровезаместительная терапия, противорвотные препараты, сердечные аналептики, ингибиторы протонной помпы, Н2-гистаминоблокаторы, антациды. При необходимости выполняется эндоскопический гемостаз, терапевтическая эмболизация, гастротомия для ушивания повреждений.
МКБ-10
Общие сведения
Впервые клиника разрывно-геморрагического синдрома была описана в 1929 году американскими патологами Дж.К. Меллори и С. Вейсом. В настоящее время заболевание является одной из ведущих причин неязвенных кровотечений из верхних отделов пищеварительного тракта. Распространенность патологии достигает 5-10%. Болезнь Меллори-Вейса выявляется преимущественно у 45-60-летних пациентов, злоупотребляющих спиртными напитками. У мужчин разрывы желудочной и пищеводной слизистой возникают в 7 раз чаще, чем у женщин. У 79-80% больных поражается эзофагогастральный переход, у 16-17% — стенка пищевода, у 3-5% — кардиальная оболочка. Длина разрывов обычно составляет 0,4-4,5 см. В 77-78% случаев повреждения являются единичными, в 22-23% — множественными.
Причины синдрома Меллори-Вейса
Продольные разрывы слизистой в области пищеводно-желудочного перехода возникают при локальном повышении давления у пациентов со сниженной резистентностью эпителиального слоя. Предпосылками к развитию разрывно-геморрагического гастроэзофагеального синдрома служат патологические процессы, при которых повреждаются эпителиоциты или наблюдается повышенное кровенаполнение сосудов верхних отдела ЖКТ: асептическое воспаление слизистой при частом употреблении спиртных напитков, воспалительные заболевания ЖКТ (эзофагиты, гастриты), длительный прием НПВС, кортикостероидов, скользящая грыжа пищеводного отверстия диафрагмы, расширение пищеводных вен при портальной гипертензии у больных с гепатитами, жировым гепатозом, фиброзом, циррозом печени. Непосредственными причинами болезни Меллори-Вейса являются:
- Рвота, неукротимая икота. У 80-85% пациентов развитие рвоты связано с алкогольным опьянением. Провоцирующими факторами также становятся рвота беременных, диспепсические расстройства при патологии пищеварительного тракта (язвенной болезни, панкреатите, холецистите), отравления, уремия.
- Длительный интенсивный кашель. В редких случаях разрывно-геморрагический синдром провоцируется острыми и хроническими респираторными заболеваниями. Линейное повреждение слизистой пищевода, верхних отделов желудка может осложнить коклюш, ОРВИ, хронический бронхит, бронхиальную астму.
- Ятрогенные воздействия. Повреждение стенки пищевода, желудка возможно при грубом выполнении эндоскопических манипуляций (гастроскопии, эзофагогастродуоденоскопии), введении желудочного зонда. Иногда разрывы слизистой возникают при проведении сердечно-легочной реанимации.
В спорадических случаях повышение давления, приводящее к разрыву эпителиального слоя, вызывается другими факторами — подъемом тяжестей, интенсивными физическими нагрузками с резким напряжением мышц брюшного пресса, тупой травмой живота. Крайне редко заболевание осложняет течение судорожного синдрома при эпилепсии, опухолях головного мозга, энцефалопатиях, менингите, энцефалите, эклампсии.
Патогенез
Пусковым моментом разрыва пищеводно-желудочной слизистой обычно становится многократная рвота, резкое повышение абдоминального давления при переполненном желудке или кардиоэзофагеальном спазме, реже — прямые механические воздействия. Возникновение избыточного давления в кардиальном отделе желудка способствует перерастяжению стенки органа. При морфологической несостоятельности эпителия, вызванной воспалительными процессами, растянутая слизистая желудка, пищевода разрывается в наиболее истонченном или патологически измененном участке. Обычно разрыв распространяется не глубже эпителиального и подслизистого слоя. В тяжелых случаях повреждается мышечная, серозная желудочная либо адвентициальная пищеводная оболочки с выходом агрессивного содержимого в средостение или брюшную полость.
Классификация
Систематизация клинических форм синдрома Меллори-Вейса основана на протяженности и глубине дефектов оболочек поврежденных органов, от размеров которых напрямую зависит тяжесть патологии. Разрывы бывают малыми (до 1 см) — наиболее частый вариант повреждения, выявляемый у 88-90% пациентов, средними (1-3 см), большими (более 3 см). С учетом глубины деструкции стенки пораженного отдела ЖКТ специалисты в сфере гастроэнтерологии и общей хирургии различают 4 стадии гастроэзофагеального разрывного синдрома:
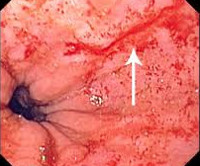
- I стадия. Повреждение слизистой желудочно-пищеводного перехода и дистальной трети пищевода. Встречается у 36-37% пациентов. В большинстве случаев кровотечение прекращается спонтанно.
- II стадия. Дефекты расположены в той же зоне, однако их глубина достигает подслизистого слоя. Выявляется у 52-53% больных. Обычно проводится консервативная гемостатическая терапия.
- III стадия. Глубокие зияющие разрывы с вовлечением мышечной оболочки и интенсивным кровотечением. Наблюдаются в 9-11% случаев. Необходим эндоскопический или хирургический гемостаз.
- IV стадия. Редко диагностируемое тяжелое повреждение с разрушением всех оболочек гастроэзофагеального участка ЖКТ. Осложняется медиастинитом, перитонитом, пневмотораксом.
Симптомы синдрома Меллори-Вейса
Клинические проявления заболевания обычно развиваются на фоне многократной рвоты. Основным признаком синдрома является выделение ярко-красной крови с рвотными массами (гематемезис), которое может иметь различную интенсивность – от нескольких капель до профузного кровотечения. Возникает резкая боль в эпигастральной области или за грудиной. Вследствие кровопотери у больного формируется острый анемический синдром, для которого характерны головокружение, бледность кожных покровов, мелькание «мушек» перед глазами, падение артериального давления, значительное учащение сердцебиения. При массивном кровотечении возможна потеря сознания.
Осложнения
Острая кровопотеря при симптомокомплексе Меллори-Вейса может привести к развитию геморрагического шока с тяжелыми нарушениями микроциркуляции, изменениями реологических свойств крови, прогрессирующей гипоксией. При отсутствии лечения шок переходит в декомпенсированную стадию, сопровождающуюся полиорганной недостаточностью. Наиболее тяжелым осложнением синдрома является тотальный разрыв стенки брюшного отдела пищевода, распространяющийся выше уровня диафрагмы. При этом у пациента возникает приступ одышки, цианоз кожи, сильнейшие боли в грудной клетке. Такое осложнение, известное как синдром Бурхаве, в 20-40% случаев заканчивается летальным исходом. Попадание содержимого желудка в средостение, полость брюшины провоцирует развитие медиастинита, перитонита.
Диагностика
Постановка диагноза при синдроме Мэллори-Вейса может быть затруднена, что обусловлено стремительным нарастанием клинической картины и необходимостью оказания пациенту экстренной медицинской помощи. Диагностика заболевания предполагает комплексное инструментальное обследование пищеварительного тракта для выявления первопричины кровавой рвоты. Наиболее информативными являются:
- Эзофагогастроскопия. Введение гибкого эндоскопа через ротовую полость позволяет оценить состояние эпителиальной оболочки верхних отделов ЖКТ и обнаружить линейные разрывы, которые обычно локализованы в области перехода пищевода в желудок. С помощью визуального осмотра удается установить глубину поражения стенки пищевода или желудка.
- Обзорная рентгенография брюшной полости. Проведение рентгенологического исследования информативно при подозрении на разрыв полого органа. Основной признак перфорации – наличие свободного газа в полости брюшины (симптом «серпа»). На рентгенограмме также можно обнаружить другие болезни ЖКТ, которые являются первопричиной патологии Меллори-Вейса.
В клиническом анализе крови определяются изменения, характерные для анемического синдрома — уменьшения содержания эритроцитов и гемоглобина, снижение показателя гематокрита. Для исключения хронического кишечного кровотечения проводится реакция Грегерсена, позволяющая обнаружить скрытую кровь в кале. При выраженном диспепсическом синдроме может выполняться бактериологический посев кала для выявления патогенных микроорганизмов.
Дифференциальная диагностика синдрома осуществляется с легочным кровотечением, отеком легких, сердечной астмой, кровотечением из язвы желудка, варикозным расширением пищеводных вен, острым гастроэнтеритом, кишечными инфекциями, распадом опухоли желудка или пищевода, синдромом Рандю-Ослера. Кроме осмотра хирурга и гастроэнтеролога пациенту могут потребоваться консультации гематолога, инфекциониста, пульмонолога, кардиолога, гематолога, гепатолога.
Лечение синдрома Меллори-Вейса
Пациент подлежит неотложной госпитализации в хирургический стационар. На начальном этапе больному обеспечивается покой, холод на область желудка, при позывах на рвоту применяются блокаторы дофаминовых и серотониновых рецепторов с противорвотным эффектом. Назначается консервативное лечение и малоинвазивные манипуляции, направленные на остановку кровотечения, восполнение объема циркулирующей крови. При резком падении АД терапию дополняют введением средств для поддержания гемодинамики. Пациентам с болезнью Меллори-Вейса показаны:
- Инфузионная терапия. При умеренной кровопотере проводятся внутривенные вливания коллоидных и кристаллоидных растворов. При массивном кровотечении переливается эритроцитарная масса или взвесь, нативная и свежезамороженная плазма, реже — донорская кровь.
- Гемостатические препараты. Для медикаментозного гемостаза используют стимуляторы свертывающей системы крови. Эффективность кровоостанавливающей терапии повышается при парентеральном введении препаратов кальция, синтетических аналогов витамина К.
- Эндоскопический гемостаз. При продолжающемся кровотечении с помощью эндоскопа обкалывают место повреждения средствами с сосудосуживающим эффектом, вводят склерозанты, лигируют или клипируют сосуды. Возможно выполнение аргоноплазменной или электрокоагуляции.
- Терапевтическая эмболизация. Для прекращения кровотечения из поврежденных сосудов в них под контролем ангиографии вводят смесь эмболов с физиологическим раствором. Альтернативным методом является редко применяемое внутриартериальное вливание жировых суспензий.
Баллонная зондовая тампонада используется ограниченно из-за возможного усугубления разрывов. Важным условием быстрого восстановления поврежденной стенки является угнетение желудочной секреции при помощи ингибиторов протонной помпы, блокаторов Н2-гистаминорецепторов. Прием секретолитиков дополняют назначением невсасывающихся антацидов, препаратов коллоидного висмута. Хирургические методы лечения геморрагического разрывного синдрома показаны при неостанавливающихся или рецидивирующих кровотечениях, глубоких дефектах, полном разрыве пищеводной или желудочной стенки. Рекомендованным вмешательством является гастротомия с прошиванием надрывов, кровоточащих сосудов, ушиванием дефектов, иногда — перевязкой левой желудочной артерии.
Прогноз и профилактика
Исход патологического состояния зависит от величины кровопотери и тяжести основного заболевания пациента. В 90% случаев кровотечение останавливается самопроизвольно или консервативными способами. Прогноз синдрома относительно неблагоприятный при потере больше 10% ОЦК и наличии сопутствующей патологии. Меры профилактики при заболевании Меллори-Вейса заключаются в отказе от злоупотребления алкоголем, своевременном устранении провоцирующих факторов, выявлении и лечении болезней желудочно-кишечного тракта, соблюдении техники проведения инвазивных медицинских манипуляций на пищеводе, желудке.
Источник