- СОП и стеллажки
- СОПпоненты
- Не ждите шаблонов сверху
- Что вызывает обеспокоенность
- Настроить шаблон стеллажных карт в аптеке
- Какой приказ регламентирует наличие стеллажных карт в подразделениях ЛПУ?
- Минздрав разъясняет: правила хранения ЛС
- Нормы рубят — щепки летят
- Свод действующих нормативно-правовых актов
- Два приказа о правилах хранения лекарственных препаратов
- Приказ № 706н по‑прежнему актуален
- Какая польза от разъяснений регуляторов?
- Срок хранения журнала
- Вопрос о стеллажных картах
СОП и стеллажки
Самвел Григорян продолжает освещать тему изменений в надлежащие практики: что такое стеллажная карта для медикаментов и нужна ли она в аптеке
Мы уже писали на тему готовящихся и желательных изменений в Надлежащую аптечную практику (приказ Минздрава РФ от 31.08.2016 от № 647н), но многое осталось за рамками того обсуждения. Например, проблема стандартных операционных процедур (СОП). Или еще одна отраслевая дискуссия — вопрос ведения стеллажных карт в современных условиях, что предписывает действующая редакция НПХиП, то есть Надлежащей практики хранения и перевозки лекарственных препаратов (приказ Минздрава РФ от 31.08.2016 от № 646н).
СОПпоненты
Судя по откликам с мест, СОП – одна из самых значимых проблем, порожденных вступлением в силу надлежащих практик. Точки зрения по этой проблеме образовали три лагеря. Представители первого считают, что СОПы не нужны вообще – это напрасная затея, нагружающая аптекарей излишней писаниной. С их точки зрения, алгоритмы рабочих действий могут успешно вырабатываться у профессионалов без всяких СОП-схем.
Представители второй точки зрения рассуждают следующим образом. СОПы, может быть, и нужны, но писать их должны не аптекари. Ведь стандартная операционная процедура – это стандарт, то есть единая для всех типовая форма. Значит, было бы логично, чтобы регулятор или аптечные ассоциации сами написали бы эти типовые СОПы и предложили их аптекам, а те, в свою очередь, адаптировали бы эти стандарты к реалиям своей организации, добавив в них что-то от своего рабочего порядка (в рамках законодательства, разумеется). Получился бы, кстати, прекрасный пример гармоничного взаимодополнения регуляторного и локального нормотворчества.
Не ждите шаблонов сверху
Третий взгляд на проблему излагает Елена Неволина, исполнительный директор Некоммерческого партнерства «Аптечная гильдия» и Союза «Национальная Фармацевтическая Палата», которая является одним из разработчиков надлежащих практик. Соглашаясь с тем, что в аббревиатуре СОП «стандарт» является ключевым словом, она подчеркивает: «В данном случае имеется в виду не типовой образец для всех, а стандарт деятельности конкретной организации».
Представим себе, продолжает Елена Неволина, что стандартная процедура спущена аптекам сверху… а руководитель аптечной организации при этом распределил у себя действия и обязанности работников другим образом. В таком случае ему – чтобы перейти на спущенные сверху стандарты – надо полностью менять установившийся порядок работы, адаптировать свою деятельность под спущенный сверху шаблон.
«Мы же говорим: менять ничего не надо, – продолжает Елена Неволина. – Просто сначала опишите так, как есть, как у вас в организации делается. Или, еще лучше, изложите это в виде схемы. Желательно кратко, не более полутора страниц по каждой процедуре, потому что больший объем труден для восприятия».
По мнению Елены Неволиной, смысл СОП, да и всей системы качества, состоит в том, чтобы описать конкретную процедуру, посмотреть, как она работает, а затем искать пути ее совершенствования. А ожидание шаблонов сверху Елена Неволина расценивает в данном случае как проявление инертного патерналистского мышления, от которого мы никак не можем освободиться.
Что вызывает обеспокоенность
Что ж, логика в этих аргументах есть. Тем не менее, приняв эти аргументы, хочется изложить, так сказать, основные «но», которые имеются у аптекарей.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Источник
Настроить шаблон стеллажных карт в аптеке
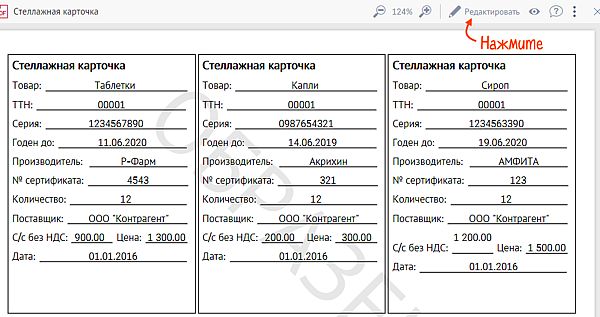
В соответствии с Приказом Минздравсоцразвития России 706н на все лекарства в аптеке должны быть созданы стеллажные карты, которые содержат наименование, форму выпуска и дозировку, номер серии, срок годности, а также производителя.
В СБИС уже есть готовый шаблон стеллажной карты. Вы можете изменить его, например, добавить дополнительные поля или отредактировать внешний вид.
В разделе «Бизнес/Закупки/Расходы»
Нажмите . В блоке «Печатные формы документа» выберите «Стеллажная карточка».
На главной странице на online.sbis.ru
- На главной странице нажмите «Конфигурация», перейдите во вкладку «Печатные формы».
Из документа поступления
Изменить шаблон карточки можно прямо из документа поступления непосредственно перед печатью.
- В разделе «Бизнес/Закупки/Расходы» откройте документ поступления.
Источник
Какой приказ регламентирует наличие стеллажных карт в подразделениях ЛПУ?
Здравствуйте! Должны ли на медицинских постах и в процедурных кабинетах находится стеллажные карты на лекарственные средства?
Где должны находится стеллажные карты на лек средства и изделия мед назначения в больнице? Если на медицинских постах и процедурных кабинетах суточный запас, нужны ли там стеллажные карты? Спасибо Людмила
Здравствуйте, Людмила! В соответствии с п. 10 Приказа Минздравсоцразвития РФ от 23.08.2010 N 706н «Об утверждении Правил хранения лекарственных средств»
10. Стеллажи (шкафы) для хранения лекарственных средств в помещениях для хранения лекарственных средств должны быть установлены таким образом, чтобы обеспечить доступ к лекарственным средствам, свободный проход персонала и, при необходимости, погрузочных устройств, а также доступность стеллажей, стен, пола для уборки.
Стеллажи, шкафы, полки, предназначенные для хранения лекарственных средств, должны быть идентифицированы.
Хранящиеся лекарственные средства должны быть также идентифицированы с помощью стеллажной карты, содержащей информацию о хранящемся лекарственном средстве (наименование, форма выпуска и дозировка, номер серии, срок годности, производитель лекарственного средства). При использовании компьютерных технологий допускается идентификация при помощи кодов и электронных устройств.
Хотя в законе конкретно не указано, где именно требуется хранить стеллажные карты, можно предположить, что они должны храниться в непосредственной, беспрепятственной близости. Очевидно, что смысл создания стеллажных карт и состоит в скором определении основных свойств того или иного препарата.
Кроме того согласно Информационному письму Минздравсоцразвития РФ от 08.02.2011 N 25-1/10/2-1208
Пункт 10 Правил определяет необходимость идентификации хранящихся лекарственных средств (независимо от места их хранения) либо с помощью стеллажной карты, либо, при использовании компьютерных технологий, — при помощи кодов и электронных устройств. Особенности кодировки определяются компьютерной программой, используемой организацией (индивидуальным предпринимателем).
К вопросу должны ли находится стеллажные карты сообщаю, что вышеупомянутые Правила распространяются на производителей лекарственных средств; организации оптовой торговли лекарственными средствами; аптечные организации (аптеки, аптечные пункты, аптечные киоски); медицинские и иные организации, осуществляющие деятельность при обращении лекарственных средств; индивидуальных предпринимателей, имеющих лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность.
Если правила распространяются на медицинскую организацию в целом, то это не исключает их применение в процедурных кабинетах и на медицинских постах. Скорее всего, более подробно данный вопрос может регулироваться локальным нормативный актом, т.е приказом руководителя (главного врача) ЛПУ.
Источник
Минздрав разъясняет: правила хранения ЛС
Официальные пояснения министерства в связи с разночтениями в двух действующих приказах об утверждении правил хранения лекарственных средств — температурный режим и стеллажные карты
«Регуляторная гильотина», отсекающая устаревшие нормы и содержащие их нормативно-правовые акты, рубит размашисто. Её реализации посвящена статья 15 недавно вступившего в силу Федерального закона от 31.07.2020 г. № 247‑ФЗ «Об обязательных требованиях [далее ОТ] в РФ». Такой масштабный процесс не бывает беспроблемным; он порождает множество вопросов. Участники отрасли направляют их в виде запросов регуляторам, от которых, в свою очередь, поступают разъяснения. В этой статье мы рассмотрим недавние разъяснения регулятора по одному из запросов на тему условий хранения лекарственных препаратов. Редакция выражает благодарность исполнительному директору Союза «Национальная фармацевтическая палата» Елене Неволиной, поделившейся этой полезной информацией с коллегами.
Нормы рубят — щепки летят
За несколько последних десятилетий фармацевтическое законодательство превратилось в такой ворох норм, законов, приказов и постановлений, что было бы долго и хлопотно отменять их один за другим. Поэтому приходится рубить всё разом. Взмах «регуляторной гильотины», который произошёл 1 января 2021 г., согласно части 1 статьи 15 Закона «Об ОТ», отсёк:
1) акты периода СССР и РСФСР;
2) нормативно-правовые акты Правительства РФ и федеральных органов исполнительной власти (например, приказы Минздрава), содержащие ОТ, соблюдение которых оценивается при осуществлении государственного контроля.
Отметим, что на акты, принятые парламентом — то есть, федеральные законы — «регуляторная гильотина» не распространяется.
Ещё одна важная мера, осуществлённая в рамках «гильотины», определена частями 2 и 3 той же статьи 15. Из них следует, что если акт вступил в силу до 1 января 2020 г., то оценка соблюдения его ОТ проверяющими не допускается, а их несоблюдение не может быть основанием для привлечения к административной ответственности.
Звучит радикально, но часть 4 статьи 15 умеряет ощущение полной свободы. Она гласит, что Правительству дано право утвердить перечень нормативно-правовых актов, в отношении которых положения частей 1, 2 и 3 статьи 15 не применяются. Иными словами, этот перечень исключений представляет собой список тех приказов и постановлений (разумеется, с содержащимися в них нормами), которые сохранили силу после 1 января 2020 г.
Свод действующих нормативно-правовых актов
Этот список утверждён Постановлением Правительства РФ от 31.12.2020 г. № 2467. Он упорядочен по видам контроля (надзора), а также в нём отдельно представлены постановления Правительства и приказы министерств.
Нормативно-правовые акты, имеющие прямое отношение к фармотрасли, перечислены в разделах «Федеральный государственный надзор в сфере обращения лекарственных средств» (9 постановлений, 11 приказов), «Лицензионный контроль в сфере фармацевтической деятельности» (2 постановления, 2 приказа) и «Лицензионный контроль за деятельностью по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений» (19 постановлений, 7 приказов). Не считая законов, это и есть базовый свод отраслевых нормативно-правовых актов. Разумеется, к нему следует добавить те постановления и приказы, которые были утверждены в 2020–2021 гг.
Два приказа о правилах хранения лекарственных препаратов
В этом своде есть два нормативно-правовых акта, регулирующих правила хранения лекарств. Первый из них — Приказ Минздравсоцразвития РФ от 23.08.2010 г. № 706н «Об утверждении Правил хранения лекарственных средств», а второй — Приказ Минздрава РФ от 31.08 2016 г. № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов (НПХиП) для медицинского применения».
Как видим, «гильотина» не отсекла один из них; а там, где порядок хранения лекарственных средств регулируют два нормативно-правовых акта, не исключены противоречия между их нормами. Елена Неволина направила в Минздрав РФ запрос с просьбой дать разъяснения по вопросу применения норм приказов, устанавливающих правила хранения лекарственных средств. Он включал три вопроса.
Приказ № 706н по‑прежнему актуален
В запросе указано, что сферы действия Приказа № 706н и Приказа № 646н не совсем совпадают. Это несовпадение вытекает даже из их названий: в одном фигурирует определение «лекарственные средства», а в другом — «лекарственные препараты», что не одно и то же, поскольку первое понятие шире. Согласно Закону «Об обращении лекарственных средств» (от 12.04.2010 г. № 61‑ФЗ), к лекарственным средствам относятся фармсубстанции и лекарственные препараты.
Следовательно, сфера применения Приказа № 706н шире, а Правила НПХиП не распространяются на фармсубстанции. Елена Неволина напоминает в связи с этим о частях 2 и 3 статьи 7 Закона «Об ОТ», согласно которым не должно быть дублирования ОТ, а тем более — противоречий между ними.
Таким образом, первый вопрос запроса был сформулирован так: распространяются ли нормы Приказа № 706н на хранение лекарственных препаратов и фармсубстанций, или только на хранение фармсубстанций?
Подоплёка вопроса понятна — необходимо было прояснить, должны ли теперь, после вступления в силу Закона «Об ОТ», аптечные организации, фармпроизводители и дистрибьюторы в части хранения лекарственных препаратов исполнять нормы только Приказа № 646н (НПХиП) или также Приказа № 706?
Разъяснение Елены Астапенко, директора Департамента лекарственного обеспечения и регулирования обращения медицинских изделий (ДЛОРОМИ) Минздрава РФ в ответ на этот вопрос, сводится к следующему:
Нормы Приказа № 706 распространяются на лекарственные препараты, и фарморганизации обязаны их соблюдать — так же, как и положения НПХиП.
Какая польза от разъяснений регуляторов?
Прежде, чем перейти ко второму вопросу запроса, поясним, почему ответы представителя регулятора на официальные запросы так важны. В Законе «Об ОТ» имеется статья 14, озаглавленная «Официальные разъяснения обязательных требований». Согласно части 1 этой статьи, федеральные органы исполнительной власти — например, Росздравнадзор, Минздрав, Минпромторг, Минэкономразвития и др. — обязаны давать в отношении принятых ими НПА официальные разъяснения.
Наши отраслевые профессиональные ассоциации делали запросы и раньше. Но ответами, которые они получали, защититься от проверяющих не получалось, потому что фактически они имели статус мнения представителя департамента того или иного ведомства. Но 1 ноября заработала норма части 3 статьи 14 Закона «Об ОТ», согласно которой действия работников контролируемых структур, осуществляемые в соответствии с официальными разъяснениями обязательных требований, не могут квалифицироваться как их нарушение.
Соответственно, значение запросов и официальных ответов значительно возросло. Теперь проверяемому достаточно продемонстрировать, что он действовал в точном соответствии с полученными разъяснениями, предъявить их контролёрам, и привлечение его к административной ответственности будет незаконно. Ну а раз значение запросов и разъяснений регуляторов возросло, то следует уделять им больше внимания. Ведь фактически теперь они стали частью отраслевой нормативной системы.
Срок хранения журнала
Сопоставим два приказа, касающихся норм измерения результатов температурного картирования и показаний гигрометра (режима влажности) в аптеке, которые регистрируются в специальном журнале.
| Приказ № 706 (Правила хранения ЛС) Нормы пункта 7 Раздела III «Общие требования к помещениям для хранения ЛС и организации их хранения» | ||||
| 7. Помещения для хранения ЛС должны быть оснащены приборами для регистрации параметров воздуха (термометрами, гигрометрами (электронными гигрометрами) или психрометрами)… Показания этих приборов должны ежедневно регистрироваться в специальном журнале (карте) регистрации на бумажном носителе или в электронном виде с архивацией (для электронных гигрометров), который ведется ответственным лицом. Журнал (карта) регистрации хранится в течение одного года, не считая текущего. Контролирующие приборы должны быть сертифицированы, калиброваны и подвергаться поверке в установленном порядке. |
| Приказ № 706 (Правила хранения ЛС) Норма пункта 10 Раздела III | Приказ № 646н (Правила НПХиП) Норма пункта 29 Раздела IV |
| Хранящиеся ЛС должны быть также идентифицированы с помощью стеллажной карты, содержащей информацию о хранящемся ЛС (наименование, форма выпуска и дозировка, номер серии, срок годности, производитель ЛС). При использовании компьютерных технологий допускается идентификация при кодов и электронных устройств. | Стеллажи (шкафы) для хранения лекарственных препаратов должны быть маркированы, иметь стеллажные карты, находящиеся в видимой зоне, обеспечивать идентификацию лекарственных препаратов в соответствии с применяемой субъектом обращения лекарственных препаратов системой учета. Допускается применение электронной системы обработки данных вместо стеллажных карт. При использовании электронной системы обработки данных допускается идентификация при помощи кодов. |
Из разъяснений Елены Астапенко по этому вопросу следует, что именно Правила хранения ЛС (Приказ № 706н) являются тем нормативным документом, который регулирует содержание стеллажных карт. Нормой его пункта 10 и нужно руководствоваться при их оформлении. Что касается пункта 29 Правил НПХиП (Приказ № 646н), то в нём стеллажные карты упоминаются в ином контексте, не относящемся к правилам их оформления.
Следовательно, не стоит расслабляться, уповая на Приказ № 646н. Информация на стеллажной карте по‑прежнему должна содержать наименование, форму выпуска и дозировку, номер серии, срок годности, и указание на производителя лекарственного средства.
Несмотря на решительные взмахи «регуляторной гильотины», неясных тем и «тёмных пятен» в отраслевом законодательстве ещё осталось немало. Так что мы с нетерпением ждём от регуляторов новых официальных разъяснений.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Источник