- С 1 октября заработает система электронных сертификатов для людей с инвалидностью и иных категорий граждан
- Льготные лекарства и как их получить
- Сертификат GMP: подтверждение качества лекарственных средств
- К каким производствам применима эта процедура?
- Нормативная база
- Преимущества обладания сертификатом
- Стандарт GMP в международной практике
- Правила GMP в России
- Процедура получения сертификата в России
- Документы для сертификации
- Сроки сертификации
- Стоимость получения сертификата
С 1 октября заработает система электронных сертификатов для людей с инвалидностью и иных категорий граждан
 |
| Yaruta / Depositphotos.com |
Председатель Правительства РФ Михаил Мишустин утвердил положение о государственной информационной системе (далее – ГИС), которая будет содержать всю информацию о средствах реабилитации для льготной категории граждан и обеспечит им возможность купить такие средства посредством электронного сертификата.
Право на использование электронного сертификата будут иметь лица, указанные в ст. 3 Федерального закона от 30 декабря 2020 года № 491-ФЗ «О приобретении отдельных видов товаров, работ, услуг с использованием электронного сертификата» следующие категории граждан:
- инвалиды войны и участники ВОВ;
- ветераны боевых действий из числа лиц, указанных в подп. 1 — 4 п. 1 ст. 3 Федерального закона от 12 января 1995 года № 5-ФЗ «О ветеранах»;
- военнослужащие, проходившие военную службу в период с 22 июня 1941 года по 3 сентября 1945 года не менее шести месяцев или военнослужащие, награжденные орденами или медалями СССР за службу в указанный период;
- лица, награжденные знаком «Жителю блокадного Ленинграда» или «Житель осажденного Севастополя»;
- лица, работавшие в период ВОВ на объектах противовоздушной обороны, местной противовоздушной обороны, строительстве оборонительных сооружений, военно-морских баз, аэродромов и других военных объектов в пределах тыловых границ действующих фронтов, операционных зон действующих флотов, на прифронтовых участках железных и автомобильных дорог, а также члены экипажей судов транспортного флота, интернированных в начале ВОВ в портах других государств;
- члены семей погибших (умерших) инвалидов войны, участников ВОВ и ветеранов боевых действий, члены семей погибших в ВОВ лиц из числа личного состава групп самозащиты объектовых и аварийных команд местной противовоздушной обороны, а также члены семей погибших работников госпиталей и больниц города Ленинграда;
- инвалиды;
- дети-инвалиды;
- лица, подлежащие обязательному социальному страхованию от несчастных случаев на производстве и профессиональных заболеваний, в случае возникновения права на получение мер поддержки при наступлении страхового случая в соответствии с Федеральным законом от 24 июля 1998 года № 125-ФЗ «Об обязательном социальном страховании от несчастных случаев на производстве и профессиональных заболеваний»;
- лица, подвергшиеся воздействию радиации вследствие катастрофы на Чернобыльской АЭС, а также вследствие ядерных испытаний на Семипалатинском полигоне, и приравненные к ним категории граждан.
В ГИС у каждого гражданина, нуждающегося в средствах реабилитации, будет цифровая запись об этом. Такой сертификат привяжут к карте «Мир», на которую будут зачисляться денежные средства.
Полученную госпомощь гражданин сможет потратить на средства реабилитации из предложенного на сайте ГИС списка магазинов.
Также Правительство РФ сформировало и утвердило перечень товаров, работ и услуг, которые будут содержаться в ГИС и их можно будет получать по электронному сертификату (Постановление Правительства РФ от 23 апреля 2021 года № 631 «О формировании и утверждении перечней отдельных видов товаров, работ, услуг, приобретаемых с использованием электронного сертификата за счет бюджетов бюджетной системы Российской Федерации»). Ответственными за федеральный сегмент будут Минздрав России и Минтруд России, за региональный – местные власти.
В дальнейшем, уточняется сообщением, систему электронных сертификатов планируют распространить на лекарства, медицинские изделия, а также лечебное питание. Это позволит упростить и ускорить процесс получения социальной поддержки.
По желанию граждан, они смогут отказаться от сертификата и приобретать средства реабилитации как и раньше – забирать их в территориальном отделении ФСС России или покупать самостоятельно. В этом случае им будет положена компенсация в размере затраченных средств.
Также сообщается, что ГИС будет взаимосвязана с Единой государственной информационной системой социального обеспечения (далее – ЕГИССО) и порталом госуслуг.
Источник
Льготные лекарства и как их получить
Для льготных категорий граждан увеличена сумма, на которую они могут получать бесплатные лекарства, медицинские изделия и лечебное питание. Постановление об этом подписал Председатель Правительства Михаил Мишустин. Теперь государство будет выделять на одного льготника 886,4 рубля в месяц. Это увеличит бюджетные расходы на социальную помощь более чем на 988 млн рублей в 2020 году. На бесплатные лекарства и медицинские изделия имеют право более 20 категорий льготников.
Какие лекарства считаются льготными?
Правительство РФ ежегодно составляет список льготных лекарств — «Перечень лекарственных препаратов для медицинского применения». Вот он на 2020 год. Бесплатно или со скидкой можно получать препараты только из этого списка и только людям льготных категорий.
Кто имеет право на льготные лекарства?
Льготными категориями считаются:
- Федеральные льготники — получатели набора социальных услуг, не выбравшие получение лекарств в денежном эквиваленте, а также герои Советского Союза, герои Российской Федерации и полные кавалеры ордена Славы, а в случае их смерти — члены их семей, и герои Социалистического Труда, герои Труда Российской Федерации и полные кавалеры ордена Трудовой славы, если они отказались от ежемесячной денежной выплаты (ЕДВ). Они могут получать все лекарства из перечня бесплатно.
- Люди с некоторыми заболеваниями или состояниями. В зависимости от заболевания они могут получать бесплатно либо все препараты из перечня, либо только те, которые необходимы для лечения их заболевания, либо только те, которые лечат симптомы их заболевания или состояния.
Полный перечень категорий граждан, которые имеют право на получение бесплатных лекарств, содержится в приложении 1 к постановлению Правительства РФ от 30.07.1994 № 890.
Льготы есть только на лекарства или на что‑то еще?
Льготы касаются не только лекарств. Например, для детей с редкими заболеваниями помимо лекарств доступны продукты лечебного питания.
Как человек может получить эти льготы?
Лекарство можно получить только по рецепту врача. Обращаться нужно в те медицинские организации (городские больницы, поликлиники, диспансеры), в которых врачи имеют право выписывать льготные рецепты.
Лекарства, медицинские изделия, специализированные продукты лечебного питания (для детей-инвалидов) отпускаются только из специальных аптечных пунктов в медицинских организациях и из аптек в непосредственной близости от них.
Как сейчас сфера льготного обеспечения лекарствами регулируется законодательно?
Обеспечение россиян лекарственными препаратами осуществляется в рамках реализации следующих социальных гарантий:
- Государственная социальная помощь отдельным категориям граждан, предусмотренная Федеральным законом № 178-ФЗ «О государственной социальной помощи».
- Лекарственное обеспечение граждан, входящих в перечни групп населения и категорий заболеваний, при амбулаторном лечении которых лекарственные средства и изделия медицинского назначения отпускаются по рецептам врачей бесплатно или с 50-процентной скидкой, осуществляемое в соответствии с постановлением Правительства Российской Федерации от 30 июля 1994 года № 890.
- Обеспечение лекарствами лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей в соответствии с Федеральным законом № 323-ФЗ.
- Обеспечение лекарственными препаратами для лечения отдельных социально значимых заболеваний (ВИЧ, туберкулез) также в соответствии с Федеральным законом № 323-ФЗ.
- Реализация государственной политики в области иммунопрофилактики, предусмотренной Федеральным законом № 157-ФЗ «Об иммунопрофилактике инфекционных заболеваний»
- Обеспечение лекарственными препаратами для лечения заболеваний, включенных в перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности, в соответствии с Федеральным законом № 323-ФЗ.
Перечень категорий граждан, имеющих право на льготное лекарственное обеспечение за счет средств федбюджета, определен Федеральным законом №178-ФЗ и Приказом Минздравсоцразвития России № 328.
Федеральным законом от 13 июля 2020 года № 206-ФЗ предусмотрено создание Федерального регистра граждан, имеющих право на обеспечение лекарственными препаратами, медицинскими изделиями и специализированными продуктами лечебного питания за счет средств федбюджета и бюджетов субъектов РФ.
С 2021 года все льготники независимо от уровня льготы будут получать льготные лекарства в объеме не менее чем это предусмотрено перечнем жизненно необходимых и важнейших лекарственных препаратов.
Над чем ГД работает сейчас в этом направлении, какие планы по совершенствованию льготного лекарственного обеспечения?
«Экспертный совет Комитета по охране здоровья по редким (орфанным) заболеваниям ведет работу по совершенствованию механизма обеспечения граждан лекарственными препаратами для лечения заболеваний, включенных в перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни гражданина или инвалидности», — сообщил Председатель Комитета Дмитрий Морозов
Морозов
Дмитрий Анатольевич Депутат Государственной Думы избран по избирательному округу 0209 (Черемушкинский – г.Москва) . Он отметил, что вопросы совершенствования лекарственного обеспечения граждан, в том числе льготных категорий, будут и в дальнейшем прорабатываться в рамках функционирования межфракционной рабочей группы по совершенствованию законодательства в сфере лекарственного обеспечения граждан и обращения лекарственных средств.
Также продолжится работа над проектом ФЗ, направленного на совершенствование правового регулирования оборота лекарственных средств и создание условий комплексного и стабильного обеспечения граждан России лекарственными препаратами.
Что делать, если в аптеке говорят, что льготного лекарства нет?
В случае временного отсутствия лекарственных препаратов, необходимых гражданину, в соответствии с Приказом Минздравсоцразвития «Об утверждении порядка предоставления набора социальных услуг отдельным категориям граждан», аптечная организация организует в течение 10 рабочих дней с даты обращения его отсроченное обслуживание или осуществляет отпуск аналогичного лекарственного средства, предусмотренного Перечнем лекарственных средств, взамен выписанного или иного лекарственного средства по вновь выписанному рецепту.
Если за то время, когда препарата не было в наличии, истек срок действия рецепта, переоформлять его не нужно.
Если вам отказали в выписке рецепта или выдаче лекарства по нему, вы вправе также обратиться в Федеральную службу по надзору в сфере здравоохранения либо в суд.
Источник
Сертификат GMP: подтверждение качества лекарственных средств
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
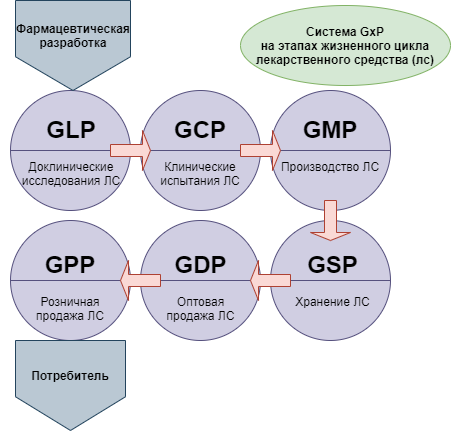
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
10 рабочих дней
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
160 рабочих дней
Принятие решения о выдаче заключения по результатам инспекционного отчета
10 рабочих дней
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Источник