- Система маркировки лекарственных препаратов
- Счетчик обращений граждан и организаций
- Система маркировки лекарственных препаратов
- Новости
- Электронные сервисы
- Маркировка лекарственных средств
- Что вы узнаете
- Закон о маркировке лекарств
- Сроки
- Участники маркировки лекарств
- Производители
- Дистрибьюторы
- Аптеки
- Медцентры
- Схема работы
- Код маркировки — что это и как выглядит?
- Штрафы
- Как зарегистрироваться в системе маркировки?
- Аптекам
- Что нужно для маркировки
- Как принимать
- Как продавать
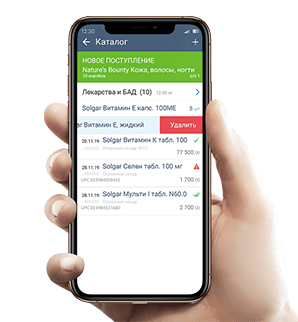
- Приложение на ваш смартфон
- 2D-cканер от 3 100 ₽
- Терминал сбора данных от 22 850 ₽
- Дистрибьюторам
- Стоматологиям и медцентрам
- Что нужно для маркировки
- Как принимать
- Как списывать
- Как получить регистратор выбытия?
- Система маркировки лекарственных препаратов
- Счетчик обращений граждан и организаций
- Система маркировки лекарственных препаратов
- Информационные письма
- Система маркировки лекарственных препаратов
- Счетчик обращений граждан и организаций
- Система маркировки лекарственных препаратов
- Об особенностях обращения лекарственных препаратов без средств идентификации
Система маркировки лекарственных препаратов
Счетчик обращений граждан и организаций
Система маркировки лекарственных препаратов
Новости
Электронные сервисы
Маркировка лекарственных препаратов
Пунктом 5 Перечня поручений Президента Российской Федерации по итогам совещания с членами Правительства Российской Федерации от 04.02.2015 дано поручение обеспечить разработку и поэтапное внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (кодификации) и идентификации упаковок лекарственных средств в целях обеспечения эффективного контроля качества ЛС, находящихся в обращении, и борьбы с их фальсификацией.
Основные цели маркировки и мониторинга движения лекарственных препаратов.
— профилактика поступления в оборот и одномоментное изъятие из оборота в автоматизированном режиме на всей территории Российской Федерации недоброкачественных, а также фальсифицированных и контрафактных лекарственных препаратов на любом из этапов их обращения от производителя до конечного потребителя;
— профилактика неэффективных расходов и экономия бюджетных средств за счет невозможности реализации схем «повторного вброса» лекарственных препаратов, невозможности легальной реализации лекарственных препаратов, подлежащих предметно-количественному учету, а также не предназначенных для розничной продажи;
— контроль адресности движения препаратов, закупаемых за счет бюджета, расходов на их приобретение; мониторинг ценообразования и предельных розничных цен на лекарственные препараты из списка ЖНВЛП;
— оперативное планирование и управление запасами и резервами препаратов на всех уровнях, включая стратегический.
— возможность с помощью персонального мобильного устройства лично проверить легальность приобретаемого (получаемого) лекарственного препарата.
— снижение издержек за счет более эффективного управления логистикой; уменьшение упущенной выгоды, обусловленной контрафактной и фальсифицированной продукцией; соответствие требованиям для поставок продукции на международные рынки.
Источник
Маркировка лекарственных средств
В 2020 году вводится обязательная маркировка лекарственных препаратов. Рассказываем, что нужно сделать и подключить и как работать дальше.
Нет времени разбираться? Поможем!
Что вы узнаете
Закон о маркировке лекарств
425-ФЗ от 28 декабря 2017 года вносит изменения в закон «Об обращении лекарственных средств». Он обязывает маркировать лекарства средствами идентификации, а участников оборота отчитываться в систему Мониторинга движения лекарственных препаратов (МДЛП) обо всех операциях с маркированными лекарствами.
Сроки
- С 1 июля 2019 началась регистрация участников оборота на Честныйзнак.рф.
- С 1 октября 2019 введена обязательная маркировка для лекарственных препаратов из списка высокозатратных нозологий.
- С 1 июля 2020 начнется обязательная маркировка всех выпускаемых лекарств и передача сведений по ним в систему маркировки.
Специалист ЦРПТ расскажет, как работать в системе «Честный знак» с 1 июля 2020, а эксперт СБИС покажет весь процесс от приемки до продажи в СБИС.
Участники маркировки лекарств
Производители
регистрируют произведенные лекарства, отчитываются о введении нового кода в оборот.
Дистрибьюторы
регистрируют получение препарата и передачу его далее по цепочке.
Аптеки
фиксируют прием препарата от дистрибьютора, продажу конечному клиенту на кассе.
Медцентры
отмечают поступление препарата от дистрибьютора, списания для оказания медуслуг.
Схема работы
Поставщики и ЦРПТ договорились о существовании обратной схемы маркировки – когда аптека передает коды дистрибьютору, а не наоборот.
1. Производитель получает коды в системе маркировки и размещает их на упаковках лекарств.
2. При отгрузке производитель отправляет дистрибьютору вместе с товаром список кодов с упаковок.
3. Дистрибьютор принимает товар как обычно и подтверждает получение кодов. Далее фасует товар и отправляет в аптеку.
4. Аптека при приемке сканирует коды с упаковок лекарств.
5. После отправляет коды в МДЛП поставщику для подтверждения.
6. При продаже провизор сканирует код маркировки на упаковке, оператор фискальных данных отправляет его в систему маркировки. Код выбывает из оборота.
Также поддерживается и прямой порядок, по которому поставщик отправляет поступление вместе с кодами, а аптека сверяет их и утверждает.
Код маркировки — что это и как выглядит?
Каждый препарат маркируют уникальным двумерным Data Matrix кодом, его наносят на упаковку с лекарством.
Общая длина ― 83 символа. В нем содержится:
- код товара: «01» + 14 символов GTIN ― международного кода маркировки
- индивидуальный серийный номер: «21» + 13 символов ― он генерируется оператором системы
- ключ проверки: «91» + 4 символа
- код проверки: «92» + 44 символа
Рекомендованный размер кода Data Matrix ― 16х16 мм. Но можно и меньшего размера ― ЦРПТ провел успешные тесты с марками 10х10 и 12х12 мм.
На большую транспортную тару (коробка, паллеты) наносят коды формата GS1 128. Такой код содержит данные обо всех упаковках внутри.
Штрафы
Незарегистрированные в МДЛП организации будут оштрафованы, сумму штрафа пока не определили. Нарушителей будут выявлять без выездных проверок, а просто при сопоставлении двух баз данных – лицензирования и регистрации в системе МДЛП.
Как зарегистрироваться в системе маркировки?
Для регистрации нужна усиленная квалифицированная электронная подпись на носителе Рутокен.
Установите необходимое ПО:
- операционная система Windows 7 / Mac OS X 10.8 или новее
- браузер Google Chrome, Mozilla Firefox, Opera, Internet Explorer 11, Safari
- плагин КриптоПро. Скачать
- сертифицированное СКЗИ
Если вы правильно настроили рабочее место ( см.пункт 1 ), система предложит ввести личные данные.
- Нажмите «Сертификат УКЭП» и выберите сертификат вашей электронной подписи.
- Автоматически заполнятся поля: «Субъект РФ», «Адрес электронной почты», «ИНН», «Имя» и «Фамилия».
- Заполните сведения о лицензии на медицинскую и фармацевтическую деятельность.
Аптекам
Что нужно для маркировки
Подключение к системе маркировки, чтобы отправлять туда коды.
Обновить прошивку онлайн-кассы, чтобы добавлять код маркировки в чек.
Подключение кассы к ОФД, которые умеют передавать чеки с кодами в систему маркировки.
Оборудование для сканирования марок на кассе и на складе.
Маркировка «под ключ»
Как принимать
При приемке нужно отсканировать все коды с упаковок лекарств и отправить их в систему маркировки и поставщику для подтверждения.
Если работаете в СБИС, то после сканирования вы просто нажмете кнопку «Отправить коды», и данные автоматически зарегистрируются в МДЛП и передадутся поставщику.
Как продавать
Продавать маркированные лекарства нужно через онлайн-кассу с ОФД: провизор сканирует код с упаковки, товар добавится в чек, а оператор фискальных данных отправит его в систему маркировки. Если марки нет – фармацевт сканирует штрихкод, и продает лекарство как раньше.
Приложение на ваш смартфон
Для небольших складов
Просто установите на него приложение СБИС Доки.
+ работает без привязки к компьютеру
+ сразу видно результаты проверки
— небольшая скорость сканирования
2D-cканер от 3 100 ₽
Для средних складов
+ высокая скорость сканирования
— работа только с компьютером
— ограниченная дальность действия
Терминал сбора данных от 22 850 ₽
Для больших складов
+ работает без привязки к компьютеру
+ высокая скорость сканирования
Дистрибьюторам
При обратном порядке акцептования дистрибьютору нужно только подтвердить коды, полученные от аптеки. Если вы работаете в СБИС, то вам даже этого делать не нужно. Сервис сам получит коды от аптек, автоматически подтвердит их и отправит в МДЛП – вы будете оформлять документы, как обычно.
Подключим к системе маркировки
Стоматологиям и медцентрам
Что нужно для маркировки
Подключение к системе маркировки, чтобы отправлять туда коды.
2D-сканер для проверки марок и приемки лекарств от поставщика.
Регистратор выбытия — устройство, фиксирующее выбытие маркированного лекарства из оборота при выдаче пациенту.
Как принимать
Маркировка лекарств в стоматологии, больнице и медицинском центре с точки зрения приемки ничем не отличается от аптек — сканируем коды с упаковок лекарств, передаем данные в МДЛП и поставщику.
Как списывать
Медицинские учреждения, которые используют препараты для оказания медицинских услуг, списывают лекарства с помощью регистратора выбытия. Перед вскрытием упаковки сканируем код с упаковки, и данные отправятся в МДЛП.
Как получить регистратор выбытия?
Регистратор получают бесплатно в ЦРПТ. Для этого в личном кабинете Честного знака необходимо оформить заявку и договор по инструкции. Наши специалисты могут помочь оформить необходимые документы — звоните.
Источник
Система маркировки лекарственных препаратов
Счетчик обращений граждан и организаций
Система маркировки лекарственных препаратов
Информационные письма
Информационное письмо Росздравнадзора от 24.12.2020 № 01И-2442/20
О необходимости оперативного внесения сведений о вакцине ГамКОВИД-Вак в систему маркировки
Информационное письмо от 02.12.2020 № 02И-2251/20
О проведении совещания
Информационное письмо от 30.10.2020 № 01И-2064/20
О работе в системе ФГИС МДЛП
Информационное письмо от 23.10.2020 № 01И-2007/20
О работе в системе ФГИС МДЛП
Информационное письмо от 27.08.2020 № 01И-1665/20
О проведении совещания
Информационное письмо от 27.08.2020 № 01И-1665/20
О проведении совещания 01.09.2020 в 11:00 по текущему статусу внедрения обязательной маркировки лекарственных препаратов производителями лекарственных средств
Информационное письмо от 19.05.2020 № 01И-939/20
О проведении тестирования ФГИС МДЛП
Информационное письмо от 28.04.2020 № 01И-750/20
О проведении совещаний в период с 12 мая по 9 июня 2020 г. в режиме видеоконференцсвязи с организациями, осуществляющими фармацевтическую и медицинскую деятельность в целях подготовки к в.
Информационное письмо от 30.03.2020 № 02И-544/20
О работе с ФГИС МДЛП
Информационное письмо от 11.02.2020 № 02И-274/20
О внесении изменений в постановление Правительства Российской Федерации от 14.12.2018 № 1556
Информационное письмо от 25.05.2018 № 04И-1304/18
О проведении обучения центров компетенций из числа лечебных учреждений
Информационное письмо от 25.05.2018 № 04И-1303/18
О проведении обучения центров компетенций из числа аптечных организаций
Источник
Система маркировки лекарственных препаратов
Счетчик обращений граждан и организаций
Система маркировки лекарственных препаратов
Об особенностях обращения лекарственных препаратов без средств идентификации
В соответствии с частью 7.1 статьи 67 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» Правительство Российской Федерации вправе установить особенности ввода в гражданский оборот лекарственных препаратов для медицинского применения, произведенных в период с 1 июля 2020 года по 1 октября 2020 года. В целях ввода в гражданский оборот лекарственные препараты для медицинского применения, за исключением лекарственных препаратов, предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей, произведенные за пределами территории Российской Федерации до 1 октября 2020 года, могут быть ввезены в Российскую Федерацию до 1 января 2021 года в порядке, установленном Правительством Российской Федерации, без нанесения средств идентификации.
Обращаем внимание, что срок действия постановления Правительства Российской Федерации от 30.06.2020 № 955 «Об особенностях ввода в гражданский оборот лекарственных препаратов для медицинского применения» (далее – Постановление) установлен до 1 января 2021 года.
В соответствии с пунктом 2 Положения об особенностях ввода в гражданский оборот лекарственных препаратов для медицинского применения, утвержденного Постановлением (далее – Положение), ввод в гражданский оборот лекарственных препаратов осуществляются на основании согласования Федеральной службой по надзору в сфере здравоохранения ввоза в Российскую Федерацию, ввода в гражданский оборот лекарственного препарата, оформленного на основании решения созданной при Федеральной службе по надзору в сфере здравоохранения межведомственной комиссии по выдаче согласований на обращение лекарственного препарата (далее соответственно – межведомственная комиссия, согласование).
Выдача согласований на лекарственные препараты, произведенные после 01.10.2020, а также маркированные лекарственные препараты не входит в компетенцию межведомственной комиссии.
Источник