Риск анализ лекарственные средства
Эта система позволяет оценить все стадии производственного процесса с точки зрения возникновения риска, выявить зоны с недопустимым риском, определить соотношение выявленных опасных факторов, а также предложить предупреждающие мероприятия по предотвращению возникновения рисков.
По данным ГОСТ Р 51705.1-2001 [1] риск представляет собой «сочетание вероятности реализации опасного фактора и степени тяжести его последствий» [1]. Риск можно определить как произведение вероятности опасности на серьезность ее последствий [3].
В качестве опасных факторов (рисков) при производстве назального спрея можно выделить 3 группы: 1) микробиологические риски (микробная контаминация), 2) химические риски (остатки моющих средств, машинного масла), 3) физические риски (попадание металлической стружки, частей пластмассы и других предметов) [2,4]. Возникновение этих опасностей может привести к возникновению экономического риска, который приведет к потере готовой продукции и денежных средств.
Риски могут возникнуть на любой стадии технологического процесса в той или иной степени, поэтому важным моментом является их оценка.
Материалы и методы исследования. Исследования проводилось на базе ООО «Завод Медсинтез» в г. Новоуральске. Выявлением опасных факторов, которые могут повлиять на качество назального спрея, на всем этапе технологического процесса занималась экспертная группа ХАССП ООО «Завод Медсинтез» совместно с авторами исследования.
Результаты исследования и их обсуждение
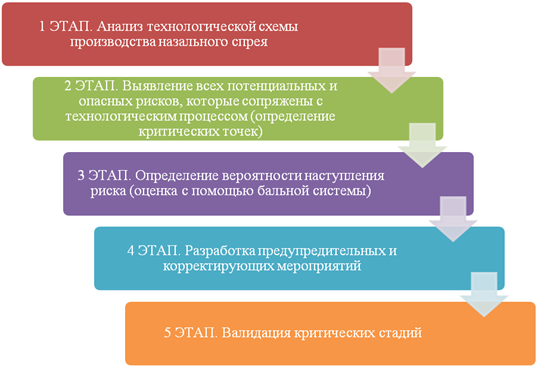
Исследование проводилось согласно алгоритму, который включал в себя 5 последовательных этапов (рис.1).
Рис. 1. Алгоритм проведения исследования
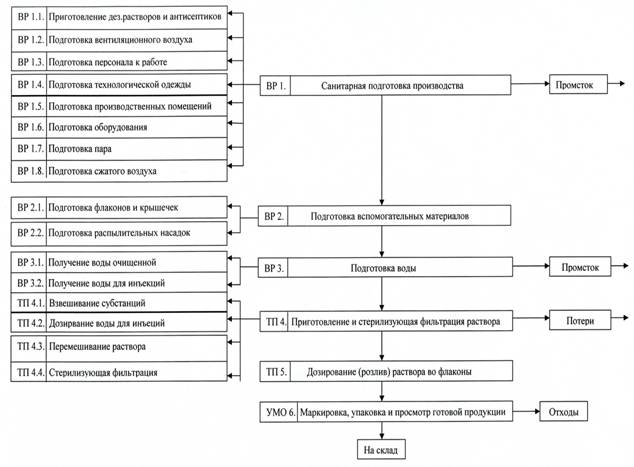
Первый этап исследования касался анализа технологической схемы производства назального спрея «Триазавирин спрей» (рис.2).
Рис. 2. Технологическая схема производства назального спрея «Триазавирин спрей»
Анализ технологической схемы производства назального спрея «Триазавирин спрей» показал, что в ней можно выделить общие стадии, которые присуши любому технологическому процессу, а именно: санитарная подготовка производства, включающая в себя приготовление дезинфицирующих растворов и антисептиков, подготовка вентиляционного воздуха, подготовка персонала к работе, подготовка технологической одежды, подготовка производственных помещений, подготовка оборудования, пара, сжатого воздуха; маркировка, упаковка и просмотр готовой продукции. Имеются и специфические стадии, присущие только производству назальных спреев: подготовка вспомогательных материалов, включающая в себя подготовку флаконов, крышечек и распылительных насадок; подготовка воды, включающая в себя получение воды очищенной и воды для инъекций; приготовление и стерилизующая фильтрация раствора, включающая в себя взвешивание субстанций, дозирование воды для инъекций, перемешивание раствора и стерилизующую фильтрацию; дозирование (розлив) раствора во флаконы.
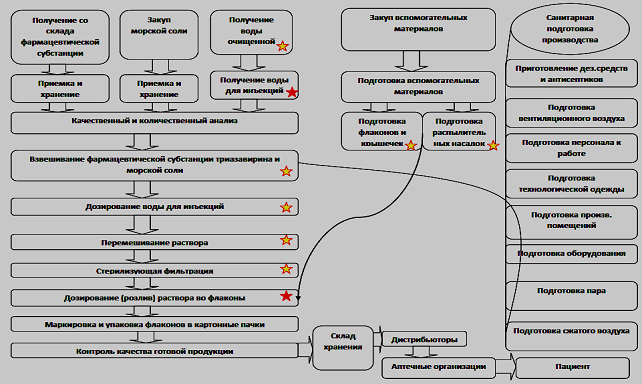
На основании технологической схемы производства назальной лекарственной формы «Триазавирин спрей» экспертами ХАССП совместно с авторами исследования была разработана производственная блок-схема (рис.3).
— 
— 
Рис. 3. Производственная блок-схема назальной лекарственной формы «Триазавирин спрей»
На производственной блок-схеме назальной лекарственной формы «Триазавирин спрей» экспертами ХАССП были выделены критические переходные и контрольные точки. Из блок-схемы видно, большой риск может наблюдаться на стадиях: получение воды для инъекций, дозирование (розлив) раствора во флаконы. Также риск может возникнуть на этапах: получение воды очищенной, взвешивание фармацевтической субстанции триазавирина и морской соли, дозирование воды для инъекций, перемешивание раствора, стерилизующая фильтрация, подготовка флаконов и крышечек, подготовка распылительных насадок.
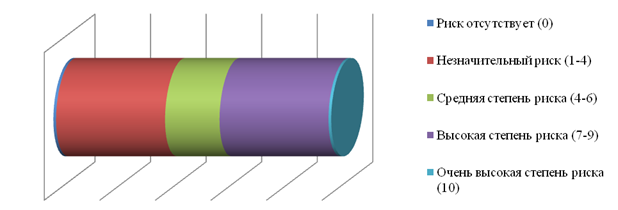
Следующий этап предполагал оценку степени риска. Оценка степени риска проводилась с использованием бальной системы от 0 до 10, где 0 – риск отсутствует, 1-4 – возможен незначительный риск, 4-6 – средняя степень риска, 7-9 – высокая степень риска, 10 – очень высокая степень риска (рис.4).
Рис. 4. Бальная шкала оценки степени риска
В таблице 1 приведены опасные факторы и предупреждающие действия при производстве назальной лекарственной формы «Триазавирин спрей»
Опасные факторы и предупреждающие действия при производстве назальной лекарственной формы «Триазавирин спрей»
Фактор (категория) риска
Предупреждающие и корректирующие мероприятия
Получение воды очищенной
Возможность попадания микроорганизмов, недостаточная очистка оборудования
Промывание оборудования и емкостей для сбора.

Получение воды для инъекций
Возможность попадания микроорганизмов, недостаточная очистка оборудования
Промывание оборудования и емкостей для сбора.

Взвешивание фармацевтической субстанции триазавирина и морской соли
Микробиологический, физический, химический
Возможность попадания микроорганизмов, частичек других субстанций, недостаточная очистка оборудования, неточность весов
Очистка оборудования, поверка весов

Дозирование воды для инъекций
Недостаточная очистка трубопроводов от микроорганизмов и моющих средств
Очистка трубопроводов от микроорганизмов и моющих средств

Возможность попадания микроорганизмов, неоднородность, осадок
Герметизация, дополнительное перемешивание

Загрязнение фильтров микроорганизмами и веществами
Замена фильтрующих материалов

Подготовка флаконов и крышечек
Микробная контаминация, остатки моющих средств

Подготовка распылительных насадок
Микробная контаминация, остатки моющих средств

Дозирование (розлив) раствора во флаконы

Таким образом, были выявлены две наиболее критические стадии: «Получение воды для инъекций» и «Дозирование (розлив) раствора во флаконы».
На следующем этапе представляло интерес проведение валидации критических стадий. Эти данные необходимы для формирования досье на препарат для представления на госрегистрацию. Рассмотрим валидацию критической стадии «Дозирование (розлив) раствора во флаконы».
ТП 4. Приготовление и стерилизующая фильтрация раствора. В данной стадии можно выделить следующие операции:
ТП 4.1. Взвешивание и растворение фармацевтической субстанции триазавирина и морской соли. На весах взвешивают 0,100 кг морской соли (КтТП4.1.) и 0,100 кг субстанции триазавирина (КтТП4.2.), последовательно добавляют в реактор, в котором содержится 5,18 литров воды для инъекций.
ТП 4.2. Дозирование воды для инъекций. В реактор дозируют 5,18 литров воды для инъекций (КтТП4.3.).
ТП 4.3. Перемешивание раствора. Отбор воды для инъекций осуществляется из горячей точки отбора V1-2 при температуре 72-95°C (КтТП4.4.), дозирование осуществляется через мерник с учетом температуры воды в количестве 5,18 л (КтТП4.3). Затем охлаждают до температуры 35 ±5°C (КтТП4.5.) и добавляют расчетное количество соли морской. Процесс растворения контролируется визуально (КтТП4.6), затем вносят необходимое количество триазавирина и перемешивают до полного растворения (КтТП4.7), при необходимости подачей в рубашку или змеевик горячей воды поднимают температуру до 45°C (КтТП4.8). Продолжительность процесса не превышает 1-1.5 часа (КтТП4.9.). Раствор охлаждают до комнатной температуры 18-25°C (КтТП4.10) и отбирают пробу на анализ (КтТП4.11). При получении положительного анализа на содержание ингредиентов в растворе его передают через фильтр с размером пор 1 мкм в промежуточную емкость (КтТП4.12).
После фильтрации полученный раствор помещают в промежуточную герметичную емкость, емкость перемещается на стадию розлива во флаконы, осуществляемую под ламинаром (Класс В), полуавтоматом для розлива во флаконы. Раствор на полуавтоматический дозатор подают через стерилизующий ультрафильтр из промежуточной емкости путем создания стерильным сжатым воздухом избыточного давления 0,01-0,02 МПа. Эта стадия процесса производства признана наиболее критичной и подлежащей обязательной валидации.
Перед началом работы помещение и оборудование участка розлива подготовлено, согласно требованиям GMP к помещениям с зонами В. Персонал подготовлен к работе в данном помещении.
Розлив раствора Триазавирина производят при температуре 18-25°C (КтТП5.1) в стерильные полиэтиленовые флаконы вместимостью 20 мл, по 20 мл во флакон. Раствор подают из передвижного сборника, в котором контролируется качество раствора (КтТП5.2.-содержание ингредиентов; КтТП5.3.-рН раствора; КтТП5.4-наличие посторонних примесей и осадка) через фильтр стерилизующей фильтрации с размером пор 0,2 мкм на дозирующий блок полуавтомата фасовки (КтТП5.5-целостность фильтра). После фильтра отбирается проба на анализ мехпримесей (КтТП5.6.) и стерильность (КтТП5.7.) Дозировку производят поршневым дозатором. Регулировка дозы происходит за счёт установки электронного регулятора. Затем проводят укупорку флаконов насадками-распылителями.
Во время дозирования на промежуточном сборнике открыта подача сжатого воздуха через установленный на линии подачи капсульный фильтр с размером пор 0,2 мкм.
В процессе розлива периодически, через 30 мин (КТ ТП.5-8), проверяют номинальный объем раствора во флаконах объёмным методом (с помощью калиброванного цилиндра вместимостью 25 мл). Номинальный объем должен быть от 19,0 до 21,0 мл (КТ ТП.5-9).
После розлива дозирующий блок промывают водой для инъекций, затем заполняют этиловым спиртом с объёмной долей 76 % и оставляют его до следующей операции розлива.
Во время розлива дозировщик систематически, не реже, чем через 2 ч работы, обрабатывает руки в перчатках анатомических этиловым спиртом с объёмной долей 76 % или готовым дезраствором для рук.
Укупоренные флаконы с раствором собирают в кассеты и передают на стадию маркировки и упаковки.
Для формирования валидационного плана и его реализации было необходимо определить перечень важнейших контрольных точек производства стадии розлива во флаконы. В таблице 2 сведены все необходимые точки контроля процесса.
Перечень важнейших контрольных точек производства стадии ТП 5 Дозирование (розлив) раствора во флаконы
Источник