Рецепторы обеспечивающие основное действие лекарственных препаратов называются
Рецепторы — макромолекулы, функция которых заключается в связывании веществ-посредников и в преобразовании этой связи в действие, т, е. изменение клеточной функции. Рецепторы отличаются по своей структуре и способу преобразования контакта с лигандом в клеточный ответ (преобразование сигнала).
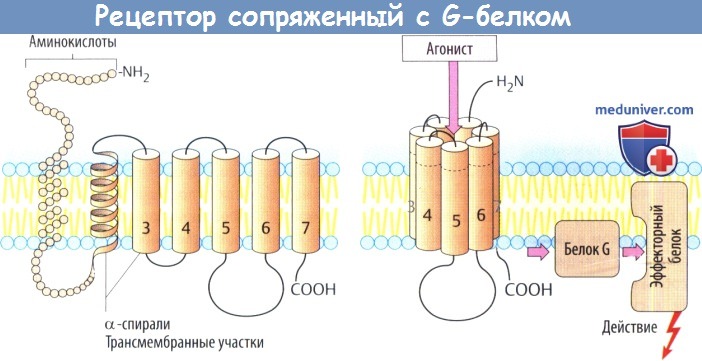
а) Рецепторы, сопряженные с белком G, состоят из цепи аминокислот, которая направлена в сторону мембраны и от нее в виде серпантина. С вне-мембранными петлевыми участками молекулы связаны углеводные остатки через различные точки N-гликозилирования.
Семь а-спиральных, охватывающих мембрану участков образуют окружность возле центральной ниши, которая несет участки для связывания медиаторных веществ. Связывание молекулы медиатора или структурно связанной молекулы агониста вызывает изменение конформации белка, в результате чего он вступает во взаимодействие с белком G (белок, связывающий нуклеотид гуанил).
Белки G располагаются в нижнем слое плазмолеммы и состоят из трех субъединиц, обозначаемых а, β и γ. Существует несколько белков G, которые отличаются в основном своей a-единицей. Контакте рецептором активирует белок G, что, в свою очередь, приводит к активации другого белка (фермента, ионного канала). Многие медиаторы действуют через рецепторы, сопряженные с белком G.
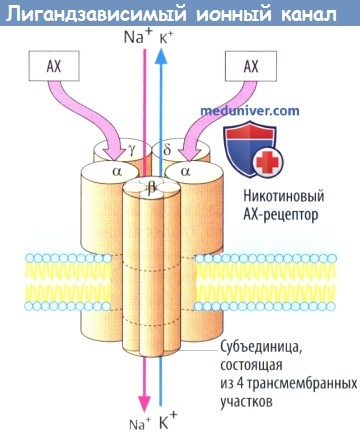
б) Примером лигандзависимого ионного канала является никотиновый холинорецептор на концевой пластинке двигательного нерва. Рецепторный комплекс образован пятью субъединицами, каждая из которых содержит четыре трансмембранных участка.
Одновременное связывание двух молекул АХ двумя а-субъединицами приводит к открытию ионного канала со входом Na + (и выходом некоторого количества К + ), деполяризации мембраны и активации потенциала действия. Нейронные N-холинорецепторы, очевидно, состоят лишь изо- и β-субъединиц.
Ряд рецепторов медиатора γ-аминомасляной кислоты (ГАМК) принадлежат к данной группе: подтип ГАМКA связан с хлорными каналами (и с участком связывания бензодиазепинов). Глутамат и глицин оба действуют через лигандзависимые ионные каналы.
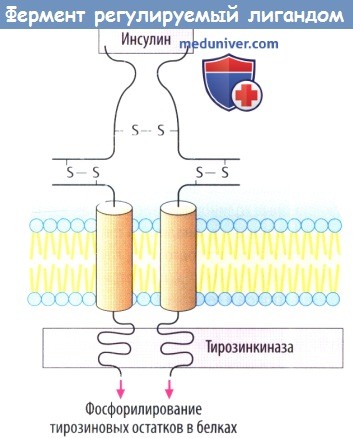
в) Белок инсулинового рецептора представляет собой управляемый лигандом фермент, каталитический рецептор. При связывании инсулина с внеклеточным участком «отключается» активность тирозинкиназы внутри клетки. Фосфорилирование белка приводит к изменению клеточной функции в результате образования других сигнальных белков. Рецепторы гормонов роста тоже принадлежат к классу каталитических рецепторов.
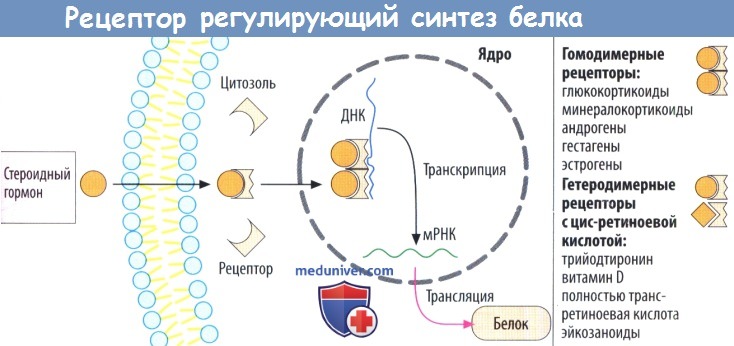
г) Рецепторы, регулирующие синтез белка, стероидов и гормонов щитовидной железы, находятся в цитозоле и в клеточном ядре соответственно. Белки рецепторов также расположены внутриклеточно, в зависимости от гормона — в цитозоле (глюкокортикоиды, минералокортикоиды, андрогены и гестагены) или в клеточном ядре (эстрогены, гормоны щитовидной железы).
При связывании гормона открывается скрытый в норме участок белка рецептора, что дает возможность последнему связаться с особой последовательностью нуклеотидов ДНК в гене и регулировать его транскрипцию. Из этого следует, что комплексы лиганд-рецептор работают как факторы, регулирующие транскрипцию. Обычно происходит активация или усиление и, редко, блокада транскрипции.
Комплексы гормон-рецептор взаимодействуют парно с ДНК. Эти пары (димеры) могут состоять из двух идентичных комплексов гормон-рецептор (гомодимерная форма, например, с гормонами надпочечников или половыми гормонами). Комплекс тиреоидный гормон-рецептор встречается в гетеродимерной форме и сочетается с комплексом цис-ретиноевая кислота-рецептор.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
7)Фармакодинамика, определение. Основные принципы действия лекарств. Типы рецепторов. Вторичные мессенджеры.
Фармакодина́мика — раздел фармакологии, изучающий биохимические эффекты и физиологические действия лекарств на тело человека, на микроорганизмы или паразитов, находящихся внутри тела человека или снаружи. Она также изучает механизмы действия лекарств, связь между концентрацией лекарственных веществ и достигнутым ими действием.
Многие лекарства имеют одинаковый механизм действия и, следовательно, могут быть объединены в группы и подгруппы. Количество различных фармакологических групп (подгрупп) ограничивается десятками.
Под действием лекарств в организме не происходит новых биохимических реакций или физиологических процессов. Большинство лекарств только стимулируют, имитируют, угнетают или полностью блокируют действие внутренних посредников, передающих сигналы между различными органами и системами через биологические субстраты.
Каждое звено механизма обратной связи участвует в регулировании функций клетки и целого организма, а, следовательно, может служить “мишенью” – биологическим субстратом – для лекарственных средств.
Многие ферменты являются “мишенями” для лекарств. Лекарства могут угнетать или – реже – повышать активность этих ферментов, а также являться для них “ложными” субстратами. Например, угнетающими активность (ингибирующими) ферментов средствами являются ненаркотические анальгетики и нестероидные противовоспалительные средства, некоторые противоопухолевые препараты (метотрексат), а ложным субстратом – метилдофа. Ингибиторы ангиотензинпревращающего фермента (АПФ) (каптоприл и эналаприл) широко применяются в качестве понижающих артериальное давление (гипотензивных) средств. Изменяя активность ферментов, лекарства изменяют внутриклеточные процессы и тем самым обеспечивают лечебный эффект.
В основе фармакологического действия лекарств лежит их физико-химическое или химическое взаимодействие с такими “мишенями”. Возможность взаимодействия лекарства с биологическим субстратом зависит в первую очередь от химического строения каждого из них. Последовательность расположения атомов, пространственная конфигурация молекулы, величина и расположение зарядов, подвижность фрагментов молекулы относительно друг друга влияют на прочность связи и, тем самым, на силу и продолжительность фармакологического действия. Молекула лекарственного вещества в большинстве случаев имеет очень маленький размер по сравнению с биологическими субстратами, поэтому она может соединяться только с небольшим фрагментом макромолекулы рецептора. При любой реакции между лекарством и биологическим субстратом образуется химическая связь
Итак, есть сигнальные молекулы (медиаторы, гормоны, эндогенные биологически активные вещества), и есть биологические субстраты, с которыми эти молекулы взаимодействуют. Лекарства, введенные в организм, могут воспроизводить или блокировать эффекты естественных сигнальных молекул, изменяя тем самым функции клеток, тканей, органов и систем органов. Этим определяется фармакологическое действие лекарств.
Воспроизведение действия (миметический эффект) наблюдается в тех случаях, когда молекула лекарственного вещества и естественная сигнальная молекула очень похожи: имеют высокое соответствие физико-химических свойств и структуры, обеспечивающих одинаковые внутриклеточные изменения. Результатом взаимодействия лекарства с рецептором в этом случае является активация или торможение определенной функции клеток в полном соответствии с действием эндогенной (внутренней) сигнальной молекулы. Подобным образом действуют очень многие аналоги гормонов и медиаторов. Цель создания подобных лекарств – получение препаратов с более выраженным, стабильным и длительным по сравнению с медиатором (адреналин, ацетилхолин, серотонин и другие) действием, а также восполнение дефицита медиатора или гормона и, соответственно, их функций.
Конкурентное действие (блокирующий, литический эффект) встречается часто и присуще лекарствам, которые лишь частично похожи на сигнальную молекулу (например, медиатор). В этом случае лекарство способно связываться с одним из участков рецептора, но оно не вызывает комплекса реакций, сопутствующих действию естественного медиатора. Такое лекарство как бы создает над рецептором защитный экран, препятствуя его взаимодействию с естественным медиатором, гормоном и так далее. Конкурентная борьба за рецептор, называемая антагонизмом (отсюда и название лекарств – антагонисты), позволяет корректировать физиологические и патологические реакции. Подобным образом действуют адрено-, холино- и гистаминолитики.
Следующий тип взаимодействия лекарства с рецептором называют неконкурентным, и в этом случае молекула лекарства связывается с рецепторной макромолекулой не в месте ее взаимодействия с медиатором, а на рядом расположенном участке, то есть действует опосредованно. При этом происходит изменение пространственной структуры рецептора, вызывающее раскрытие или закрытие его для естественного медиатора. В этих случаях рецептор для лекарства и рецептор для медиатора не совпадают, но находятся в одном рецепторном комплексе, и лекарство не вступает в прямое взаимодействие с рецептором. Ярким примером лекарств, действующих по этому типу, являются бензодиазепины – большая группа структурно родственных соединений, обладающих анксиолитическими, снотворными и противосудорожными свойствами.Соединяясь со специфическими бензодиазепиновыми рецепторами, которые взаимосвязаны с рецепторами гамма-аминомасляной кислоты (ГАМК), лекарственное средство изменяет пространственную конфигурацию ГАМК-рецепторов и увеличивает прочность их связи с субстратом – гамма-аминомасляной кислотой. В результате усиливается тормозящее влияние этого медиатора на центральную нервную систему, чем обеспечивается лечебный эффект препаратов.
В качестве «мишеней» для лекарственных средств служат рецепторы, ионные каналы, ферменты, транспортные системы и гены. Рецепторами называют активные группировки макромолекул субстратов, с которыми взаимодействует вещество. Рецепторы, обеспечивающие проявление действия веществ, называют специфическими.
Выделяют следующие 4 типа рецепторов
I. Рецепторы, осуществляющие прямой контроль за функцией ионных каналов. К этому типу рецепторов, непосредственно сопряженных с ионными каналами, относятся н-холинорецепторы, ГАМКА-рецепторы, глутаматные рецепторы.
II. Рецепторы, сопряженные с эффектором через систему «G-белки — вторичные передатчики» или «G-белки-ионные каналы». Такие рецепторы имеются для многих гормонов и медиаторов (м-холинорецепторы, адренорецепторы).
III. Рецепторы, осуществляющие прямой контроль функции эффекторного фермента. Они непосредственно связаны с тирозинкиназой и регулируют фосфорилирование белков. По такому принципу устроены рецепторы инсулина, ряда факторов роста.
IV. Рецепторы, контролирующие транскрипцию ДНК. В отличие от мембранных рецепторов I-III типов, это внутриклеточные рецепторы (растворимые цитозольные или ядерные белки). С такими рецепторами взаимодействуют стероидные и тиреоидные гормоны.
Вторичные посредники, или «вторичные мессенджеры» — это внутриклеточные сигнальные молекулы, высвобождаемые в тех или иных внутриклеточных сигнальных каскадах в ответ на стимуляцию тех или иных рецепторов и вызванную ею активацию первичных эффекторных белков. Вторичные посредники, в свою очередь, приводят к активации вторичных эффекторных белков. Это, в свою очередь, запускает каскад тех или иных физиологических изменений, которые могут быть важны для обеспечения таких важных физиологических процессов, как рост, развитие и дифференцировка клеток, активация деления клетки, транскрипция или наоборот угнетение транскрипции тех или иных генов, биосинтез тех или иных белков, выделение ею гормонов, нейромедиаторов или цитокинов соответственно типу клетки, изменение биоэлектрической активности клетки, миграция клеток, обеспечение их выживаемости или, наоборот, индукция апоптоза. Вторичные посредники являются инициирующими элементами во множестве внутриклеточных сигнальных каскадов. Вследствие всего этого вторичные посредники играют очень важную роль в жизни клетки, а грубое нарушение работы любой из систем вторичных посредников оказывает неблагоприятное воздействие на клетку (например, может привести к её опухолевой трансформации или наоборот к апоптозу).
Вторичные посредники, как правило, являются малыми небелковыми молекулами. Важнейшие примеры молекул вторичных посредников (но не ограничивающиеся ими) включают в себя циклический АМФ, циклический ГМФ, инозитолтрифосфат, диацилглицерин, кальций, оксид азота (II).
Источник
ВИДЫ ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ ЛС (ЧАСТЬ 3)
Индивидуальная несовместимость организма с ЛС может быть врожденной (идиосинкразия) или приобретенной (сенсибилизация).
Идиосинкразия (греч. idios — своеобразный, synkrasis — смешение) — врожденная индивидуальная непереносимость ЛВ. Она обусловлена отсутствием или снижением активности ферментов, либо отсутствием систем обезвреживания веществ определенной химической группы.
Преферанская Нина Германовна
Доцент кафедры фармакологии фармфакультета Первого МГМУ им. И.М. Сеченова, к.фарм.н.
Идиосинкразия возникает при первом приеме вещества (агента) и при этом иммунитет не развивается, антитела не образуются, не возникает реакции «АГ+АТ». Например, врожденная аномалия фермента псевдохолинэстеразы удлиняет миорелаксирующее действие суксаметония йодида (Дитилин). У ряда больных с наследственной недостаточностью фермента глюкозо–6–фосфатдегидрогеназы может возникать гемолиз эритроцитов при применении противомалярийного препарата «Примахин» или антибиотика «Хлорамфеникол».
Аллергические реакции являются одними из наиболее часто встречающихся отрицательных видов действия ЛС. Многие из них (антибиотики, сульфаниламиды, препараты инсулина и др.) при попадании в организм людей с повышенной чувствительностью приводят к образованию и накоплению специфических антител. При повторных введениях этих ЛС происходит их взаимодействие с антителами и в результате возникают аллергические реакции. Лекарственная аллергия обусловлена нарушением иммунологических свойств организма, это приобретенная повышенная чувствительность организма к лекарственным веществам. Она протекает в виде аллергических реакций по немедленному или замедленному типу. К аллергическим реакциям немедленного типа относятся крапивница, отек Квинке, поллинозы, бронхиальная астма, сывороточная болезнь, лекарственный анафилактический шок. Они возникают при повторных курсах терапии, через несколько минут (≈20–30 мин.) после приема лекарства. Из аллергических реакций немедленного типа наиболее опасным является анафилактический шок. Анафилактический шок — быстроразвивающаяся реакция организма на повторное введение лекарства при имеющейся повышенной чувствительности к данному лекарственному веществу. Симптомы: боль за грудиной, отек гортани, спазм бронхов и удушье, снижение АД и ослабление сердечной деятельности, возможна потеря сознания. Если вовремя не оказать помощь, может наступить гибель организма. Аллергические реакции немедленного типа могут вызвать антибактериальные препараты (в частности, введение антибиотиков пенициллинового ряда), НПВС, анестетики, введение сывороток, вакцин.
Аллергические реакции замедленного типа развиваются через 24–48 часов и более, после повторного введения лекарственного вещества, к которому имеется сенсибилизация организма. Сенсибилизацией (лат. sensibilis — чувствительный) называется иммунологически опосредованная повышенная чувствительность организма к экзогенным или эндогенным антигенам. К ним относятся: лекарственная аллергия, вызывающая цитотоксический эффект в виде дерматитов, васкулитов, флебитов, аллергические реакции на пробы Манту, Пирке.
К отрицательным видам действия ЛС относится также «синдром отмены» — абстиненция (лат. abstinentia — воздержание), физическое и психическое состояние пациента после внезапного или полного прекращения препаратозависимой терапии. Синдром отмены может наблюдаться после прекращения приема опиоидных наркотических анальгетиков (Морфин, Тримеперидин); гормональных препаратов (Инсулин, глюкокортикостероиды); антигипертензивного средства «Клофелин», адреноблокатора «Анаприлин» и некоторых психотропных средств.
Всесоюзная организация здравоохранения (ВОЗ) рассматривает все случаи неблагоприятных реакций на организм зарегистрированных ЛС. Согласно определению ВОЗ, побочное нежелательное действие — это непредвиденные вредные (губительные) эффекты, которые возникают при использовании доз лекарственного средства, рекомендованных для профилактики и лечения заболеваний. При однократном введении лекарства неблагоприятные реакции могут не развиваться, не проявляться и никак не выявляться. При длительном применении ЛС побочный нежелательный эффект может стать причиной различных осложнений, в т.ч. обострения наследственных заболеваний. Различают нежелательные реакции, связанные с применением ЛС, на:
- побочные (негативные) реакции;
- серьезные нежелательные реакции (приводящие к различным осложнениям, инвалидности, угрозе жизни человека или к летальному исходу);
- непредсказуемые нежелательные реакции;
- серьезные непредвиденные нежелательные реакции.
Нежелательные эффекты, возникающие при применении ЛС в дозах, превышающих терапевтические, называются токсическими, как правило, это связано с передозировкой того или иного лекарственного препарата.
Согласно международной классификации выделяют 4 типа отрицательных побочных эффектов или нежелательных реакций на ЛС.
Тип А — предсказуемые реакции организма на введенное лекарство. Как правило, это дозозависимые побочные реакции, возникающие в 75% случаев от всех нежелательных реакций и приблизительно наблюдаются более чем у 1 из 100 больных. Эти реакции связывают с лекарственным взаимодействием, абсолютной, относительной передозировкой, индивидуальными особенностями организма. Летальность пациентов невысокая.
Тип В — непредсказуемые реакции организма, как правило, нечастые и возникают только у чувствительных людей. Это — дозонезависимые реакции, в
25% случаев неизвестного генеза, иммунологические или неиммунологические (иммунопатии, энзимопатии, идиосинкразия, сенсибилизация, гиперчувствительность). Возникновение таких реакций — менее 1 на 1000 больных, высокая летальность.
Тип С — реакции организма, связанные с длительной терапией заболевания. Возникает синдром отмены, кумуляция, лекарственная зависимость, подавление выработки эндогенных веществ. Диагностика таких реакций затруднительна.
Тип D — тяжелые необратимые побочные эффекты на вводимое лекарство. Как правило, чаще всего наблюдаются отсроченные эффекты: мутагенность, канцерогенность и тератогенность. Предсказать такие реакции организма крайне трудно. В настоящее время все лекарства, которые регистрируются, проходят тестирование на вышеперечисленные необратимые побочные эффекты.
Одновременное использование нескольких ЛС с мало прогнозируемым результатом их совместного взаимодействия может привести к полипрагмазии (греч. poli, polys — многий, pragma — действие). У больных старше 60 лет нередко диагностируют одновременно несколько заболеваний. В норме врач назначает не более 3–5 лекарств. Использование 3–5 лекарств одновременно приводит к развитию нежелательных реакций у 4% пациентов. Применение 16–20 лекарств одновременно может вызвать развитие побочных нежелательных эффектов в 54% случаев.
Токсическое действие возникает также при абсолютной или относительной передозировке ЛС и проявляется в значительном, иногда обратимом нарушении функций отдельных органов или систем органов. Абсолютная передозировка бывает при повышении высших, суточных и курсовых доз, а относительная передозировка – при назначении средних (обычных) доз лицам с поражениями печени, почек, что сопровождается накоплением в организме применяемого действующего вещества, т.к. замедляется его инактивация и выделение из организма. Хорошо известно токсическое действие аминогликозидных антибиотиков (Стрептомицин, Канамицин) на слуховой нерв, когда поражается восьмая пара черепно-мозговых нервов и возникает ототоксический эффект. У больных наблюдается снижением слуха, шум, звон или заложенность в ушах, вплоть до глухоты.
Токсическое действие, кроме общего и местного, может обозначаться как ориентированное на определенные органы: нейро–, нефро–, гепато–, гемато– или кардиотоксический эффект и т.д.
При нейротоксическом эффекте повреждаются ткани нервной системы (ЦНС, периферическая нервная система). Примером нейротоксического действия является повреждающее действие ЦНС местным анестетиком «Новокаином» и близким к нему по химической структуре антиаритмическим препаратом 1А класса — «Новокаинамидом». При в/в введении возможно развитие головокружения, двигательного возбуждения или неприятные ощущения (чаще в конечностях), парестезии, которые проявляются онемением, покалыванием, жжением или эффектом «ползание мурашек». Антибиотик «Циклосерин», применяемый для лечения больных туберкулезом, может вызвать развитие психозов, галлюцинаций, псевдоэпилептических припадков.
Антибиотики из группы аминогликозидов вызывают нефротоксический эффект. Повреждение клубочкового аппарата или канальцевой системы нефрона почек могут возникать при применении полимиксинов и некоторых цефалоспоринов.
Гепатотоксическое действие — повреждение паренхимы печени и нарушение ее метаболической функции и др. Например, при применении Метациклина, Рифампицина.
Гематотоксическое действие (угнетение кроветворения) оказывают большинство цитостатиков, т.к. оказывают прямое угнетающее влияние на быстро размножающиеся ткани и в т.ч. на кроветворную систему (костный мозг). Это токсическое действие возникает только при резорбтивном применении хлорамфеникола (левомицетина). После местного применения препаратов, в состав которых входит левомицетин: 0,25% раствор левомицетина в глазных каплях, 1% глазной линимент, линимент синтомицина, содержащий рацемическую смесь (1 ч. хлорамфеникола + 1 ч. — его правовращающий изомер), комбинированная мазь «Левомиколь» и антибактериальный аэрозоль «Олазоль», таких побочных эффектов не возникает.
При назначении ЛС беременным женщинам возможно отрицательное действие на развивающийся плод. Эти отрицательные действия возникают при применении ЛС, проникающих через плацентарный барьер. Наиболее серьезными являются тератогенное и эмбриотоксическое действия.
Тератогенное действие (греч. teras — урод) проявляется врожденными уродствами, развившимися в результате влияния некоторых ЛС на организм плода (наиболее опасный период с 3 по 12 неделю беременности). Хорошо известна история применения в некоторых зарубежных странах успокаивающего и снотворного средства «Талидомид». У женщин, принимавших в первую треть беременности этот препарат, рождались дети, имевшие врожденные уродства (дефекты конечностей, их недоразвитие, пороки сердца, почек, нарушение функций желудочно–кишечного тракта и др. органов). Известны случаи уродств от применения некоторых гормональных препаратов, антибиотиков. Для предупреждения тератогенного действия рекомендуется воздерживаться от приема ЛС в первые три месяца беременности, особенно когда происходит закладка органов ребенка.
Эмбриотоксическое действие ЛС проявляется нарушением развития эмбриона, процессов имплантации (1–2 неделю беременности) и образования плаценты (3–6 неделю). В результате эмбриотоксического действия беременность или не развивается, или заканчивается самопроизвольным абортом.
Фетотоксическое действие связано с изменением функции органов и систем плода, а также обмена веществ в период с 9 по 38 неделю.
Мутагенное действие связано со стойким повреждением зародышевой клетки в период эмбриогенеза и ее генетического аппарата (до 12 недели беременности). Мутации могут проявляться в половых клетках, изменяя генотип потомства. Мутации в соматических клетках могут привести к развитию злокачественных образований (канцерогенному действию).
Безопасность ЛС должна изучаться на всех этапах продвижения препарата на фармацевтическом рынке (даже после тщательно проведенных доклинических и клинических испытаний). Одно только официальное разрешение на применение лекарства не является гарантией его безопасности для всех больных.
Источник