- 7)Фармакодинамика, определение. Основные принципы действия лекарств. Типы рецепторов. Вторичные мессенджеры.
- Рецепторы клетки лекарственные средства
- Больная тема: часть I
- Похожее на студень скопление нервных клеток под названием «желатинозная субстанция», можно сказать, определяет – что уже считать болью, а что ещё нет.
7)Фармакодинамика, определение. Основные принципы действия лекарств. Типы рецепторов. Вторичные мессенджеры.
Фармакодина́мика — раздел фармакологии, изучающий биохимические эффекты и физиологические действия лекарств на тело человека, на микроорганизмы или паразитов, находящихся внутри тела человека или снаружи. Она также изучает механизмы действия лекарств, связь между концентрацией лекарственных веществ и достигнутым ими действием.
Многие лекарства имеют одинаковый механизм действия и, следовательно, могут быть объединены в группы и подгруппы. Количество различных фармакологических групп (подгрупп) ограничивается десятками.
Под действием лекарств в организме не происходит новых биохимических реакций или физиологических процессов. Большинство лекарств только стимулируют, имитируют, угнетают или полностью блокируют действие внутренних посредников, передающих сигналы между различными органами и системами через биологические субстраты.
Каждое звено механизма обратной связи участвует в регулировании функций клетки и целого организма, а, следовательно, может служить “мишенью” – биологическим субстратом – для лекарственных средств.
Многие ферменты являются “мишенями” для лекарств. Лекарства могут угнетать или – реже – повышать активность этих ферментов, а также являться для них “ложными” субстратами. Например, угнетающими активность (ингибирующими) ферментов средствами являются ненаркотические анальгетики и нестероидные противовоспалительные средства, некоторые противоопухолевые препараты (метотрексат), а ложным субстратом – метилдофа. Ингибиторы ангиотензинпревращающего фермента (АПФ) (каптоприл и эналаприл) широко применяются в качестве понижающих артериальное давление (гипотензивных) средств. Изменяя активность ферментов, лекарства изменяют внутриклеточные процессы и тем самым обеспечивают лечебный эффект.
В основе фармакологического действия лекарств лежит их физико-химическое или химическое взаимодействие с такими “мишенями”. Возможность взаимодействия лекарства с биологическим субстратом зависит в первую очередь от химического строения каждого из них. Последовательность расположения атомов, пространственная конфигурация молекулы, величина и расположение зарядов, подвижность фрагментов молекулы относительно друг друга влияют на прочность связи и, тем самым, на силу и продолжительность фармакологического действия. Молекула лекарственного вещества в большинстве случаев имеет очень маленький размер по сравнению с биологическими субстратами, поэтому она может соединяться только с небольшим фрагментом макромолекулы рецептора. При любой реакции между лекарством и биологическим субстратом образуется химическая связь
Итак, есть сигнальные молекулы (медиаторы, гормоны, эндогенные биологически активные вещества), и есть биологические субстраты, с которыми эти молекулы взаимодействуют. Лекарства, введенные в организм, могут воспроизводить или блокировать эффекты естественных сигнальных молекул, изменяя тем самым функции клеток, тканей, органов и систем органов. Этим определяется фармакологическое действие лекарств.
Воспроизведение действия (миметический эффект) наблюдается в тех случаях, когда молекула лекарственного вещества и естественная сигнальная молекула очень похожи: имеют высокое соответствие физико-химических свойств и структуры, обеспечивающих одинаковые внутриклеточные изменения. Результатом взаимодействия лекарства с рецептором в этом случае является активация или торможение определенной функции клеток в полном соответствии с действием эндогенной (внутренней) сигнальной молекулы. Подобным образом действуют очень многие аналоги гормонов и медиаторов. Цель создания подобных лекарств – получение препаратов с более выраженным, стабильным и длительным по сравнению с медиатором (адреналин, ацетилхолин, серотонин и другие) действием, а также восполнение дефицита медиатора или гормона и, соответственно, их функций.
Конкурентное действие (блокирующий, литический эффект) встречается часто и присуще лекарствам, которые лишь частично похожи на сигнальную молекулу (например, медиатор). В этом случае лекарство способно связываться с одним из участков рецептора, но оно не вызывает комплекса реакций, сопутствующих действию естественного медиатора. Такое лекарство как бы создает над рецептором защитный экран, препятствуя его взаимодействию с естественным медиатором, гормоном и так далее. Конкурентная борьба за рецептор, называемая антагонизмом (отсюда и название лекарств – антагонисты), позволяет корректировать физиологические и патологические реакции. Подобным образом действуют адрено-, холино- и гистаминолитики.
Следующий тип взаимодействия лекарства с рецептором называют неконкурентным, и в этом случае молекула лекарства связывается с рецепторной макромолекулой не в месте ее взаимодействия с медиатором, а на рядом расположенном участке, то есть действует опосредованно. При этом происходит изменение пространственной структуры рецептора, вызывающее раскрытие или закрытие его для естественного медиатора. В этих случаях рецептор для лекарства и рецептор для медиатора не совпадают, но находятся в одном рецепторном комплексе, и лекарство не вступает в прямое взаимодействие с рецептором. Ярким примером лекарств, действующих по этому типу, являются бензодиазепины – большая группа структурно родственных соединений, обладающих анксиолитическими, снотворными и противосудорожными свойствами.Соединяясь со специфическими бензодиазепиновыми рецепторами, которые взаимосвязаны с рецепторами гамма-аминомасляной кислоты (ГАМК), лекарственное средство изменяет пространственную конфигурацию ГАМК-рецепторов и увеличивает прочность их связи с субстратом – гамма-аминомасляной кислотой. В результате усиливается тормозящее влияние этого медиатора на центральную нервную систему, чем обеспечивается лечебный эффект препаратов.
В качестве «мишеней» для лекарственных средств служат рецепторы, ионные каналы, ферменты, транспортные системы и гены. Рецепторами называют активные группировки макромолекул субстратов, с которыми взаимодействует вещество. Рецепторы, обеспечивающие проявление действия веществ, называют специфическими.
Выделяют следующие 4 типа рецепторов
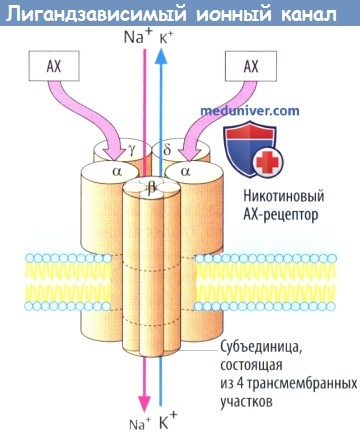
I. Рецепторы, осуществляющие прямой контроль за функцией ионных каналов. К этому типу рецепторов, непосредственно сопряженных с ионными каналами, относятся н-холинорецепторы, ГАМКА-рецепторы, глутаматные рецепторы.
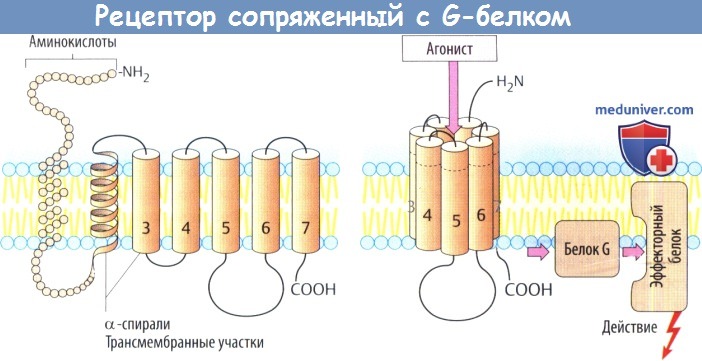
II. Рецепторы, сопряженные с эффектором через систему «G-белки — вторичные передатчики» или «G-белки-ионные каналы». Такие рецепторы имеются для многих гормонов и медиаторов (м-холинорецепторы, адренорецепторы).
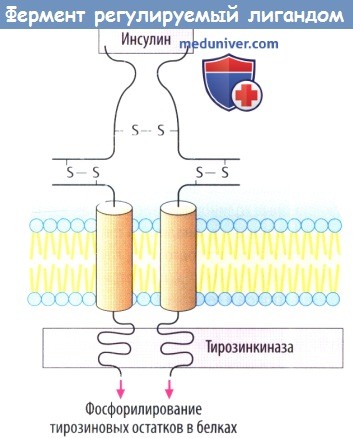
III. Рецепторы, осуществляющие прямой контроль функции эффекторного фермента. Они непосредственно связаны с тирозинкиназой и регулируют фосфорилирование белков. По такому принципу устроены рецепторы инсулина, ряда факторов роста.
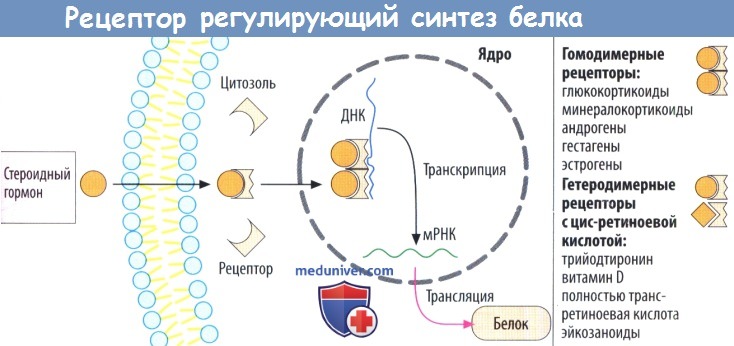
IV. Рецепторы, контролирующие транскрипцию ДНК. В отличие от мембранных рецепторов I-III типов, это внутриклеточные рецепторы (растворимые цитозольные или ядерные белки). С такими рецепторами взаимодействуют стероидные и тиреоидные гормоны.
Вторичные посредники, или «вторичные мессенджеры» — это внутриклеточные сигнальные молекулы, высвобождаемые в тех или иных внутриклеточных сигнальных каскадах в ответ на стимуляцию тех или иных рецепторов и вызванную ею активацию первичных эффекторных белков. Вторичные посредники, в свою очередь, приводят к активации вторичных эффекторных белков. Это, в свою очередь, запускает каскад тех или иных физиологических изменений, которые могут быть важны для обеспечения таких важных физиологических процессов, как рост, развитие и дифференцировка клеток, активация деления клетки, транскрипция или наоборот угнетение транскрипции тех или иных генов, биосинтез тех или иных белков, выделение ею гормонов, нейромедиаторов или цитокинов соответственно типу клетки, изменение биоэлектрической активности клетки, миграция клеток, обеспечение их выживаемости или, наоборот, индукция апоптоза. Вторичные посредники являются инициирующими элементами во множестве внутриклеточных сигнальных каскадов. Вследствие всего этого вторичные посредники играют очень важную роль в жизни клетки, а грубое нарушение работы любой из систем вторичных посредников оказывает неблагоприятное воздействие на клетку (например, может привести к её опухолевой трансформации или наоборот к апоптозу).
Вторичные посредники, как правило, являются малыми небелковыми молекулами. Важнейшие примеры молекул вторичных посредников (но не ограничивающиеся ими) включают в себя циклический АМФ, циклический ГМФ, инозитолтрифосфат, диацилглицерин, кальций, оксид азота (II).
Источник
Рецепторы клетки лекарственные средства
Рецепторы — макромолекулы, функция которых заключается в связывании веществ-посредников и в преобразовании этой связи в действие, т, е. изменение клеточной функции. Рецепторы отличаются по своей структуре и способу преобразования контакта с лигандом в клеточный ответ (преобразование сигнала).
а) Рецепторы, сопряженные с белком G, состоят из цепи аминокислот, которая направлена в сторону мембраны и от нее в виде серпантина. С вне-мембранными петлевыми участками молекулы связаны углеводные остатки через различные точки N-гликозилирования.
Семь а-спиральных, охватывающих мембрану участков образуют окружность возле центральной ниши, которая несет участки для связывания медиаторных веществ. Связывание молекулы медиатора или структурно связанной молекулы агониста вызывает изменение конформации белка, в результате чего он вступает во взаимодействие с белком G (белок, связывающий нуклеотид гуанил).
Белки G располагаются в нижнем слое плазмолеммы и состоят из трех субъединиц, обозначаемых а, β и γ. Существует несколько белков G, которые отличаются в основном своей a-единицей. Контакте рецептором активирует белок G, что, в свою очередь, приводит к активации другого белка (фермента, ионного канала). Многие медиаторы действуют через рецепторы, сопряженные с белком G.
б) Примером лигандзависимого ионного канала является никотиновый холинорецептор на концевой пластинке двигательного нерва. Рецепторный комплекс образован пятью субъединицами, каждая из которых содержит четыре трансмембранных участка.
Одновременное связывание двух молекул АХ двумя а-субъединицами приводит к открытию ионного канала со входом Na + (и выходом некоторого количества К + ), деполяризации мембраны и активации потенциала действия. Нейронные N-холинорецепторы, очевидно, состоят лишь изо- и β-субъединиц.
Ряд рецепторов медиатора γ-аминомасляной кислоты (ГАМК) принадлежат к данной группе: подтип ГАМКA связан с хлорными каналами (и с участком связывания бензодиазепинов). Глутамат и глицин оба действуют через лигандзависимые ионные каналы.
в) Белок инсулинового рецептора представляет собой управляемый лигандом фермент, каталитический рецептор. При связывании инсулина с внеклеточным участком «отключается» активность тирозинкиназы внутри клетки. Фосфорилирование белка приводит к изменению клеточной функции в результате образования других сигнальных белков. Рецепторы гормонов роста тоже принадлежат к классу каталитических рецепторов.
г) Рецепторы, регулирующие синтез белка, стероидов и гормонов щитовидной железы, находятся в цитозоле и в клеточном ядре соответственно. Белки рецепторов также расположены внутриклеточно, в зависимости от гормона — в цитозоле (глюкокортикоиды, минералокортикоиды, андрогены и гестагены) или в клеточном ядре (эстрогены, гормоны щитовидной железы).
При связывании гормона открывается скрытый в норме участок белка рецептора, что дает возможность последнему связаться с особой последовательностью нуклеотидов ДНК в гене и регулировать его транскрипцию. Из этого следует, что комплексы лиганд-рецептор работают как факторы, регулирующие транскрипцию. Обычно происходит активация или усиление и, редко, блокада транскрипции.
Комплексы гормон-рецептор взаимодействуют парно с ДНК. Эти пары (димеры) могут состоять из двух идентичных комплексов гормон-рецептор (гомодимерная форма, например, с гормонами надпочечников или половыми гормонами). Комплекс тиреоидный гормон-рецептор встречается в гетеродимерной форме и сочетается с комплексом цис-ретиноевая кислота-рецептор.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Больная тема: часть I
Поделиться:
Мы начинаем цикл статей, посвящённых разным группам лекарственных препаратов. В них мы расскажем о том, как лекарства действуют на организм (это называется «фармакодинамика»), как они усваиваются и добираются до «больного места» (это изучает фармакокинетика) и как их правильно применять, чтобы помочь, а не навредить своему организму. Несмотря на профессиональную помощь врачей, в конечном итоге ответственность за своё здоровье несём мы сами. А значит, будет полезным иметь общее представление о том, что и зачем мы глотаем, запивая водой, а также намазываем, втираем, капаем и так далее. Если вам не удастся запомнить всё, что написано в этой статье, разом, обязательно сохраните её в закладках и при необходимости используйте как шпаргалку. И, конечно же, не забудьте поделиться ссылкой со своими друзьями и родственниками.
Что такое боль
Для того, чтобы понять, как работают обезболивающие средства (они же анальгетики), сперва необходимо получить представление о том, что такое боль. В норме боль – это защитный механизм человеческого тела, сигнализирующий о внешних и внутренних повреждениях. Он помогает сохранить целостность организма, вызывая инстинктивные реакции (отдёрнуть руку, отпрянуть и.т.д.) и провоцируя более сложные схемы поведения, такие как ограничение физической активности, визит к врачу и прочее.
Болевой импульс рождается в особых рецепторах – ноцицепторах (от лат. nocens – «вредный»). Ноцицепторы представляют собой окончания двух типов тонких нервных волокон – А и С.
А-ноцицепторы расположены преимущественно в коже и суставах и реагируют в основном на механические повреждения (сдавливание, укол, порез, разрыв и пр.) и иногда – на термические повреждения (ожоги).
В свою очередь, С-ноцицепторы более универсальны, так как реагируют и на механические, и на термические, и на химические раздражители. Они пронизывают всё тело человека. Именно они «отвечают» за боль во внутренних органах и глубинных тканях, а также за головную боль (менингеальные ноцицепторы). Очевидно, что внутри тела человека нет иголок или зажигалок, способных стать раздражителями. Вместо них выступают различные химические соединения, которые оказывают влияние на ноцицепторы. Особо активны химические раздражители при наличии воспаления – их называют «медиаторами воспаления».
Хорошо, с рецепторами разобрались, идём дальше. Импульс от раздражённого рецептора бежит по нервному волокну в спинной мозг. «Бежит» в данном случае не преувеличение: проводимость А-волокон (назовём их условно «кожными») колеблется в районе 3–45 м/сек., а проводимость С-волокон («внутренних») достигает 2 м/сек. Такая «разница в скорости» вполне объяснима: эволюционно внешние повреждения организма требуют моментальной реакции, так как связаны с нападением хищников.
На «входе» в спинной мозг импульсы попадают в своеобразные «ворота».
Похожее на студень скопление нервных клеток под названием «желатинозная субстанция», можно сказать, определяет – что уже считать болью, а что ещё нет.
Основной параметр – интенсивность поступающих с периферии импульсов. Если воздействие слабое, то желатинозная субстанция тормозит трактовые (проводящие) нейроны, и ощущения боли не возникает. В случае мощного потока импульсов она снижает свою собственную активность, и сигналы беспрепятственно проходят наверх, к «начальству» – головному мозгу. Получается, что желатинозная субстанция в спинном мозге – это своеобразный «менеджер среднего звена», от которого зависит эффективность всей системы.
Затем, наконец, импульс попадает в похожий на куриное яйцо таламус и в некоторые части коры головного мозга. В этот момент мы и говорим: «Ай!».
Мы будем не раз возвращаться к этой упрощённой схеме возникновения боли, потому что разные виды препаратов с обезболивающим эффектом действуют на различных этапах передачи сигнала – одни снижают интенсивность импульсов ещё на этапе рецепторов, а другие «глушат» их уже в спинном мозге.
Чтобы не запутаться
Существует несколько разных классификаций лекарственных препаратов, которые распределяют их по группам, исходя из той или иной логики. Мы не будем углубляться в эти тонкости и доказывать правоту той или иной классификации, а пойдём по простому пути, взяв за основу механизм достижения обезболивающего эффекта. Это позволяет нам выделить две основные группы обезболивающих: опиоидные и неопиоидные. Фактически «настоящими» анальгетиками можно считать именно опиоиды (морфин, фентанил, трамадол и пр.), в то время как все остальные препараты имеют комплексное предназначение, частью которого является анальгетический эффект. К примеру, неопиоидные по своей природе анальгетики-антипиретики (анальгин, парацетамол) – это, прежде всего, жаропонижающие препараты. На это недвусмысленно намекает содержащийся в этом слове корень «пир» (греч. – «огонь»). Обезболивание – это их второе свойство, наряду со способностью снижать температуру. А нестероидные противовоспалительные препараты (тоже не опиоиды) нужны прежде всего для борьбы с воспалением, следствием которой является ослабление боли.
Но опиоиды просто так в аптеке не купишь из-за их мощного эффекта и способности вызывать зависимость. Для их применения нужны достаточные основания и письменное назначение врача. Поэтому мы начнем с неопиоидных обезболивающих, объединённых единым принципом действия – с ингибиторов циклооксигеназы.
Важное предупреждение: все описываемые в статье особенности лекарств имеют общий характер и относятся к целым группам препаратов. То, как подействует конкретное лекарство именно на ваш организм, зависит от целого ряда факторов. Во-первых, у разных препаратов в рамках одной группы лекарственных средств могут существенно различаться и фармакодинамика («как работает»), и фармакокинетика («как усваивается»). Всё потому, что действующие вещества в этих лекарствах разные. Во-вторых, даже у одного и того же препарата фармакокинетика может быть разной в зависимости от лекарственной формы (например, таблетки или сироп). И третье – это индивидуальные особенности организма. Биохимия человеческого тела – это невероятно сложный комплекс процессов, «настройки» которого могут отличаться в зависимости от возраста, пола, перенесённых ранее болезней, режима питания и даже времени цикла у женщин. Поэтому не стоит принимать лекарства только на основе прочитанного в интернете и без какого-либо контроля врача. Это может быть не только неэффективным, но и опасным занятием.
Ингибиторы циклооксигеназы (ЦОГ) – принцип действия
Ингибиторами ЦОГ с обезболивающим эффектом являются препараты сразу двух формальных групп:
Антипиретики : метамизол натрия («Анальгин», «Баралгин» и т.д.), парацетамол («Панадол», «Эффералган» и пр.).
Нестероидные противовоспалительные средства (НПВС): диклофенак («Диклак», «Вольтарен»), пироксикам («Финалгель», «Хотемин» – оба для наружного применения), мелоксикам («Мовалис», «Генитрон»), ибупрофен («Нурофен, «МИГ», «Долгит» – наружное), кетопрофен («Кетонал», «Фастум» – наружное), напроксен («Мотрин», «Налгезин»), целекоксиб («Целебрекс», «Дилакса»), нимесулид («Нимесил», «Найз»).
Ингибиторы циклооксигеназы влияют на самый первый этап возникновения боли – раздражение рецепторов. Помните, мы говорили о том, что у сидящих глубоко в тканях тела С-ноцицепторов бывают химические раздражители? Вот с ними как раз и связан обезболивающий механизм действия ингибиторов ЦОГ. В теле человека существуют особые белки – простагландины. Помимо всякой другой полезной работы, они выполняют три функции, связанные с воспалением (будучи «медиаторами воспаления»): «выгоняют» жидкость из сосудов в межклеточную среду (отёк), усиливают локальный кровоток (покраснение и рост температуры) и раздражают ноцицепторы, вызывая ощущение боли.
Любые белки в организме человека образуются при помощи ферментов. А необходимыми для образования простагландинов ферментами как раз и являются те самые циклооксигеназы (ЦОГ). Ингибиторы ЦОГ временно «выключают» эти ферменты, тем самым сильно замедляя выработку простагландинов и снимая раздражение с ноцицепторов. Нет медиаторов воспаления – нет боли.
Но здесь есть один подвох. «Ответственной» за воспаление является только циклооксигеназа-2, а ее коллеги ЦОГ-1 и ЦОГ-3 влияют на выработку других, «безобидных» простаноидов (простагландины – это вид простаноидов). Например, тех, что участвуют в непрерывном восстановлении слизистой желудка. Большинство лекарств-ингибиторов ЦОГ «не разбираются» в номерах циклооксигеназ и «косят» всех подряд, таким образом вызывая целый ряд неприятных побочных эффектов, например, проблемы c желудком. Их называют неселективными ингибиторами ЦОГ. К ним относится большинство лекарств этого класса. И лишь самые передовые препараты этой группы ведут себя иначе – их называют селективными ингибиторами ЦОГ-2. Они прицельно подавляют лишь тот тип циклооксигеназы, который «помогает» воспалению (то есть ЦОГ-2), а остальные не трогают. Благодаря этому тяжесть побочных эффектов у этих лекарств существенно ниже. В качестве примера можно привести такие препараты, как целекоксиб, нимесулид и мелоксикам.
В следующей статье мы поговорим о том, как усваиваются ингибиторы ЦОГ (об их фармакокинетике), а также о том, как их правильно принимать, чтобы достичь максимального заявленного производителем эффекта. Следите за обновлениями на нашем сайте!
Марк Волков, редактор онлайн-журнала для фармацевтов и медицинских работников «Катрен Стиль».
Источник