- Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств» (с изменениями и дополнениями)
- С изменениями и дополнениями от:
- ГАРАНТ:
- Маркировка лекарственных средств
- Что вы узнаете
- Закон о маркировке лекарств
- Сроки
- Участники маркировки лекарств
- Производители
- Дистрибьюторы
- Аптеки
- Медцентры
- Схема работы
- Код маркировки — что это и как выглядит?
- Штрафы
- Как зарегистрироваться в системе маркировки?
- Аптекам
- Что нужно для маркировки
- Как принимать
- Как продавать
- Приложение на ваш смартфон
- 2D-cканер от 3 100 ₽
- Терминал сбора данных от 22 850 ₽
- Дистрибьюторам
- Стоматологиям и медцентрам
- Что нужно для маркировки
- Как принимать
- Как списывать
- Как получить регистратор выбытия?
Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств» (с изменениями и дополнениями)
Федеральный закон от 12 апреля 2010 г. N 61-ФЗ
«Об обращении лекарственных средств»
С изменениями и дополнениями от:
27 июля, 11 октября, 29 ноября 2010 г., 6 декабря 2011 г., 25 июня, 25 декабря 2012 г., 2 июля, 25 ноября 2013 г., 12 марта, 22 октября, 22 декабря 2014 г., 8 марта, 29 июня, 13 июля, 14, 29 декабря 2015 г., 2 июня, 3 июля 2016 г., 29 июля, 28 декабря 2017 г., 4 июня, 28 ноября, 27 декабря 2018 г., 6 июня, 26 июля, 2 августа, 27 декабря 2019 г., 26 марта, 1, 3 апреля, 13 июля, 8, 22 декабря 2020 г., 11 июня, 2 июля 2021 г.
Принят Государственной Думой 24 марта 2010 года
Одобрен Советом Федерации 31 марта 2010 года
ГАРАНТ:
См. комментарии к настоящему Федеральному закону
Президент Российской Федерации
12 апреля 2010 г.
Закреплены основные правила обращения лекарственных средств. Речь идет об их разработке, доклинических и клинических исследованиях, экспертизе, госрегистрации, стандартизации, изготовлении, хранении, перевозке, ввозе в Россию и вывозе из нее и др.
Закон о лекарственных средствах, принятый в 1998 г., потерял свою актуальность в связи с изменением ситуации в экономике.
Формируется единая государственная фармакопея. Определено ее содержание.
Закреплены новые правила госрегистрации лекарств. Она необходима в отношении оригинальных и воспроизведенных средств, новых комбинаций препаратов (зарегистрированных ранее), а также тех, которые произведены в других формах или новой дозировке.
Расширен перечень лекарств, не подлежащих госрегистрации. Речь идет о средствах, предназначенных для экспорта, о лекарственном растительном сырье, радиофармацевтических препаратах.
Регистрационное удостоверение на лекарственный препарат действует бессрочно. Однако на лекарство, которое в России регистрируется впервые, оно будет выдаваться на 5 лет.
Определен порядок проведения клинических исследований лекарственных препаратов. В них могут участвовать аккредитованные медорганизации.
Запрещается проводить испытания на детях-сиротах и детях, оставшихся без попечения родителей, на сотрудниках правоохранительных органов, лицах, находящихся в местах лишения свободы или СИЗО, и на некоторых других. Провести клиническое исследование на несовершеннолетних можно с письменного согласия родителей.
Жизнь и здоровье участников испытаний должны быть застрахованы. Установлены размеры соответствующих выплат (например, в случае смерти пациента — 2 млн руб.).
Вводится этическая экспертиза возможности клинического исследования лекарственного препарата.
На официальном Интернет-сайте должны будут размещаться список всех разрешенных и запрещенных лекарств, информация об экспертизе, регистрации, клинических исследованиях.
Признаны утратившими силу некоторые законодательные акты, в том числе Закон о лекарственных средствах (с учетом изменений).
Федеральный закон вступает в силу с 1 сентября 2010 г. Определены переходные положения, касающиеся госрегистрации, экспертизы лекарств, лицензий на их производство.
Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств»
Настоящий Федеральный закон вступает в силу с 1 сентября 2010 г.
Текст Федерального закона опубликован в «Российской газете» от 14 апреля 2010 г. N 78, в «Парламентской газете» от 16 апреля 2010 г. N 19-20, в Собрании законодательства Российской Федерации от 19 апреля 2010 г. N 16 ст. 1815
В настоящий документ внесены изменения следующими документами:
Федеральный закон от 2 июля 2021 г. N 317-ФЗ
Изменения вступают в силу с 1 сентября 2023 г.
См. будущую редакцию настоящего документа
Текст настоящего документа представлен в редакции, действующей на момент выхода установленной у Вас версии системы ГАРАНТ
Федеральный закон от 11 июня 2021 г. N 170-ФЗ
Изменения вступают в силу с 1 июля 2021 г. и с 1 марта 2022 г.
См. будущую редакцию настоящего документа
Текст настоящего документа представлен в редакции, действующей на момент выхода установленной у Вас версии системы ГАРАНТ
Федеральный закон от 22 декабря 2020 г. N 444-ФЗ
Изменения вступают в силу с 22 декабря 2020 г.
Федеральный закон от 8 декабря 2020 г. N 429-ФЗ
Изменения вступают в силу с 8 декабря 2020 г.
Федеральный закон от 13 июля 2020 г. N 206-ФЗ
Изменения вступают в силу с 13 июля 2020 г.
Федеральный закон от 3 апреля 2020 г. N 105-ФЗ
Изменения вступают в силу с 3 апреля 2020 г.
Федеральный закон от 1 апреля 2020 г. N 98-ФЗ
Изменения вступают в силу с 1 апреля 2020 г.
Федеральный закон от 26 марта 2020 г. N 67-ФЗ
Изменения вступают в силу с 26 марта 2020 г.
Федеральный закон от 27 декабря 2019 г. N 481-ФЗ
Изменения вступают в силу с 29 декабря 2020 г.
Федеральный закон от 27 декабря 2019 г. N 478-ФЗ
Изменения вступают в силу с 1 января 2021 г.
Федеральный закон от 27 декабря 2019 г. N 475-ФЗ
Изменения вступают в силу с 1 марта 2020 г., за исключением положений, для которых установлен иной срок вступления их в силу
См. будущую редакцию настоящего документа
Текст настоящего документа представлен в редакции, действующей на момент выхода установленной у Вас версии системы ГАРАНТ
Федеральный закон от 27 декабря 2019 г. N 462-ФЗ
Изменения вступают в силу с 28 декабря 2019 г.
Федеральный закон от 2 августа 2019 г. N 297-ФЗ
Изменения вступают в силу с 13 августа 2019 г.
Федеральный закон от 26 июля 2019 г. N 240-ФЗ
Изменения вступают в силу с 6 августа 2019 г.
Федеральный закон от 6 июня 2019 г. N 134-ФЗ
Изменения вступают в силу с 7 июня 2019 г.
Федеральный закон от 27 декабря 2018 г. N 511-ФЗ
Изменения вступают в силу с 7 января 2019 г.
Федеральный закон от 28 ноября 2018 г. N 449-ФЗ
Изменения вступают в силу с 28 ноября 2018 г. и с 29 ноября 2019 г.
Федеральный закон от 4 июня 2018 г. N 140-ФЗ
Изменения вступают в силу с 15 июня 2018 г.
Федеральный закон от 28 декабря 2017 г. N 425-ФЗ (в редакции Федерального закона от 27 декабря 2019 г. N 462-ФЗ)
Изменения вступают в силу с 28 декабря 2019 г., за исключением абзацев второго, пятого и девятого подпункта «б» пункта 7 статьи 1 изменений, вступающих в силу с 1 июля 2020 г.
Федеральный закон от 28 декабря 2017 г. N 425-ФЗ (в редакции Федерального закона от 28 ноября 2018 г. N 449-ФЗ)
Изменения вступают в силу с 1 января 2018 г., за исключением абзацев второго, пятого и девятого подпункта «б» пункта 7 статьи 1 изменений, вступающих в силу с 1 января 2020 г.
Федеральный закон от 29 июля 2017 г. N 278-ФЗ
Изменения вступают в силу с 1 января 2018 г.
Федеральный закон от 29 июля 2017 г. N 242-ФЗ
Изменения вступают в силу с 1 января 2018 г.
Федеральный закон от 3 июля 2016 г. N 261-ФЗ
Изменения вступают в силу с 1 января 2017 г.
Федеральный закон от 3 июля 2016 г. N 350-ФЗ
Изменения вступают в силу по истечении 10 дней после дня официального опубликования названного Федерального закона
Федеральный закон от 3 июля 2016 г. N 305-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 2 июня 2016 г. N 163-ФЗ
Изменения вступают в силу по истечении 10 дней после дня официального опубликования названного Федерального закона
Федеральный закон от 29 декабря 2015 г. N 389-ФЗ
Изменения вступают в силу c 1 января 2016 г.
Федеральный закон от 14 декабря 2015 г. N 374-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 13 июля 2015 г. N 262-ФЗ
Изменения вступают в силу c 1 января 2016 г.
Федеральный закон от 13 июля 2015 г. N 233-ФЗ
Изменения вступают в силу по истечении 10 дней после дня официального опубликования названного приказа
Федеральный закон от 13 июля 2015 г. N 241-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 29 июня 2015 г. N 160-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 8 марта 2015 г. N 34-ФЗ
Изменения вступают в силу с 1 июля 2015 г., за исключением изменения, вступающего в силу с 16 марта 2015 г.
Федеральный закон от 22 декабря 2014 г. N 429-ФЗ (в редакции Федерального закона от 13 июля 2015 г. N 241-ФЗ)
Федеральный закон от 22 декабря 2014 г. N 429-ФЗ
Изменения вступают в силу с 1 июля 2015 г., за исключением положений, вступающих в силу с 1 января 2016 г., и положений, вступающих в силу с 1 января 2017 г.
Федеральный закон от 22 октября 2014 г. N 313-Ф3
Изменения вступают в силу по истечении тридцати дней после дня официального опубликования названного Федерального закона, за исключением подпунктов «а» и «б» пункта 5 статьи 1 изменений, вступающих в силу с 1 января 2015 г.
Федеральный закон от 12 марта 2014 г. N 33-ФЗ
Изменения вступает в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 25 ноября 2013 г. N 317-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 2 июля 2013 г. N 185-ФЗ
Изменения вступают в силу с 1 сентября 2013 г.
Федеральный закон от 25 декабря 2012 г. N 262-ФЗ
Изменения вступают в силу по истечении ста восьмидесяти дней после дня официального опубликования названного Федерального закона
Федеральный закон от 25 июня 2012 г. N 93-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 6 декабря 2011 г. N 409-ФЗ
Изменения вступают в силу по истечении тридцати дней после дня официального опубликования названного Федерального закона
Федеральный закон от 29 ноября 2010 г. N 313-ФЗ
Изменения вступают в силу с 1 января 2011 г., за исключением изменений, вступающих в силу со дня официального опубликования названного Федерального закона
Федеральный закон от 11 октября 2010 г. N 271-ФЗ
Изменения вступают в силу по истечении 10 дней после дня официального опубликования названного Федерального закона.
Часть 6 статьи 18 настоящего Федерального закона применяется к правоотношениям, возникшим после дня вступления в силу для Российской Федерации протокола о присоединении Российской Федерации к Всемирной торговой организации
Федеральный закон от 27 июля 2010 г. N 192-ФЗ
Изменения вступают в силу со дня официального опубликования названного Федерального закона
Источник
Маркировка лекарственных средств
В 2020 году вводится обязательная маркировка лекарственных препаратов. Рассказываем, что нужно сделать и подключить и как работать дальше.
Нет времени разбираться? Поможем!
Что вы узнаете
Закон о маркировке лекарств
425-ФЗ от 28 декабря 2017 года вносит изменения в закон «Об обращении лекарственных средств». Он обязывает маркировать лекарства средствами идентификации, а участников оборота отчитываться в систему Мониторинга движения лекарственных препаратов (МДЛП) обо всех операциях с маркированными лекарствами.
Сроки
- С 1 июля 2019 началась регистрация участников оборота на Честныйзнак.рф.
- С 1 октября 2019 введена обязательная маркировка для лекарственных препаратов из списка высокозатратных нозологий.
- С 1 июля 2020 начнется обязательная маркировка всех выпускаемых лекарств и передача сведений по ним в систему маркировки.
Специалист ЦРПТ расскажет, как работать в системе «Честный знак» с 1 июля 2020, а эксперт СБИС покажет весь процесс от приемки до продажи в СБИС.
Участники маркировки лекарств
Производители
регистрируют произведенные лекарства, отчитываются о введении нового кода в оборот.
Дистрибьюторы
регистрируют получение препарата и передачу его далее по цепочке.
Аптеки
фиксируют прием препарата от дистрибьютора, продажу конечному клиенту на кассе.
Медцентры
отмечают поступление препарата от дистрибьютора, списания для оказания медуслуг.
Схема работы
Поставщики и ЦРПТ договорились о существовании обратной схемы маркировки – когда аптека передает коды дистрибьютору, а не наоборот.
1. Производитель получает коды в системе маркировки и размещает их на упаковках лекарств.
2. При отгрузке производитель отправляет дистрибьютору вместе с товаром список кодов с упаковок.
3. Дистрибьютор принимает товар как обычно и подтверждает получение кодов. Далее фасует товар и отправляет в аптеку.
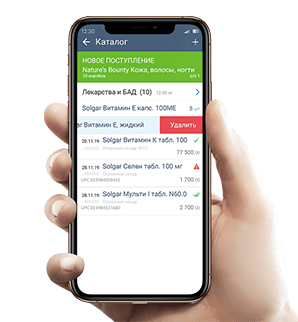
4. Аптека при приемке сканирует коды с упаковок лекарств.
5. После отправляет коды в МДЛП поставщику для подтверждения.
6. При продаже провизор сканирует код маркировки на упаковке, оператор фискальных данных отправляет его в систему маркировки. Код выбывает из оборота.
Также поддерживается и прямой порядок, по которому поставщик отправляет поступление вместе с кодами, а аптека сверяет их и утверждает.
Код маркировки — что это и как выглядит?
Каждый препарат маркируют уникальным двумерным Data Matrix кодом, его наносят на упаковку с лекарством.
Общая длина ― 83 символа. В нем содержится:
- код товара: «01» + 14 символов GTIN ― международного кода маркировки
- индивидуальный серийный номер: «21» + 13 символов ― он генерируется оператором системы
- ключ проверки: «91» + 4 символа
- код проверки: «92» + 44 символа
Рекомендованный размер кода Data Matrix ― 16х16 мм. Но можно и меньшего размера ― ЦРПТ провел успешные тесты с марками 10х10 и 12х12 мм.
На большую транспортную тару (коробка, паллеты) наносят коды формата GS1 128. Такой код содержит данные обо всех упаковках внутри.
Штрафы
Незарегистрированные в МДЛП организации будут оштрафованы, сумму штрафа пока не определили. Нарушителей будут выявлять без выездных проверок, а просто при сопоставлении двух баз данных – лицензирования и регистрации в системе МДЛП.
Как зарегистрироваться в системе маркировки?
Для регистрации нужна усиленная квалифицированная электронная подпись на носителе Рутокен.
Установите необходимое ПО:
- операционная система Windows 7 / Mac OS X 10.8 или новее
- браузер Google Chrome, Mozilla Firefox, Opera, Internet Explorer 11, Safari
- плагин КриптоПро. Скачать
- сертифицированное СКЗИ
Если вы правильно настроили рабочее место ( см.пункт 1 ), система предложит ввести личные данные.
- Нажмите «Сертификат УКЭП» и выберите сертификат вашей электронной подписи.
- Автоматически заполнятся поля: «Субъект РФ», «Адрес электронной почты», «ИНН», «Имя» и «Фамилия».
- Заполните сведения о лицензии на медицинскую и фармацевтическую деятельность.
Аптекам
Что нужно для маркировки
Подключение к системе маркировки, чтобы отправлять туда коды.
Обновить прошивку онлайн-кассы, чтобы добавлять код маркировки в чек.
Подключение кассы к ОФД, которые умеют передавать чеки с кодами в систему маркировки.
Оборудование для сканирования марок на кассе и на складе.
Маркировка «под ключ»
Как принимать
При приемке нужно отсканировать все коды с упаковок лекарств и отправить их в систему маркировки и поставщику для подтверждения.
Если работаете в СБИС, то после сканирования вы просто нажмете кнопку «Отправить коды», и данные автоматически зарегистрируются в МДЛП и передадутся поставщику.
Как продавать
Продавать маркированные лекарства нужно через онлайн-кассу с ОФД: провизор сканирует код с упаковки, товар добавится в чек, а оператор фискальных данных отправит его в систему маркировки. Если марки нет – фармацевт сканирует штрихкод, и продает лекарство как раньше.
Приложение на ваш смартфон
Для небольших складов
Просто установите на него приложение СБИС Доки.
+ работает без привязки к компьютеру
+ сразу видно результаты проверки
— небольшая скорость сканирования
2D-cканер от 3 100 ₽
Для средних складов
+ высокая скорость сканирования
— работа только с компьютером
— ограниченная дальность действия
Терминал сбора данных от 22 850 ₽
Для больших складов
+ работает без привязки к компьютеру
+ высокая скорость сканирования
Дистрибьюторам
При обратном порядке акцептования дистрибьютору нужно только подтвердить коды, полученные от аптеки. Если вы работаете в СБИС, то вам даже этого делать не нужно. Сервис сам получит коды от аптек, автоматически подтвердит их и отправит в МДЛП – вы будете оформлять документы, как обычно.
Подключим к системе маркировки
Стоматологиям и медцентрам
Что нужно для маркировки
Подключение к системе маркировки, чтобы отправлять туда коды.
2D-сканер для проверки марок и приемки лекарств от поставщика.
Регистратор выбытия — устройство, фиксирующее выбытие маркированного лекарства из оборота при выдаче пациенту.
Как принимать
Маркировка лекарств в стоматологии, больнице и медицинском центре с точки зрения приемки ничем не отличается от аптек — сканируем коды с упаковок лекарств, передаем данные в МДЛП и поставщику.
Как списывать
Медицинские учреждения, которые используют препараты для оказания медицинских услуг, списывают лекарства с помощью регистратора выбытия. Перед вскрытием упаковки сканируем код с упаковки, и данные отправятся в МДЛП.
Как получить регистратор выбытия?
Регистратор получают бесплатно в ЦРПТ. Для этого в личном кабинете Честного знака необходимо оформить заявку и договор по инструкции. Наши специалисты могут помочь оформить необходимые документы — звоните.
Источник