- Регистрация лекарственных средств по правилам еаэс 2021
- Информация Евразийской экономической комиссии от 31 декабря 2020 г. «Что изменится в регулировании доступа лекарственных препаратов на рынок ЕАЭС с 1 января 2021 года»
- Обзор документа
- Информация Коллегии ЕЭК от 03.01.2021 «Что изменится в регулировании доступа лекарственных препаратов на рынок ЕАЭС с 1 января 2021 года»
- Регистрация медицинских изделий по правилам ЕАЭС
- Нормативная база регистрации медицинских товаров по правилам ЕАЭС
- Актуальные правила регистрации медицинских товаров
- Регистрация медицинских продуктов в 2021 году и далее
- Льготная перерегистрация до 2026 года
Регистрация лекарственных средств по правилам еаэс 2021
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.
Программа разработана совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Информация Евразийской экономической комиссии от 31 декабря 2020 г. «Что изменится в регулировании доступа лекарственных препаратов на рынок ЕАЭС с 1 января 2021 года»
На правовом портале Евразийского экономического союза опубликовано решение Совета Евразийской экономической комиссии от 23 декабря о продлении на шесть месяцев (до 1 июля 2021 года) возможности для фармацевтических производителей выбирать регистрацию новых лекарств по национальной процедуре в четырех союзных государствах (Республике Армения, Республике Беларусь, Республике Казахстан и Кыргызской Республике).
Это означает, что с 1 января по 30 июня 2021 года в названных странах сохранится возможность регистрации лекарственных препаратов по национальным процедурам. 30 июня 2021 года — последний день, когда заявители смогут подать документы на регистрацию новых лекарственных препаратов в соответствии с законодательством государств ЕАЭС. Завершится один из основных переходных периодов общего рынка лекарственных средств для медицинского применения.
С 1 июля 2021 года (а в Российской Федерации — с 1 января 2021 года) новые лекарственные препараты (то есть лекарственные препараты, не имеющие действующих регистрационных удостоверений государств-членов Союза) могут быть зарегистрированы только в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения, утвержденными Решением Совета ЕЭК N 78 от 3 ноября 2016 года
До 31 декабря 2025 года для лекарственных препаратов, зарегистрированных в странах Союза, будут доступны процедуры внесения изменений и подтверждения регистрации, а также продление срока действия регистрационного удостоверения для срочных регистрационных удостоверений в соответствии с законодательством государств ЕАЭС.
Участники союзного рынка должны учитывать, что все регистрационные удостоверения, выданные по «национальным» правилам государств-членов, действительны до окончания срока их действия, но не позднее 31 декабря 2025 года.
Производителям, которые еще не сделали в связи с этим необходимых шагов, необходимо спланировать процесс внесения изменений в регистрационное досье для перехода к наднациональному регулированию, выбрать референтное государство, которое будет проводить экспертизу всех материалов досье и лабораторную оценку качества препарата, и уложиться с подачей документов по процедуре приведения в соответствие с требованиями международных договоров и актов, составляющих право Союза, в срок до 31 декабря 2025 года.
На общем рынке лекарственных средств ЕАЭС могут обращаться лекарственные препараты, качество, эффективность и безопасность которых оценена в соответствии с требованиями Союза, учитывающими наилучшие мировые практики. Это обеспечивается обязательным соблюдением надлежащих практик (GxP), подтверждается документами регистрационного досье, подготовленного в формате CTD, и полученными результатами лабораторной оценки качества образцов лекарственного препарата.
Обзор документа
С 1 января 2021 г. изменилось регулирование доступа лекарств на рынок ЕАЭС.
В частности, до 1 июля 2021 г. фармпроизводители могут выбирать регистрацию новых лекарств по национальной процедуре в Армении, Беларуси, Казахстане и Кыргызстане.
С 1 июля (а в России — с 1 января) новые препараты могут быть зарегистрированы только в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения, утвержденными Решением Совета ЕЭК в 2016 г.
До 31 декабря 2025 г. для препаратов, зарегистрированных в странах ЕАЭС, будут доступны процедуры внесения изменений и подтверждения регистрации, а также продление срока действия регистрационного удостоверения для срочных регистрационных удостоверений в соответствии с законодательством государств Союза.
Источник
Информация Коллегии ЕЭК от 03.01.2021 «Что изменится в регулировании доступа лекарственных препаратов на рынок ЕАЭС с 1 января 2021 года»
На правовом портале Евразийского экономического союза опубликовано решение Совета Евразийской экономической комиссии от 23 декабря о продлении на шесть месяцев (до 1 июля 2021 года) возможности для фармацевтических производителей выбирать регистрацию новых лекарств по национальной процедуре в четырех союзных государствах (Республике Армения, Республике Беларусь, Республике Казахстан и Кыргызской Республике).
Это означает, что с 1 января по 30 июня 2021 года в названных странах сохранится возможность регистрации лекарственных препаратов по национальным процедурам. 30 июня 2021 года — последний день, когда заявители смогут подать документы на регистрацию новых лекарственных препаратов в соответствии с законодательством государств ЕАЭС. Завершится один из основных переходных периодов общего рынка лекарственных средств для медицинского применения.
С 1 июля 2021 года (а в Российской Федерации — с 1 января 2021 года) новые лекарственные препараты (то есть лекарственные препараты, не имеющие действующих регистрационных удостоверений государств-членов Союза) могут быть зарегистрированы только в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения, утвержденными Решением Совета ЕЭК N 78 от 3 ноября 2016 года.
До 31 декабря 2025 года для лекарственных препаратов, зарегистрированных в странах Союза, будут доступны процедуры внесения изменений и подтверждения регистрации, а также продление срока действия регистрационного удостоверения для срочных регистрационных удостоверений в соответствии с законодательством государств ЕАЭС.
Участники союзного рынка должны учитывать, что все регистрационные удостоверения, выданные по «национальным» правилам государств-членов, действительны до окончания срока их действия, но не позднее 31 декабря 2025 года.
Производителям, которые еще не сделали в связи с этим необходимых шагов, необходимо спланировать процесс внесения изменений в регистрационное досье для перехода к наднациональному регулированию, выбрать референтное государство, которое будет проводить экспертизу всех материалов досье и лабораторную оценку качества препарата, и уложиться с подачей документов по процедуре приведения в соответствие с требованиями международных договоров и актов, составляющих право Союза, в срок до 31 декабря 2025 года.
На общем рынке лекарственных средств ЕАЭС могут обращаться лекарственные препараты, качество, эффективность и безопасность которых оценена в соответствии с требованиями Союза, учитывающими наилучшие мировые практики. Это обеспечивается обязательным соблюдением надлежащих практик (GxP), подтверждается документами регистрационного досье, подготовленного в формате CTD, и полученными результатами лабораторной оценки качества образцов лекарственного препарата.
Источник
Регистрация медицинских изделий по правилам ЕАЭС
Российская Федерация наряду с еще четырьмя государствами, включая Казахстан, Кыргызстан, Армению и Беларусь уже много лет входит в состав союзного объединения, которое сейчас называется Евразийским экономическим союзом.
Российская Федерация наряду с еще четырьмя государствами, включая Казахстан, Кыргызстан, Армению и Беларусь уже много лет входит в состав союзного объединения, которое сейчас называется Евразийским экономическим союзом. Основной целью его создания было упрощение процедур, необходимых для взаимной торговли, увеличение товарооборота между странами и активизация других видов экономического взаимодействия. Эти установки применяются к разным сегментам рынка, и сегодня в их число входят и особые категории товаров – например, продукты медицинского назначения.
Специфика этой группы товаров состоит в том, что они потенциально несут с собой серьезный риск для здоровья пациента – например, в случае нарушения действующих требований к правилам их производства или качественным характеристикам. Поэтому во всем мире параметры качества и безопасности медизделий контролируются на государственном уровне. Разумеется, такой контроль существовал и в странах, входящих в состав ЕАЭС, еще до его создания.
Однако при переходе на рельсы интенсивного сотрудничества в этой сфере возникли довольно серьезные сложности. Они были связаны с тем, что в каждой стране действовали собственные правила и требования к продуктам медицинского назначения. Поэтому в процессе формирования общего рынка медизделий страны – участницы ЕАЭС должны были провести серьезную работу по унификации действующих требований и согласованию их со всеми членами союзного объединения.
Сегодня эта работа уже близка к завершению. Стороны договорились о механизмах государственного контроля качества, безопасности и действенности продуктов медицинского назначения, а также выработали устраивающий всех порядок перехода к новым правилам.
Нормативная база регистрации медицинских товаров по правилам ЕАЭС
Основным нормативным документом, который устанавливает общие правила регистрации товаров медицинского назначения в ЕАЭС, становится Решение Совета ЕЭК от 12 февраля 2016 г. N 46. Однако, как это обычно делается и в национальных законодательных базах, отдельные аспекты его применения и процедурные вопросы часто регулируются дополнительными правовыми актами. В этом случае в роли таких документов выступают:
- распоряжение Коллегии ЕЭК от 12.11.2018 N 176, устанавливающее правила допуска уполномоченных организаций к проведению испытаний медицинских товаров для их регистрации и ведения реестра таких организаций;
- рекомендация Коллегии ЕЭК от 21.05.2019 N 14, уточняющая правила выполнения обязательной экспертизы качества, безопасности и действенности медицинского товара;
- решение Коллегии ЕЭК от 21.08.2018 N 135, содержащее классификатор типов документов, предоставляемых в составе регистрационного досье;
- распоряжение Коллегии ЕЭК от 02.04.2019 N 56 о правилах ведения единого реестра медизделий, прошедших процедуру госрегистрации;
- другие нормативные документы.
При этом в целях регулирования и уточнения переходных положений процесса госрегистрации товаров медицинского назначения в этой области нередко принимаются новые правовые акты, вносящие некоторые изменения в действующие правила.
Актуальные правила регистрации медицинских товаров
Решение № 46 вступило в силу в 2016 году, и с этого момента в области регистрации медицинских продуктов параллельно действуют два механизма. С одной стороны, чтобы облегчить производителям переход к новым правилам учета, законодатели ЕАЭС временно сохранили национальную процедуру регистрации. С другой стороны, те производители или продавцы, которые уже сегодня знают, что им потребуется выводить свои товары на рынки других стран, входящих в ЕАЭС, могут сразу подать заявление о регистрации по общесоюзным правилам и получить регистрационное удостоверение, которое будет действовать во всех странах-участницах.
Впрочем, переход к новым требованиям – это всегда сложно, поэтому на практике организации, которым нужно получить РУ, пока еще в большинстве ситуации предпочитают пользоваться возможностью зарегистрировать свои продукты по старым, национальным правилам. Действительно, такая возможность у них есть, однако документ, полученный в результате этой процедуры, будет действовать только на территории конкретного государства. Это, впрочем, не особенно смущает заявителей: так, в официальном реестре Росздравнадзора, который занимается регистрацией медизделий в России, за период с 1 января по 20 августа 2020 года появилось более 3,5 тысяч новых записей о регистрации.
А вот смельчаков, который взяли на себя ответственность от начала до конца пройти процесс регистрации по правилам ЕАЭС, пока немного. Собственно, до логической точки этой процедуры, то есть получения действующего регистрационного удостоверения, согласно информации, содержащейся в Едином реестре медизделий, поставленных на учет в Евразийском экономическом союзе, пока дошли только … два заявителя. Кстати, они оба из России. Первый из них – это ООО «НПО «Диагностические системы»», которое получило удостоверение на набор спецреагентов для количественного определения свободного тироксина, второй – АО «ПО «УМЗ»», получившее документ для фототерапевтического неонатального облучателя. Оба продукта относятся к классу риска потенциального применения 2а, то есть характеризуются средней опасностью для здоровья пациента.
Регистрация медицинских продуктов в 2021 году и далее
Учитывая, что на дворе уже 2020 год, становится ясно, что производителей нужно как-то стимулировать к тому, чтобы переходить к новым правилам регистрации: иначе подавляющее большинство из них так и будет получать РУ по национальным правилам, тем самым тормозя развитие общего рынка медизделий в ЕАЭС. И действительно, такой механизм предусмотрен союзным законодательством в этой сфере – причем его действие мы заметим очень скоро.
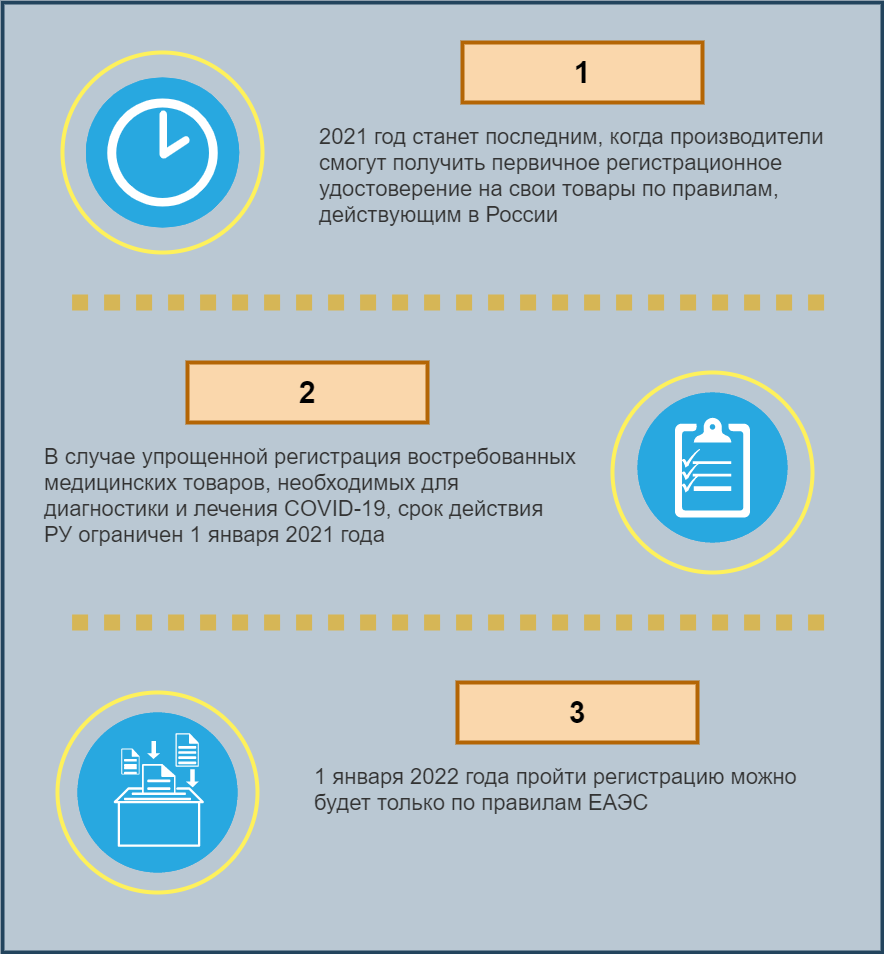
Дело в том, что параллельное существование двух вариантов регистрации и возможность выбора между ними по желанию заявителя – это временная мера, введенная в рамках переходного периода. Срок ее действия ограничен, и он заканчивается 31 декабря 2021 года. Таким образом, 2021 год станет последним, когда производители смогут получить первичное регистрационное удостоверение на свои товары по правилам, действующим в России. Они, кстати, определены постановлением Правительства от 27 декабря 2012 года N 1416.
Однако это еще не конец истории. Казалось бы, все просто: с 1 января 2022 года пройти регистрацию можно будет только по правилам ЕАЭС. Но, наблюдая за ходом развития события в течение переходного периода, законодатели Союза убедились в том, что переход к новым правилам для игроков рынка выглядит чрезвычайно сложным, и решили дать им еще одно небольшое послабление. Оно сформулировано в Распоряжение №142 Коллегии ЕЭК от 02.09.2019 г. Идея этой маленькой уступки состоит в том, чтобы в течение еще пяти лет после окончания переходного периода производители, имеющие на руках временные регистрационные удостоверения, выданные по национальным правилам до 31 декабря 2021 года, могли пройти процедуру перерегистрации своих товаров и получить новый регистрационный документ – с ограничением или без ограничения срока действия, смотря что на этот счет говорят национальные правила.
При этом, однако, нужно учитывать, что по законодательству Российской Федерации заявителям в большинстве случаев оформляются бессрочные регистрационные удостоверения. Исключение составляет только один вариант…
Льготная перерегистрация до 2026 года
Итак, согласно постановлению № 1416 медицинские товары, проходящие регистрацию в рамках стандартной процедуры, получают РУ без ограничения срока действия. Однако в связи с распространением коронавирусной инфекции в России сейчас введен временный упрощенный порядок госрегистрации для некоторых видов самых нужных товаров. Если точнее, сейчас в стране действуют два таких механизма:
- ускоренная регистрация защитных продуктов низкого класса риска в соответствии с постановлением Правительства от 18 марта 2020 г. N 299. По этой процедуре РУ могут получить только конкретные товары из списка, приведенного в приложении к документу; он включает 36 позиций;
- упрощенная регистрация востребованных медицинских товаров, необходимых для диагностики и лечения COVID-19, введенная постановлением Правительства от 3 апреля 2020 года N 430. Такая возможность доступна для более чем 360 видов продуктов, перечисленных в приложении к постановлению.
По второй процедуре предусмотрена выдача временных регистрационных удостоверений на партии товаров. Срок действия таких документов ограничен 1 января 2021 года. Поэтому производители, у которых истек срок действия РУ, должны будут получать новое уже в стандартном порядке. А учитывая, что до конца переходного периода по правилам ЕАЭС останется еще целый год, они по-прежнему смогут выбирать, проходить ли им госрегистрацию по национальным правилам или по стандартам ЕАЭС.
А вот с первой процедурой ситуация складывается интереснее. Дело в том, что, в отличие от второго постановления, которое однозначно имеет временный характер и ограниченный срок действия, первое постановление не содержит таких условий. Более того, оно не носит статус отдельного нормативного документа, а вносит изменения в главный правовой акт, регулирующий правила регистрации МИ в России – постановление № 1416.
Предполагаемая им процедура дает возможность получения на защитные товары низкого класса риска временного регистрационного удостоверения со сроком действия 150 дней. Фактически оно выдается «авансом», на основании небольшого пакета документов, представленного заявителем, который даже не включает результаты испытаний. Зато к моменту окончания этого периода заявитель должен провести все требуемые исследования и доказать качество, действенность и безопасность своего продукта: тогда он сможет обменять временное РУ на бессрочное.
Так вот, в принципе такая ситуация может подпасть под действие временного порядка, предусмотренного распоряжением № 142, но только при одновременном соблюдении следующих условий:
- продукт заявителя входит в список из 36 позиций, приведенных в приложении к постановлению № 299;
- заявитель получил временное РУ до 31 декабря 2021 года;
- срок действия временного РУ истекает после 31 декабря 2021 года;
- заявитель хочет работать только на российском рынке, поэтому ему достаточно национального регистрационного удостоверения.
В этом случае он сможет воспользоваться предложением законодателей ЕАЭС и пройти перерегистрацию по национальным правилам, получив РУ российского образца, и после 31 декабря 2021 года. А вот в других обстоятельствах такая опция производителям будет уже недоступна – во всяком случае, если российское Правительство до тех пор не введет новые возможности по выдаче временных регистрационных удостоверений.
До 31 декабря 2021 года
с 1 января 2022 года по 31 декабря 2026 года
Источник
(1).jpg)