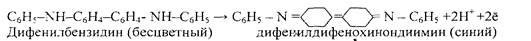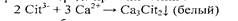Реагент раствор дифениламина является качественным для лекарственного препарата
Дифениламин используется в различных отраслях промышленного органического синтеза при производстве красителей, вводится в качестве добавки как стабилизатор эпоксидных смол, поливинилхлорида и пр. Также дифениламин используется как индикатор в аналитической химии, ингибитор коррозии, стабилизатор пироксилиновых (бездымных) порохов [1]. При производстве выстрела дифениламин в микроколичествах отлагается на ладонях и тыльных поверхностях рук стрелявшего человека, его одежде, а также на пораженном объекте и на предметах вещной обстановки места происшествия. Идентификация микроколичеств дифениламина является важной задачей при проведении судебной криминалистической экспертизы, для решения которой используется метод хроматомасс-спектрометрии [2]. Однако недостатком данного метода является малая чувствительность, высокая стоимость аналитического оборудования и отсутствие методики количественного определения дифениламина. В связи с этим встает вопрос о разработке нового способа определения дифениламина.
В последние годы в практике широко используется инверсионная вольтамперометрия, так как обладает высокой чувствительностью, отличается простотой анализа, экспрессностью и доступностью. Многообразие применяемых электродов позволяет проводить определение органических и неорганических элементов и веществ с высокой точностью. Так, инверсионная вольтамперометрия активно используется при исследовании объектов пищевой, косметической, фармацевтической, нефтедобывающей и нефтеперерабатывающей промышленности, экологии, сельского хозяйства и медицины [3–5].
На сегодняшний день изучено электрохимическое поведение большинства катионов металлов, многих анионов минеральных и органических кислот, а также некоторых фармацевтических препаратов и красителей, что нашло свое практическое применение в аналитической химии [6]. Кроме того, современные представления об органических веществах позволяют предположить, что многие токсичные вещества, биологически активные соединения, взрывчатые вещества способны участвовать в электрохимической реакции, однако этот вопрос недостаточно изучен. Все это позволяет предположить, что вольтамперометрический анализ может быть успешно применен в криминалистике для определения продуктов выстрела, в частности дифениламина.
Целью работы является исследование вольтамперометрического поведения дифениламина на стеклоуглеродном электроде, выбор основных рабочих условий и разработка методики вольтамперометрического определения дифениламина в продуктах выстрела.
Вольтамперометрическое определение дифениламина основано на процессе электродного концентрирования дифениламина на поверхности рабочего стеклоуглеродного электрода с последующим растворением (окислением) и одновременной регистрации пика дифениламина при потенциале, характерном для него.
В качестве индикаторного электрода нами был выбран стеклоуглеродный электрод (СУЭ). Стеклоуглеродный электрод был выбран из-за его высокой электрохимической и химической устойчивости, широкого диапазона рабочих потенциалов, и простотой механического обновления его поверхности. Стеклоуглерод в настоящее время является наиболее перспективным электродным материалом в электроаналитической химии. Известно несколько разновидностей стеклоуглерода, выпускаемых в различных странах. Общими для всех марок стеклоуглерода является высокая химическая устойчивость в агрессивных средах, беспористость и высокая твердость. По своим электрохимическим свойствам индикаторные электроды из различных марок стеклоуглерода отличаются по значению остаточного тока и интервалу рабочих потенциалов.
Для вольтамперометрического определения дифениламина на модельных растворах экспериментально были выбраны рабочие условия (фоновый электролит, потенциал и время электролиза, скорость изменения потенциала). В качестве фонового электролита был подобран раствор 0,2 М натрия фосфорнокислого двузамещенного (Na2HPO4). Указанный фоновый электролит и его концентрация подобраны экспериментально.
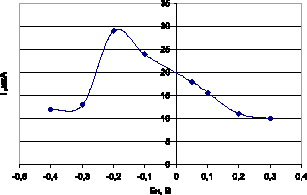
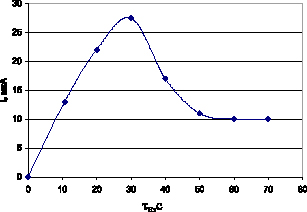
На стеклоуглеродном электроде исследована кинетика накопления дифениламина. На рис. 1 и 2 показаны зависимости тока дифениламина (I, мкА) от потенциала накопления (Ен, В) и времени накопления (τн, с). Потенциал накопления варьировали в диапазоне от –0,3 В до 0,3 В. Время накопления варьировали от 0 с до 70 с.
Рис. 1. Зависимость тока дифениламина от потенциала накопления на СУЭ
Рис. 2. Зависимость тока дифениламина от времени накопления на СУЭ
Из рис. 1 видно, что область предельного тока дифениламина находится в диапазоне потенциала накопления от –0,2 В до 0,1 В. Нами выбран потенциал накопления Ен = – 0,2 В, который находится в этом диапазоне.
Выбор времени накопления (τн) зависит от концентрации дифениламина в растворе: чем она меньше, тем необходимо больше τн для получения хорошо измеряемого сигнала. На рис. 2 показано, что величина аналитического сигнала дифениламина слабо зависит от времени накопления. Накопление дифениламина проводили при потенциале –0,2÷–0,3 В и при этих значениях потенциала дифениламин, по-видимому, адсорбционно концентрируется на поверхности СУЭ и преимущественно находится в восстановленной форме. Поэтому целесообразно использовать время накопления τн = 30 с.
Рабочим значением скорости развертки поляризующего напряжения является w = 55 мВ/с. При более высоких скоростях чувствительность определения повышается незначительно, но форма аналитического сигнала дифениламина искажается. Установленные значения Ен и τн позволяют регистрировать хорошо воспроизводимые пики дифениламина с четко выраженным максимумом.
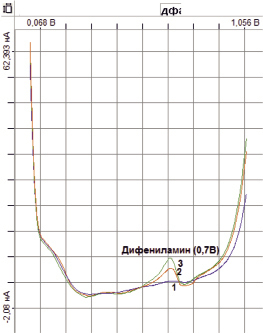
Таким образом, нами подобраны условия вольтамперометрического определения дифениламина на СУЭ (рис. 3), основанный на накоплении дифениламина в течение 30 с при потенциале накопления Ен = – 0,2 В относительно ХСЭ на фоне 0,2М Na2HPO4, с удалением кислорода из фонового электролита продувкой азота, с последующей регистрацией аналитического сигнала при ступенчатом изменении потенциала 0,0*1,1 В в режиме первой производной тока по потенциалу.
Методом добавки аттестованной смеси определяли концентрацию дифениламина по высоте пика при потенциале аналитического сигнала (0,7 ± 0,05)В.
Проведена проверка правильности предложенной методики с помощью метода «введено – найдено», погрешность анализа составила не более 15 %. Диапазон определяемых содержаний составлял от 0,001 до 15 мг/л, диапазон линейных значений – от 0,001 до 0,054 мг/л.
Для вольтамперометрического определения дифениламина в продуктах выстрела необходима стадия пробоподготовки, которая заключается в переводе дифениламина с объекта-носителя в раствор путем экстракции. В качестве объекта-носителя, содержащего продукты выстрела, в частности дифениламин, использовали мишени из бязи с пулевым повреждением, подготовленные специальным образом. Для этого производили серию отстрелов из пистолета Макарова калибра 9 мм патронами с пулей со свинцовым сердечником по мишеням из бязи с различных дистанций. Выстрелы производили по трем мишеням для каждой дистанции, с углом наклона траектории полета пули к плоскости мишени, равным 90 °. Далее изучали влияние природы растворителя и времени на полноту экстракции дифениламина. В качестве растворителей нами были выбраны: 7 %-й раствор азотной кислоты, дистиллированная вода, ацетон, этиловый спирт. Эффективность экстракции оценивали путем вольтамперометрического измерения аналитического сигнала дифениламина на стеклоуглеродном электроде в подобранных условиях и определения концентрации методом добавки через 5, 15, 24, 36 часов после экстракции.
Этиловый спирт является достаточно эффективным растворителем для извлечения дифениламина, а также после 24 часов экстракции извлекается максимально возможное количество дифениламина. В то же время использование раствора азотной кислоты, дистиллированной воды и ацетона вовсе нецелесообразно.
Для изучения характера распределения дифениламина на поверхности мишеней после выстрела каждую мишень, представляющую собой прямоугольный фрагмент белой бязи с огнестрельным повреждением, раскладывали на листе фильтровальной бумаги и находили пулевое повреждение, которое принимали за центр мишени. Мишень размечали относительно ее центра при помощи циркуля с графитовым стержнем на участки в виде окружностей диаметром 20, 50, 200 мм, вписанных друг в друга.
Рис. 3. Вольтамперограмма дифениламина на СУЭ. Условия: Ен = – 0,2 В, τн = 30 с: 1 – фоновый электролит 0,2М Na2HPO4; 2 – С дифениламина = 0,01мг/л; 3 – С дифениламина = 0,02мг/л
Размеченные таким образом окружности делили по вертикали и горизонтали на четыре части. После чего при помощи ножа с керамическим клинком вырезали одну произвольно взятую часть (1/4), которую разрезали по намеченным дугообразным линиям на три фрагмента. Полученные фрагменты мишени (каждый отдельно) взвешивали на аналитических весах, помещали в отдельные химические стаканы и экстрагировали этиловым спиртом в течение 24 часов.
Затем, из полученного спиртосодержащего раствора отбирали аликвоту объемом 0,03 мл, помещали в раствор фонового электролита и проводили вольтамперометрическое определение дифениламина, концентрацию определяли методом стандартной добавки.
В ходе измерения на трех мишенях концентраций дифениламина, полученных при стрельбе для каждой дистанции, определяли средние значения концентраций и их доверительные интервалы. С учетом того что масса фрагмента материала мишени (бязи) площадью 1 см2 составила 0,01346 г, пересчитывали содержание дифениламина в 1 см2 материала мишени.
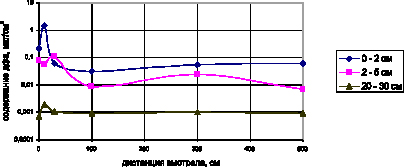
Для исследования влияния дистанции выстрела на отлажение дифениламина по поверхности бязи были построены графические зависимости содержания дифениламина (по логарифмической шкале) в материале мишени от дистанции выстрела из пистолета Макарова патроном со свинцовой безоболочечной пулей (рис. 4).
Рис. 4. Зависимость содержания дифениламина на различных участках материла мишеней от дистанции выстрела из 9 мм пистолета Макарова
Из рис. 4 видно, что отложения дифениламина на поверхности мишеней, находящихся на разном удалении от центра повреждения, при выстреле с различных дистанций, значительно различаются. Кривые содержания дифениламина на начальном этапе имеют выраженные максимумы, что можно объяснить наложением процессов образования продуктов выстрела на многослойной преграде при воздействии газопороховой струи. Вокруг центров повреждения, образованных пулями, имеются фрагменты содержащие большое количество дифениламина. Во всех мишенях на фрагментах, прилегающих к пулевому повреждению (на расстоянии до 10 мм от центра), обнаружено повышенное количество дифениламина. Это можно объяснить образованием «пояска обтирания» вокруг пулевого повреждения при прохождении пули через преграду, что подтверждается высокими концентрациями дифениламина для огнестрельных повреждений, образованных в результате «близкого выстрела», и от выстрела с расстояния 500 см, для которой газопороховая струя не способна значительно повлиять. С увеличением расстояния от центра огнестрельного повреждения к периферии для каждой мишени наблюдается уменьшение содержания дифениламина, что хорошо согласуется с теорией воздействия газопороховой струи на материал преграды.
При определении дистанции «близкого выстрела» по содержанию дифениламина подходит фрагмент мишени, находящийся на расстоянии от 0 мм до 20 мм.
Таким образом, нами впервые получен вольтамперометрический сигнал дифениламина на стеклоуглеродном электроде. Исследовано влияние различных факторов на аналитический сигнал (фоновый электролит, потенциал и время электролиза, скорость изменения потенциала), подобраны рабочие условия определения дифениламина с минимальной концентрацией его содержания Сmin = 0,001 мг/л.
Показана возможность применения инверсионной вольтамперометрии для определения дифениламина в продуктах выстрела, а также установления дистанции «близкого выстрела».
Источник
Реакция с дифениламином (фармакопейная)
1. Реакция с дифениламином (фармакопейная).
Реакцию проводят в концентрированной серной кислоте. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
дифениламин дифенилбензидин (бесцветный)
Две молекулы дифениламина отдают окислителю два электрона и теряют два иона водорода. Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем до окрашенного в синий цвет дифенилдифенохинондиимина, при котором молекулы дифенилбензидина также отдает окислителю два электрона и теряет два иона водорода:
При стоянии синей смеси, ее окраска постепенно изменяется вначале на бурую, а затем — на желтую, вследствие необратимого разрушения синего продукта реакции.
Проведению реакции мешают как анионы — окислители (C103 — ,Br3, Cr207 и др.), так и анионы — восстановители (S 2- , SO3 2- , S2O3 2- , 1 — и др.).
Нитрат — ион NO3— дает аналогичную реакцию с дифениламином.
2. Реакция с сильными кислотами (фармакопейная).
3.Реакция с иодидом калия (нитрит — ион — окислитель).
Нитрит — ион в кислой среде (НС1, H2SO4, CH3COOH) окисляет иодид — ионы до свободного иода:
2 N02 — + 2 1 — + 4 Н + -> 12 + 2 N0 + 2 Н20
Образующийся йод обнаруживают реакцией с крахмалом (по посинению раствора) или экстрагируя его органическим растворителем — бензолом, хлороформом (органический слой окрашивается в фиолетовый цвет).
Нитрат — ион N03 не мешает проведению реакции, поэтому ионы N02 — можно открыть в присутствии нитрат — ионов. Проведению реакции мешают окислители (МпО4-.Сг2О7 2 — и др.).
4.Реакция с перманганатом калия (нитрит — ион — восстановитель).
Проведению реакции мешают другие восстановители (S 2 -, SO3 2 \ S2O3 2 -, C2O4 2 -, SCN\ АбОз 3 -,!-, Вг-), также реагирующие с МпО4— — ионами.
Нитрат — ион N03— не обесцвечивает раствор КМпО4 (отличие от нитрит — иона -фармакопейный тест). Розовый раствор перманганата калия обесцвечивается.
5.Реакция с реактивом Грисса — Илотвая.
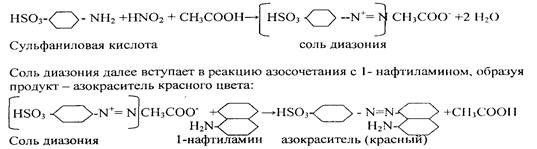
Реактив Грисса — Илотвая — смесь сульфаниловой кислоты HSO3C6H4NIЬ с 1-нафтиламином C10P7NH2. Реакцию проводят в нейтральных или уксуснокислых растворах.Образующаяся в кислой среде в присутствии нитрит- иона азотистая кислота HN02 реагирует с сульфаниловой кислотой, давая соль диазония:
В результате раствор окрашивается в красный цвет.
Нитрат — ион NO3 — аналогичной реакции не дает.
Вместо сульфаниловой кислоты используют и другие ароматические амины, а вместо 1-нафтиламина — 1 амино — 2- нафтол, 2- нафтол и т.д.
6. Реакция с солями аммония — реакция разложения (удаления) нитрит ионов.
Аналогична реакция с карбамидом:>
Эти реакции используют для удаления нитрит- ионов из раствора. Наблюдается выделение пузырьков газа — азота.
Чтобы убедиться в полноте протекания реакции, в пробирку прибавляют каплю раствора иодида калия KI и каплю крахмала. Если раствор не окрашивается в синий цвет, то это означает, что нитрит — ион в растворе отсутствует.
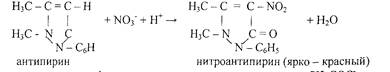
7. Реакция с антипирином (фармакопейная)
Реакцию проводят в слабокислой среде.
8. Другие реакции нитрит — иона.
Нитрит — ион с солями кобальта и KCI в уксуснокислой среде дает желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO)2)6]; с FeSO4 в , сернокислой или уксуснокислой среде о.бразует комплекс состава [Fe(NO)SO4] бурого цвета и т.д.
Аналитические реакции нитрат — иона NO3 —
Нитрат — ион NO3— — анион одноосновной сильной азотной кислоты HNO3. В водных растворах бесцветный нитрат — ион не гидролизуется, обладает окислительными свойствами. Как лиганд NO3— — мало эффективен и образует неустойчивые нитракомплексы металлов. Нитраты металлов хорошо растворяются в воде.
В отличие от нитритов, нитраты не обесцвечивают подкисленные водные растворы перманганата калия (фармакопейный тест).
1.Реакция с дифениламином (фармакопейная).
Эта реакция — общая для NO3— и NO2— и проводится точно так же, как и для нитрит -иона (см. выше); только вместо раствора нитрита натрия используют раствор нитрата натрия или калия. Данной реакцией нельзя открывать нитраты в присутствии нитритов.
2.Реакция с металлической медью (фармакопейная).
Реакцию проводят в среде концентрированной H2SO4 при нагревании.
2 NO3— + 8 Н + + 3 Си = 3 Си 2+ + 2 NOT + 4 Н2О 2NO + О2 —> 2 NO2j'(жeлтo-бypыe пары)
3.Реакция с сульфатом железа (II) и концентрированной серной кислотой.
Реакцию проводят при нагревании:
3 Fe 2+ + Nft- + 4 Н + ->■ 3 Fe 3+ + NO + 2 Н2О Fe 2+ + NO + SO4 2 — -> [Fe NO]SO4 (бурый)
Эту реакцию дает и нитрит — ион, поэтому нельзя открыть этой реакцией нитрат — ион в присутствии нитрит- иона. Проведению реакции мешают Вг-, Г, SO3 2 -, S2O3 2 ‘, CrO4 2 -, MnO4 2 -.
4.Реакция с металлическим алюминием или цинком.
Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумагу в синий цвет.Проведению реакции мешают катионы аммония NH4 + , выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (NO2-, SCN-, ферро — и феррицианид — ионы).
5.Реакция с антипирином. Реакцию проводят в кислой среде.
Аналитические реакции ацетат — иона CH3COO’
Ацетат — ион СН3СОО- — анион слабой одноосновной уксусной кислоты СН3СООН: в водных растворах бесцветен, подвергается гидролизу, не обладает окислительно -восстановительными свойствами; довольно эффективный лиганд и образует устойчивые ацетатные комплексы с катионами многих металлов. При реакциях со спиртами в кислой среде дает сложные эфиры.
Ацетаты аммония, щелочных и большинства других металлов хорошо растворяется в воде. Ацетаты серебра CH3COOAg и ртути (I) менее ацетатов других металлов растворимы в воде.
1.Реакция с хлоридом железа (III) (фармакопейная).
При рН = 5-8 ацетат — ион с катионами Fe(III) образует растворимый темно — красный (цвета крепкого .чая) ацетат или оксиацетат железа (III).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
При кипячении из раствора выпадает красно-бурый осадок основного ацетата железа (III):
(CH3COO)3Fe + 2 Н2О 2 -, SO3‘-, РО4 3 -, [Fe(CN)6] 4 , образующие осадки с железом (III), а также анионы SCN- (дающие красные комплексы с катионами Fe 3+ ), иодид — ион Г,окисляющийся до йода 12, придающего раствору желтую окраску.
2.Реакция с серной кислотой.
Ацетат — ион в сильно кислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса:
СН3СОО- + Н + 2 -, SO3 2 -, S2O3 2 -, также выделяющие в среде концентрированной H2SO4 газообразные продукты с характерным запахом.
3.Реакция образования уксусноэтилового эфира (фармакопейная).
Реакцию проводят в сернокислой среде. С этанолом:
Выделяющийся этилацетат обнаруживают по характерному приятному запаху. Соли серебра катализируют эту реакцию, поэтому при ее проведении рекомендуется добавлять небольшое количество AgNO3.
Аналогично при реакции с амиловым спиртом С5НцОН образуется также обладающий приятным запахом амилацетат СН3СООС5Ни (-грушевая-) Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.
Аналитические реакции тартрат — иона РОС- СН(ОН) — СН(ОН) — СОСТ. Тартрат- ион — анион слабой двухосновной винной кислоты:

Тартрат — ион хорошо растворим в воде. В водных растворах тартрат — ионы бесцветны, подвергаются гидролизу, склонны к комплексообразованию, давая устойчивые тартратные комплексы с катионами многих металлов. Винная кислота образует два ряда солей – средние тартраты, содержащие двух зараядный тартрат – ион СОСН(ОН)СН(ОН)СОО — , и кислые тартраты – гидротартраты, содержащие однозарядный гидротартрат – ион НОООСН(ОН)СН(ОН)СОО — . Гидротартрат калия (-винный камень-) КНС4Н4О6 практически не растворм в воде, что используется для открытия катионов калия. Средняя кальциевая соль также мало растворима в воде. Средняя калиевая соль К2С4Н4О6 хорошо растворяется в воде.
I. Реакция с хлоридом калия (фармакопейная).
2. Реакция с резорцином в кислой среде (фармакопейная).
Тартраты при нагревании с резорцином мета — С6Н4(ОН)2 в среде концентрированной серной кислоты образуют продукты реакции вишнево — красного цвета.
3.Реакции с аммиачным комплексом серебра. Выпадает черный осадок металлического серебра.
4.Реакция с сульфатом железа (II) и пероксидом водорода.
Прибавление разбавленного водного раствора FeSO4 и Н2О2 к раствору, содержащему тартраты. приводит к образованию к образованию неустойчивого комплекса железа жатого цвета. Последующая обработка раствором щелочи NaOH приводит к кяншиовению комплекса голубого цвета.
Аналитические реакции цитрат — иона
Цитрат — ион — ООССН2 — С(ОН)(СОО — ) — СН2СОО- — анион слабой трехосновной лимонной кислоты:
Лимонная кислота хорошо растворима в воде. В водных растворах цитрат — ионы бесцветны, подвергаются гидролизу, способны образовывать устойчивые цитратные комплексы с катионами многих металлов.
Средний нитрат натрия растворяется в воде. Средняя кальциевая соль лимонной свеклы мало растворима в горячей воде, но хорошо растворяется в холодной воде, что используется на практике. I. Реакция с хлоридом кальция (фармакопейная). Реакцию проводят в нейтральной среде при кипячении:
где Cit — — условное сокращенное обозначение среднего цитрат — иона. 2. Реакция образования пентабромацетона. Реакцию проводят в сернокислой среде.
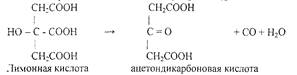
Вначале в сернокислом растворе происходит окисление лимонной кислоты до апгтондикарбоновой кислоты О = С (CitCOOH)2:
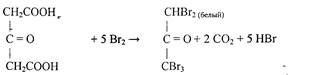
Затем ацетондикарбоновая кислота бромируется и переходит в пентабромацетон:
Проведению реакции мешают органические кислоты и фенолы, дающие осадки продуктов бромирования.
Источник