Разработка состава лекарственной формы
С незапамятных времен и до настоящего времени не утрачен, а наоборот все возрастает интерес к проблеме использования и изучения многочисленных продуктов, производимых пчелами.
Кроме воска, меда, пчелиного молочка, особенно в последнее время большой научно-практический интерес представляет продукт пчеловодства – прополис (пчелиный клей).
Имеющиеся многочисленные литературные данные свидетельствуют о его широком и многогранном применении при лечении различных заболеваний, как в народной, так и в научной медицине. В частности, прополис применяется как средство для лечения злокачественных новообразований, ожогов, различных ран и заболеваний полости рта. Назначают при туберкулезе, дифтерии, экземе, роже, ангине, гнойных процессах, в гинекологической практике и в стоматологии. Используют его как противовоспалительное и болеутоляющее средство, а также для лечения язвенной болезни желудка и двенадцатиперстной кишки, гастритах, изжоге, воспалительных заболеваниях пародонта. Тем не менее, несмотря на огромное число исследований, разработанных новых средств и методов лечения, проблема изучения новых методов и технологий лечения воспалительных заболеваний пародонта остается актуальным, так как распространенность заболеваний не снижается [4].
Широта терапевтического действия прополиса объясняется наличием в нем целого комплекса биологически активных веществ, главным образом, полифенольного характера.
Прополис очень ценный лечебный продукт. Преимущество его в сравнении с некоторыми другими лечебными препаратами в том, что он биологически безвреден для организма и может быть использован как самостоятельное комплексное лечебное средство, так и в различных комбинациях с другими лекарственными веществами в той или иной лекарственной форме.
Однако, в виде композиций препараты прополиса используются сравнительно редко, и в то же время возможность составления таких составов, особенно с противовоспалительными средствами, довольно привлекательна. Именно поэтому разработка такого комбинированного препарата с использованием прополиса стала основной целью наших исследований.
В качестве второго компонента мы решили предложить поливинокс (винилин) – мощное противовоспалительное, противоязвенное средство, однако, отличающееся отрицательными органолептическими показателями и не очень выраженной антимикробной активностью. Поэтому такое сочетание показалось нам перспективным и актуальным.
Оптимальной лекарственной формой для сочетания прополиса и поливинокса является мягкая лекарственная форма. Мази состоят из лекарственных веществ, равномерно распределенных в мазевых основах. В зависимости от типа дисперсных систем различают мази гомогенные (растворы, сплавы) и гетерогенные (суспензии, эмульсии, комбинированные) [5].
Для реализации поставленной цели был сформирован поэтапный план работы:
— приготовление извлечения из прополиса;
— стандартизация извлечения из прополиса, согласно существующей ВФС;
— разработка технологической схемы мягкой лекарственной формы;
— биофармацевтические и реологические исследования;
— разработка методики качественного анализа прополиса и поливинокса в мягкой лекарственной форме;
— разработка методики количественного определения фенольных соединений прополиса в мягкой лекарственной форме;
— установление срока годности мази;
— выявление антимикробных свойств мазевой основы и проверка активности разработанной мягкой лекарственной формы микробиологическим методом, используя тест– культуры;
— исследование ранозаживляющей активности разработанной мягкой лекарственной формы.
Следуя поэтапному выполнению исследования, на первом этапе необходимо было получить гидрофильный препарат прополиса. Процесс состоял из следующих стадий:
— получение водного извлечения,
Полученный фенольный гидрофильный препарат прополиса представлял собой порошок светло – коричневого цвета, со слабым своеобразным запахом, растворим в воде. Выход фенольного гидрофильного препарата прополиса составил 5,5 %, содержание в нем фенольных соединений 29 %. Полученный препарат является достаточно эффективным средством для полоскания при стоматологических заболеваниях, однако с точки зрения технолого-экономичсеких качеств этот препарат не совершенен [2]. Оптимальной лекарственной формой для фенольного гидрофильного препарата прополиса является мягкая лекарственная форма. Исходя из свойств фенольного гидрофильного препарата прополиса были получены четыре мазевые композиции. Для выбора оптимальной мазевой основы проводили биофармацевтические исследования полученных мазей, используя метод диффузии в гель.
Мягкая лекарственная форма на основе полиэтиленоксид 400 – полиэтиленоксид 1500 быстрее высвобождает из себя действующие вещества. Второй по величине степени высвобождения является мазь на основе натрий – карбоксиметилцеллюлоза, затем – мазь на основе аксам и далее – мазь на основе метилцеллюлоза.
Таким образом, из результатов проведенных исследований следует вывод о том, что оптимальной мазевой основой для приготовления мази с поливиноксом и прополисом является основа полиэтиленоксид 400 – полиэтиленоксид 1500.
На основании полученных результатов была разработана технологическая схема производства мягкой лекарственной формы, состоящая из следующих стадий:
— подготовка сырья и материалов,
— приготовление мазевой основы,
— добавление в мазевую основу действующих веществ,
— фасовка и упаковка.
Исследования по стандартизации и установлению норм качества, согласно требованиям ОСТ «Стандарты качества лекарственных средств. Основные положения», проводили на 5 сериях препарата [1, 3].
Полученную мягкую лекарственную форму подвергли реологическому исследованию.
На следующем этапе, полученную мягкую лекарственную форму проверили на антимикробную активность. Исследованию были подвергнуты мягкая лекарственная форма с поливиноксом и прополисом, а также основа сплав – ПЭО 400 и ПЭО 1500. Определение чувствительности патогенных микроорганизмов к лекарственной форме и к основе проводили, используя способ «колодцев». Оценка результатов проводилась по диаметру зон задержки роста вокруг «колодца», включая и диаметр самого «колодца». Зоны измерялись с помощью миллиметровой бумаги.
Таким образом, проведенный биологический скрининг разработанной мягкой лекарственной формы установил её высокую микробиологическую активность.
Качественный анализ фенольного гидрофильного препарата прополиса проводили как с помощью цветных реакций, так и используя его способность поглощать УФ – излучение.
Одним из основных критериев, характеризующих качество фенольного гидрофильного препарата прополиса является потеря в массе при высушивании, которая согласно требованиям фармакопейной статьи (ФС) не должна превышать 10 %. Проведенный анализ подтвердил соответствие исследуемого образца ФС.
На следующем этапе исследования была подтверждена ранозаживляющая активность разработанной мягкой лекарственной формы.
Исследования в области стабильности мягкой лекарственной формы на основе композиции поливинокса и прополиса определили срок годности в течение 2 лет.
Источник
Разработка лекарственных форм
Фармацевтическая разработка – это комплексные экспериментальные исследования, в рамках которых осуществляется обоснов ание состава, этапов технологического процесса, условий производства для дальнейшего включения этой информации в регистрационное досье. Мы разрабатываем различные лекарственные формы: таблетки, порошки, капсулы, суппозитории, мази, растворы для парентерального применения, спреи.
Этапы фармацевтической разработки:
- Информационная проработка по теме научно-исследовательской работы.
- Преформуляционные исследования (изучение физико-химических и технологических свойств активной фармацевтической субстанции (АФС); изучение стабильности АФС в условиях стресс-тестов; разработка и валидация методик количественного определения; выбор вспомогательных веществ).
- Фармацевтическая разработка (изучение совместимости субстанции в составе комбинаций со вспомогательными веществами; разработка состава и технологии готовой лекарственной формы (ГЛФ); выбор первичной упаковки; подготовка лабораторного регламента).
- Наработка ГЛФ для подтверждения фармацевтической разработки, проведения аналитических исследований, изучения стабильности и проведения доклинических исследований.
- Изучение стабильности АФС и ГЛФ (долгосрочные, промежуточные и ускоренные исследования стабильности).
- Составление нормативного документа (НД) на АФС и ГЛФ.
Дополнительная информация в брошюре
Источник
Разработка состава лекарственной формы
Лечение и профилактика клинических проявлений аллергии является одним из актуальных вопросов современной медицины, которые имеют большое социальное значение. Одним из проявлений аллергии являются дерматозы. Наиболее распространенными в общей структуре аллергических болезней кожи является атопический дерматит (АТД) и хроническая крапивница. Основным симптомом, объединяющим эту группу заболеваний, является кожный зуд. В связи с этим возрастает внимание к антигистаминным препаратам [1].
Терапевтическая эквивалентность микрокапсул возрастает и в связи с тем, что с помощью относительно несложных технологических приемов удается не только получать микрокапсулы с оболочкой равной толщины, но и регулировать толщину оболочки, в зависимости от целей и стратегии медикаментозной терапии. Круг веществ, используемых для формирования оболочек микрокапсул, очень разнообразен и включает в себя: высокомолекулярные соединения животного и растительного происхождения – белки, декстраны, пектины, альгинаты, хитозан, агар, производные целлюлозы, природные смолы (камеди, шеллак), синтетические полимеры и олигомеры – полиолефины, поливиниловый спирт, поливинилацетат, поливинилхлорид, эпоксидные и полиэфирные смолы, полиамиды, полилактиды, полигликолиды, и пр. [3, 5].
Целью настоящей работы является разработка состава и технологии микрокапсул фексофенадина.
Материалы и методы исследования
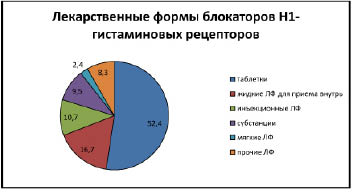
В настоящее время в Государственном реестре Лекарственных средств зарегистрировано 218 наименований противоаллергических препаратов, из них 168 относятся к группе антигистаминных. Лекарственные формы блокаторов Н1-гистаминовых рецепторов представлены на рис. 1.
Действующим компонентом выбран фексофенадин. Фексадин (фексофенадин)– антигистаминный препарат третьего поколения, является активным метаболитом терфенадина. Фексадин не кумулируется в печени, быстро всасывается, выводится в неизмененном виде желчью через желудочно-кишечный тракт и с мочой через почки. Отечественными учеными проводится ряд исследований в данном направлении, и в целях усовершенствования лекарственной формы ими предложен гель с микрокапсулами противоаллергического действия [2, 6].
Изготовление микрокапсул проводили физическим методом – как наиболее оптимальным. Подбор метода осуществлялся на основе физико-химических свойств фексофенадина. Для получения микрокапсул методом диспергирования в несмешивающихся жидкостях необходимо наличие двух фаз – гидрофильной и гидрофобной. При подборе состава расплава – будущей оболочки микрокапсул изучен сплав воск пчелиный и масло какао в соотношении (3:2). В качестве дисперсионной среды, т.е. диспергируемой жидкости изучены: глицерин, раствор метилцеллюлозы (МЦ). В качестве гидрофильной оболочки был использован желатин, дисперсионная среда – масло подсолнечное.
Рис. 1. Лекарственные формы блокаторов Н1-гистаминовых рецепторов
Технология микрокапсул заключается в следующем: горячий расплав воск/масло какао с распределенным в нем действующим веществом диспергируется в подогретом 2 %-м растворе МЦ с помощью мешалки. В результате охлаждения раствора полимера и расплава мельчайшие частицы фексофенадина покрываются оболочкой гидрофобного расплава.
Полученные таким образом микрокапсулы отделяются от раствора МЦ многократным промыванием водой очищенной и подвергаются сушке при комнатной температуре.
Изучение скорости и полноты высвобождения действующего вещества из микрокапсул проводили методом диализа через полупроницаемую мембрану. Навеску каждого из образцов микрокапсул на различных основах помещали на целлофановую мембрану-пленку «Купрофан». В диализаторы наливали по 25 мл 0,1 М HCl. Проводили диализ при температуре 37 ºС, отбирая пробы через 20, 45, 90 мин. Измеряли оптическую плотность на спектрофотометре при длине волны 220 нм в кювете с толщиной слоя
10 мм.
Результаты исследования и обсуждение
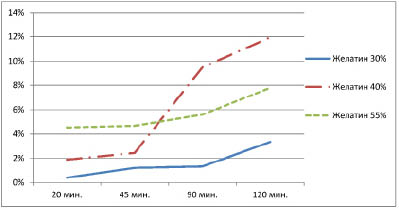
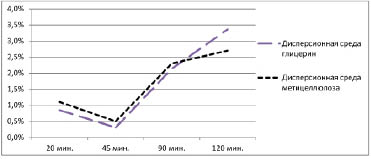
Результаты высвобождения фексафенадина в диализную среду представлены на рис. 2 и 3.
Рис. 2. Высвобождение фексофенадина из желатиновых микрокапсул
с различной концентрацией желатина
Рис. 3. Высвобождение фексофенадина из гидрофобных микрокапсул
На рис. 2 показано, что из микрокапсул с содержанием желатина 55 % высвобождение действующего вещества происходит более равномерно, чем из микрокапсул с концентрацией желатина 30 % и более полно, чем из микрокапсул с концентрацией желатина 40 %. что более полно фексофенадин высвобождается из гидрофобных микрокапсул, дисперсионной средой которых является глицерин. Из рис. 3 видно, что оптимальной дисперсионной средой для получения микрокапсул с гидрофобной оболочкой является глицерин.
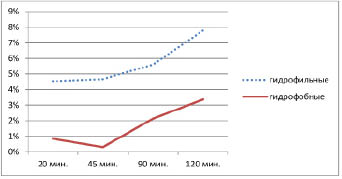
Сравнение степени высвобождения действующего вещества из микрокапсул с различной природой оболочки показало, что более полное и равномерное высвобождение фексофенадина происходит из гидрофильных микрокапсул (за 120 минут высвободилось 7,9 % лекарственного вещества) (рис. 4).
Рис. 4. Высвобождение фексофенадина из гидрофильных и гидрофобных микрокапсул
Таким образом, на основе проведенных исследований:
1. Разработана технология получения микрокапсул с фексофенадином методом диспергирования в несмешивающихся жидкостях.
2. Выбран оптимальный состав микрокапсул, содержащих желатиновую оболочку, степень высвобождения действующего вещества в диализную среду за 120 минут составила 7,9 % лекарственного вещества.
Источник
Разработка состава лекарственной формы
С незапамятных времен и до настоящего времени не утрачен, а наоборот все возрастает интерес к проблеме использования и изучения многочисленных продуктов, производимых пчелами.
Кроме воска, меда, пчелиного молочка, особенно в последнее время большой научно-практический интерес представляет продукт пчеловодства – прополис (пчелиный клей).
Имеющиеся многочисленные литературные данные свидетельствуют о его широком и многогранном применении при лечении различных заболеваний, как в народной, так и в научной медицине. В частности, прополис применяется как средство для лечения злокачественных новообразований, ожогов, различных ран и заболеваний полости рта. Назначают при туберкулезе, дифтерии, экземе, роже, ангине, гнойных процессах, в гинекологической практике и в стоматологии. Используют его как противовоспалительное и болеутоляющее средство, а также для лечения язвенной болезни желудка и двенадцатиперстной кишки, гастритах, изжоге, воспалительных заболеваниях пародонта. Тем не менее, несмотря на огромное число исследований, разработанных новых средств и методов лечения, проблема изучения новых методов и технологий лечения воспалительных заболеваний пародонта остается актуальным, так как распространенность заболеваний не снижается [4].
Широта терапевтического действия прополиса объясняется наличием в нем целого комплекса биологически активных веществ, главным образом, полифенольного характера.
Прополис очень ценный лечебный продукт. Преимущество его в сравнении с некоторыми другими лечебными препаратами в том, что он биологически безвреден для организма и может быть использован как самостоятельное комплексное лечебное средство, так и в различных комбинациях с другими лекарственными веществами в той или иной лекарственной форме.
Однако, в виде композиций препараты прополиса используются сравнительно редко, и в то же время возможность составления таких составов, особенно с противовоспалительными средствами, довольно привлекательна. Именно поэтому разработка такого комбинированного препарата с использованием прополиса стала основной целью наших исследований.
В качестве второго компонента мы решили предложить поливинокс (винилин) – мощное противовоспалительное, противоязвенное средство, однако, отличающееся отрицательными органолептическими показателями и не очень выраженной антимикробной активностью. Поэтому такое сочетание показалось нам перспективным и актуальным.
Оптимальной лекарственной формой для сочетания прополиса и поливинокса является мягкая лекарственная форма. Мази состоят из лекарственных веществ, равномерно распределенных в мазевых основах. В зависимости от типа дисперсных систем различают мази гомогенные (растворы, сплавы) и гетерогенные (суспензии, эмульсии, комбинированные) [5].
Для реализации поставленной цели был сформирован поэтапный план работы:
— приготовление извлечения из прополиса;
— стандартизация извлечения из прополиса, согласно существующей ВФС;
— разработка технологической схемы мягкой лекарственной формы;
— биофармацевтические и реологические исследования;
— разработка методики качественного анализа прополиса и поливинокса в мягкой лекарственной форме;
— разработка методики количественного определения фенольных соединений прополиса в мягкой лекарственной форме;
— установление срока годности мази;
— выявление антимикробных свойств мазевой основы и проверка активности разработанной мягкой лекарственной формы микробиологическим методом, используя тест– культуры;
— исследование ранозаживляющей активности разработанной мягкой лекарственной формы.
Следуя поэтапному выполнению исследования, на первом этапе необходимо было получить гидрофильный препарат прополиса. Процесс состоял из следующих стадий:
— получение водного извлечения,
Полученный фенольный гидрофильный препарат прополиса представлял собой порошок светло – коричневого цвета, со слабым своеобразным запахом, растворим в воде. Выход фенольного гидрофильного препарата прополиса составил 5,5 %, содержание в нем фенольных соединений 29 %. Полученный препарат является достаточно эффективным средством для полоскания при стоматологических заболеваниях, однако с точки зрения технолого-экономичсеких качеств этот препарат не совершенен [2]. Оптимальной лекарственной формой для фенольного гидрофильного препарата прополиса является мягкая лекарственная форма. Исходя из свойств фенольного гидрофильного препарата прополиса были получены четыре мазевые композиции. Для выбора оптимальной мазевой основы проводили биофармацевтические исследования полученных мазей, используя метод диффузии в гель.
Мягкая лекарственная форма на основе полиэтиленоксид 400 – полиэтиленоксид 1500 быстрее высвобождает из себя действующие вещества. Второй по величине степени высвобождения является мазь на основе натрий – карбоксиметилцеллюлоза, затем – мазь на основе аксам и далее – мазь на основе метилцеллюлоза.
Таким образом, из результатов проведенных исследований следует вывод о том, что оптимальной мазевой основой для приготовления мази с поливиноксом и прополисом является основа полиэтиленоксид 400 – полиэтиленоксид 1500.
На основании полученных результатов была разработана технологическая схема производства мягкой лекарственной формы, состоящая из следующих стадий:
— подготовка сырья и материалов,
— приготовление мазевой основы,
— добавление в мазевую основу действующих веществ,
— фасовка и упаковка.
Исследования по стандартизации и установлению норм качества, согласно требованиям ОСТ «Стандарты качества лекарственных средств. Основные положения», проводили на 5 сериях препарата [1, 3].
Полученную мягкую лекарственную форму подвергли реологическому исследованию.
На следующем этапе, полученную мягкую лекарственную форму проверили на антимикробную активность. Исследованию были подвергнуты мягкая лекарственная форма с поливиноксом и прополисом, а также основа сплав – ПЭО 400 и ПЭО 1500. Определение чувствительности патогенных микроорганизмов к лекарственной форме и к основе проводили, используя способ «колодцев». Оценка результатов проводилась по диаметру зон задержки роста вокруг «колодца», включая и диаметр самого «колодца». Зоны измерялись с помощью миллиметровой бумаги.
Таким образом, проведенный биологический скрининг разработанной мягкой лекарственной формы установил её высокую микробиологическую активность.
Качественный анализ фенольного гидрофильного препарата прополиса проводили как с помощью цветных реакций, так и используя его способность поглощать УФ – излучение.
Одним из основных критериев, характеризующих качество фенольного гидрофильного препарата прополиса является потеря в массе при высушивании, которая согласно требованиям фармакопейной статьи (ФС) не должна превышать 10 %. Проведенный анализ подтвердил соответствие исследуемого образца ФС.
На следующем этапе исследования была подтверждена ранозаживляющая активность разработанной мягкой лекарственной формы.
Исследования в области стабильности мягкой лекарственной формы на основе композиции поливинокса и прополиса определили срок годности в течение 2 лет.
Источник