- Процесс изготовления лекарственных препаратов
- Технология изготовления препаратов
- Особенности фармацевтической технологии
- Два направления технологии изготовления ЛС
- Заводская технология лекарств (ЗТЛ)
- Аптечная технология лекарств (АТЛ)
- Путь лекарства
- Путь лекарства
- Конкурс «био/мол/текст»-2018
- Да здравствует идея!
- Операция «Мишень»
- На поиски лигандов
- Сокращай, оптимизируй!
- Тестировали, тестировали, да вытестировали
- Выходи на рынок!
Процесс изготовления лекарственных препаратов
Разработка лекарственного средства начинается с синтеза новых химических соединений. Вещества со сложной структурой можно получить из различных иа очников, например растений (сердечные гликозиды), тканей животных (гепарин), микробных культур (бензилпенициллин), культур человеческих клеток (урокиназа), или посредством генно-инженерных технологий (человеческий инсулин).
Чем больше ясности во взаимоотношениях структуры и активности, тем более направленным оказывается поиск новых веществ.
а) Доклинические испытания дают информацию о биологических эффектах новых веществ. Начальный скрининг может включать биохимические и фармакологические исследования (анализ связывания с рецептором) или эксперименты на культурах клеток, изолированных клетках и изолированных органах.
Поскольку эти модели не способны воспроизвести сложные биологические процессы, происходящие в интактных организмах, любое потенциальное лекарственное средство необходимо проверить на животных. Только эксперименты на животных позволяют выяснить, возникаютли желаемые эффекты при дозах, не вызывающих токсичности или сопровождающихся слабой токсичностью. Цель токсикологических исследований заключается в том, чтобы оценить:
1) токсичность, обусловленную кратковременным или длительным приемом;
2) генетические повреждения (генотоксичность, мутагенез);
3) развитие опухолей (канцерогенность);
4) возникновение врожденных дефектов (тератогенность).
В экспериментах на животных также оценивают всасывание, распределение, метаболизм и элиминацию (фармакокинетика) изучаемых веществ. На уровне доклинического изучение лишь у малой части новых веществ обнаруживается потенциал для применения у человека.
Фармацевтическиетехнологии предлагают методы изготовления лекарственных форм.
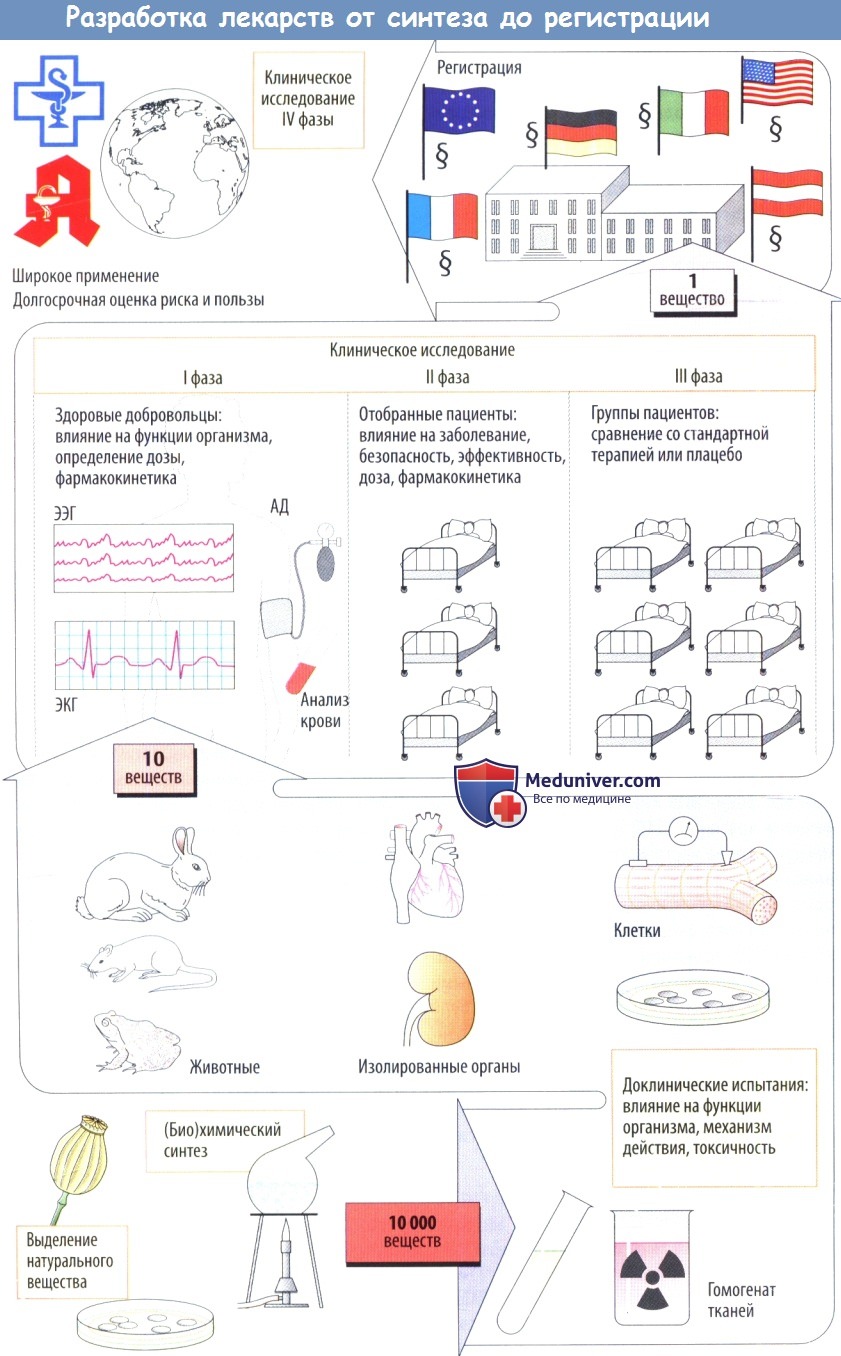
б) Клинические испытания начинаются с исследований I фазы, в которых участвуют здоровые лица; цель этих исследований — определить, будут ли эффекты, наблюдаемые у животных, также возникать у людей. Кроме того, на данном этапе определяется дозозависимость клинических эффектов.
Во II фазе потенциальные лекарственные средства сначала проверяют на отобранных пациентах на терапевтическую эффективность при заболевании, для лечения которого эти препараты предназначались. Если полезное действие очевидно, а частота побочных эффектов приемлема, начинается III фаза, в которой участвует более крупная группа пациентов, у которых новое средство сравнивают с традиционными методами лечения сточки зрения терапевтического результата.
Как форма экспериментов на людях, эти клинические исследования подвергаются анализу и одобрению этическими комитетами медицинских учреждений в соответствии с международными правилами проведения (Хельсинкской, Токийской и Венецианской декларациями). Во время клинических исследований выясняется, что многие вещества нельзя использовать. Как правило, в конце концов примерно из 10 000 вновь синтезированных веществ остается только одно.
в) Решение зарегистрировать новое лекарственное средство выносится национальным регуляторным органом (Food and Drug Administration в США, Health Protection Branch Drugs Directorate в Канаде, комиссией ЕС вместе с European Medicines Agency в Великобритании), которому производители должны подавать регистрационные документы.
Заявители должны документально подтвердить результатами соответствующих испытаний (доклинических и клинических), что критерии эффективности и безопасности удовлетворены и что лекарственные формы продукта (таблетки, капсулы и т. д.) соответствуют всем стандартам контроля качества.
После регистрации новое лекарственное средство может продаваться под торговым названием, оно должно быть доступным, выписываться врачами и отпускаться фармацевтами. В это время наблюдение продолжается в форме постмаркетинговых исследований (IV фаза клинических исследований)
г) Фармакологический надзор — действия, направленные на то, чтобы выявлять и устранять связанные с препаратом риски во время проведения клинических исследований и последующего его выхода на рынок. Фармаконадзор включает отчеты о предполагаемых случаях нежелательных реакций, направляемые в национальные регуляторные органы.
На основе длительного опыта применения можно правильно оценить соотношение риска и пользы и, следовательно, терапевтическую ценность нового лекарственного средства. Если новый препарат имеет небольшое преимущество перед существующими, необходимо принимать во внимание соотношение затрат и пользы от применения лекарственного средства.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Технология изготовления препаратов
В основе практической деятельности провизора-технолога в аптечной организации лежит технология изготовления препаратов — фармацевтическая технология.
Фармацевтическая технология — наука, которая определяет способы и методы изготовления лекарственных средств. В ее сферу входит изучение процессов и теоретических основ производства лекарств, определение перспектив разработки, создания и производства новых лекарственных форм.
Лекарственное средство — вещество или сочетание веществ синтетического, природного или биотехнологического происхождения. Имеет специфическую фармакологическую активность, которая позволяет применять его для диагностики, профилактики или лечения людей при внутреннем или внешнем применении.
Современная промышленность предлагает множество вариантов лекарственных форм жидкие, твёрдые и мягкие, газообразные. Они могут быть представлены в разных формах выпуска: капсулах, каплях, сиропах, экстрактах, настойках, растворах, гранулах, плёнках, таблетках, суспензий, аэрозолях и так далее. Все это требует использования разных способов производства.
Особенности фармацевтической технологии
Технологический процесс включает совокупность определенных действий.
Пример: при производстве таблеток технологический процесс включает стадии подготовки, гранулирования, таблетирования, упаковки и маркировки.
Процессы технологии изготовления лекарственных препаратов можно разделить на шесть групп:
- Механические. Встречаются при работе с твёрдыми материалами и включают такие действия как измельчение, дозирование, смешивание, прессование и другие;
- Гидромеханические. Встречаются при работе с газообразными веществами или жидкостями и включают такие действия как разделение жидких и твердых фаз, смешивание жидкостей, очистка газов от микроорганизмов или пыли и другие;
- Тепловые. Встречаются при работе с веществами, требующими изменения температурного режима. Включают такие действия как охлаждение, нагревание, приводящие к плавлению, испарению, конденсации и так далее;
- Массообменные. Встречаются в случаях, когда при проведении диффузии меняется состояние компонентов лекарственной смеси — из-за этого такие процессы иногда называют «диффузные». Включают такие действия как сушка, растворение, абсорбция, перегонка и другие;
- Химические. Предполагают образование новых химических соединений или изменение строения веществ, что приводит к изменению их химических свойств;
- Биотехнологические. Встречаются при производстве лекарственных средств с клеточными структурами животных или растений, микроорганизмов в составе.
Один технологический цикл может включать сразу несколько процессов разных типов, например, гранулирование может включать в себя механические, гидромеханические и массообменные процессы.
Два направления технологии изготовления ЛС
Технология изготовления лекарственных средств делятся на промышленную (заводскую) и аптечную технологию лекарственных средств и имеют общую теоретическую основу.
Заводская технология лекарств (ЗТЛ)
Применяется при массовом промышленном изготовлении лекарственных средств. Для целесообразности переноса производства в заводские условия должны присутствовать такие факторы как:
- Массовое потребление лекарств, делающее осмысленным внедрение комплексной механизации и автоматизации процесса производства, которое позволяет обеспечить высокое качество готовых препаратов;
- Длительная сохранность готового препарата, при которой лекарство сохраняет свои качественные характеристики на всем пути от производителя к больному человеку;
- Возможность стандартизации процесса производства с помощью машинной техники.
Производителей можно разделить на две категории: галеново-фармацевтические и химико-фармацевтические заводы. Между собой они различаются мощностью и номенклатурой производства, технологическим оборудованием, наличием нескольких линий производства и так далее.
Фармацевтическое производство функционирует в рамках системы менеджмента качества (СМК), а у передовых производителей есть свои подразделения исследования и разработки (R&D).
Аптечная технология лекарств (АТЛ)
Аптечное производство предполагает изготовление лекарств по индивидуальным прописям. Такие лекарства обычно имеют небольшой срок годности, что делает невозможным их массовое приготовление. Одним из преимуществ такого подхода является индивидуальность состава лекарства, которая позволяет учесть особенности организма больного при определении вида и количества компонентов.
Федеральный закон № 61-ФЗ «Об обращении лекарственных средств» в ст. 56 регламентирует, что аптеки могут изготавливать лекарственные препараты по рецептам по требованию медицинской организации. При этом процесс изготовления должен соответствовать правилам изготовления и отпуска лекарственных препаратов, которые определяют уполномоченные федеральные органы исполнительной власти.
Источник
Путь лекарства
16 октября 2018
Путь лекарства
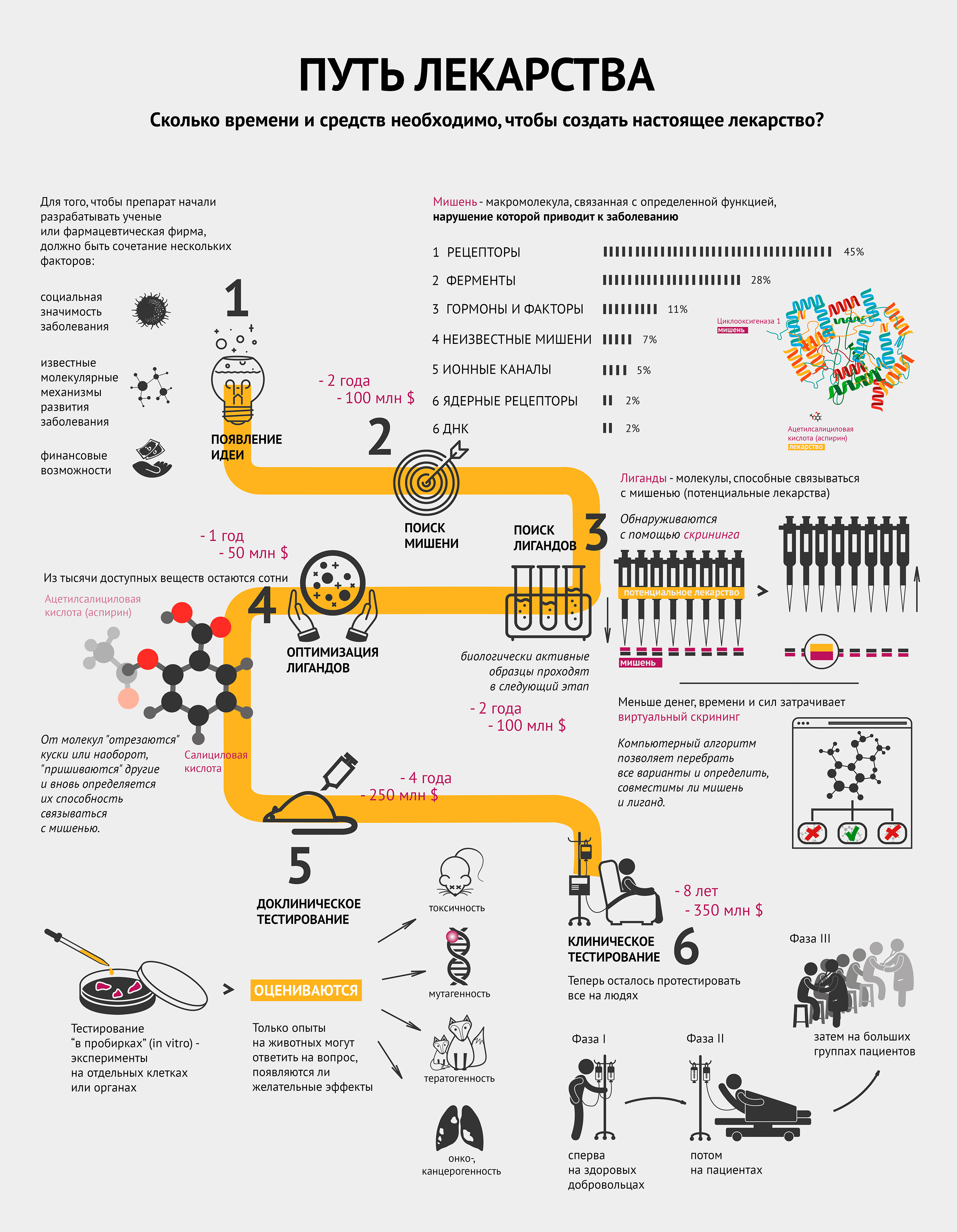
Создание нового лекарства требует большого количества ресурсов и времени. Невозможно предугадать успешность результата: подходящее, казалось бы, вещество, может дать сбой на любом этапе.
Автор
Редакторы
Инфографика на конкурс «био/мол/текст»: Казалось бы, для читателей «Биомолекулы» нет ничего понятнее, чем процесс создания лекарства. Однако почти никто не делал из этого инфографику — для смертных попроще. Вкратце — отсюда вы узнаете, сколько времени занимает процесс создания лекарства и насколько это недешево. И может быть, догадаетесь, что, если по телевизору сказали, что ученые обнаружили вещество, способное победить рак какую-нибудь заразу, то еще ох как рано бежать в аптеку в надежде купить новое лекарство.
Конкурс «био/мол/текст»-2018

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Да здравствует идея!
Для того чтобы препарат начали разрабатывать ученые или фармацевтическая фирма, должно быть сочетание нескольких факторов [1]:
- социальная значимость заболевания;
- известные молекулярные механизмы развития заболевания;
- финансовые средства и возможности по созданию конкретного лекарства.
Другими словами, должна появиться идея.
Операция «Мишень»
Совместными усилиями группа ученых выбирает мишень и способ воздействия на нее для лечения или предотвращения заболевания.
Мишень — это биологическая макромолекула, связанная с определенной функцией, нарушение которой приводит к заболеванию [2]. Чаще всего мишенями являются белки — рецепторы и ферменты. Инфографика демонстрирует, какие макромолекулы чаще всего становятся мишенями [2]. Забегая вперед, стоит отметить, что затем к мишени подбирают вещество — лекарство. Самый распространенный пример — циклооксигеназа 1 (мишень) и ацетилсалициловая кислота (аспирин) (лекарство) — тоже проиллюстрирован (см. также видео).
Видео. Лекция Валентина Табакмахера «Драг-дизайн. Современный подход к созданию лекарств».
На поиски лигандов
После того, как ученые нашли мишень, им нужно понять, чем в нее целиться. Лиганд (потенциальное лекарство) — это химическое соединение (как правило, низкомолекулярное), специфически взаимодействующее со своей мишенью и тем самым влияющее на процессы внутри клетки [2].
Исследование всех возможных веществ, конечно, нереально: существует не менее 10 40 лигандов. Поэтому на структуру потенциальных лигандов накладывают ряд ограничений, которые существенно сужают поиск. В качестве отправной точки обычно используют библиотеки соединений, которые создаются специализированными компаниями по условиям, заданным разработчиком, или уже имеются в арсенале фармацевтической фирмы. Такие библиотеки могут содержать миллионы веществ [3].
Воздействуют ли выбранные лиганды на мишень, помогает определить скрининг. Он бывает лабораторным (in vitro) или компьютерным (in silico). В случае с лабораторным скринингом на особые предметные стекла — плашки, содержащие в тысячах микролитровых лунок тестовую систему, например молекулы белка-мишени или целые клетки (при необходимости — генетически модифицированные), — робот раскапывает из пипеток исследуемые вещества, следуя заданной программе. Потом происходит считывание данных, говорящее о том, в какой лунке обнаружена биологическая активность. Детектор может определять ее по радиоактивному сигналу, флюоресценции, поляризации света и многим другим параметрам [3].
Сокращай, оптимизируй!
Из тысяч доступных веществ с более-менее определенными свойствами необходимо выбрать сотни молекул, способных после дальнейшей модификации и испытаний на бактериях или культурах клеток дать десятки так называемых кандидатных соединений, предназначенных для доклинических исследований, включая тестирование на животных.
Оптимизация может заключаться в «отсечении» части известного лиганда, или наоборот, добавлении к нему новых элементов и новой проверке на взаимодействие с мишенью. Возвращаясь к аспирину: он получился из салициловой кислоты путем добавления ацетильной группы.
Тестировали, тестировали, да вытестировали
Отобранные соединения сначала тестируются в биохимико-фармакологических исследованиях или экспериментах на клеточных культурах, изолированных клетках и изолированных органах. Так как эти модели не способны полностью воспроизвести весь комплекс биологических процессов в настоящем организме, любое потенциальное лекарство тестируется на животных. Только опыты на животных могут ответить на вопрос, появляются ли желательные эффекты в нетоксичных или малотоксичных дозах.
Исследование токсичности призвано оценить:
- токсичность при кратковременном и длительном применении;
- возможность генетических повреждений (генотоксичность, мутагенность);
- возможность развития опухолей (онко- и канцерогенность);
- возможность рождения больного плода (тератогенность).
На животных исследуемые соединения испытываются также на поглощение, распределение, метаболизм и выделение (фармакокинетика) [4].
После этого этапа отсева на стадию клинических испытаний на людях остается в лучшем случае 1−3 препарата (напомню, что изначально было примерно 1000 потенциальных лекарств!).
Выходи на рынок!
Клиническое тестирование включает в себя несколько фаз, которые иллюстрирует инфографика [5].
Сначала проводится исследование новых препаратов на здоровых лицах с целью определить, наблюдаются ли у человека эффекты, обнаруженные в тестах на животных, и выявить взаимоотношения между дозой и эффектом.
Потом потенциальный новый препарат апробируется на избранных пациентах для определения терапевтической эффективности при заболевании, для которого он предназначен. Положительное действие должно быть явным, а нежелательные эффекты приемлемо малы.
Далее к исследованию привлекаются большие группы пациентов, с помощью которых исследуемое лекарство сравнивается со стандартным лечением по исходам терапии [4].
В процессе клинических испытаний многие новые лекарства признаются негодными к применению.
Решение одобрить новый препарат принимает национальный регулирующий орган (в России — Фармкомитет МЗ РФ). Заявители (фармацевтические компании) представляют в регулирующий орган полный комплект документации преклинических и клинических испытаний, в которых полученные данные об эффективности и безопасности удовлетворяют установленным требованиям и предполагаемую форму выпуска продукта (таблетки, капсулы и т.д.)
После получения одобрения новое лекарство может продаваться под торговой маркой и, таким образом, становится доступным для назначения врачами и распространения в аптеках. Параллельно идет разработка технологического процесса производства лекарственного средства, требований к качеству, методов анализа.
По мере распространения препарата за ним продолжается наблюдение. Окончательное суждение о соотношении «польза—риск» нового лекарства может быть сделано только на основании долговременного опыта его применения. Таким образом, определяется терапевтическая ценность нового лекарственного препарата.
В разных случаях процесс разработки нового лекарства от идеи до реализации занимает примерно от 5 до 18 лет. Суммарная стоимость разработки, с учетом препаратов, не достигших рынка, часто превышает 1 млрд долларов (до 2,5 млрд в среднем) [6].
Источник