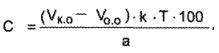Анализ производных фурана, бензопирана, пиррола, пиразола
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Глава 12. Анализ производных фурана, бензопирана, пиррола, пиразола, имидазола и индола
Нa основе гетероциклических систем создано множество современных ЛС. Получение многих из них стало возможным вследствие изучения биологической активности гетероциклических природных соединений. В свою очередь, изучение их синтетических аналогов служит основой для дальнейшего развития синтеза новых лекарств. В последнее время довольно широко применяется программа компьютерного моделирования лекарств.
ЛС, относящиеся к данной группе, представляют собой разнообразные химические соединения, в которых проявляются закономерности, присущие другим классам и группам химических соединений.
Фуран – пятичленный гетероцикл с гетероатомом кислорода; ему, как и бензолу, присущ ароматический характер. Лекарственные вещества данной группы используют как антибактериальные средства. Строение большинства из них можно представить общей формулой:
По строению эти вещества можно рассматривать как продукт конденсации альдегида 5-нитрофурфурола с соответствующим аминопроизводным:
Таким образом, лекарственные вещества данной группы построены по типу оснований Шиффа и содержат азометиновую связь – СН = И – (табл. 45).


Кислотно-основные свойства
Производные 5-нитрофурана являются веществами кислотного характера. У фурацилина кислотные свойства обусловлены подвижным атомом водорода амидной группы в остатке семикарбазида.
Фурадонин проявляет кислотные свойства за счет кетоенольной и лактим-лактамной таутомерии в гидантоиновом фрагменте:
Лактим-лактамная таутомерия обусловливает также возможность существования фурагина в 2 формах – кислотной (лактамной) и солевой (лактимной).
У фуразолидона кислотные свойства выражены слабее, чем у других лекарственных веществ данной группы.
Кислотные свойства лекарственных веществ группы 5-нитрофурана проявляются в следующих видах взаимодействия:
– с водными растворами щелочей;
– с протофильными растворителями (пиридин, диметилформамид);
– с ионами тяжелых металлов.
Все лекарственные вещества данной группы реагируют с раствором натрия гидроксида, при этом окраска становится более интенсивной. Поэтому реакция со щелочью является общегрупповой для данных веществ. Фурацилин при растворении в 10% растворе натрия гидроксида дает оранжево-красное окрашивание. Происходящее при этом депротонирование NH-кислотного центра вызывает перераспределение электронной плотности, что приводит к ионизации вещества и образованию новой сопряженной системы двойных связей с интенсификацией в результате указанных факторов окраски:
Темно-красное окрашивание при действии раствора натрия гидроксида на фурадонин обусловлено таутомерными превращениями в ядре гидантоина (см. выше), что также приводит к образованию дополнительных двойных связей и ионизации.
Фуразолидон дает бурое окрашивание с 30% раствором щелочи при нагревании, что связано с расщеплением лактонного цикла (ядро оксазолидона) и получением ионизированной соли:
Реакция с групповым реагентом — раствором натрия гидроксида — лежит также в основе количественного фотометрического определения лекарственных веществ группы 5-нитрофурана и их препаратов.
За счет кислотных свойств производные 5-нитрофурана растворяются в протофильных растворителях (пиридин, диметилформамид) с образованием окрашенных анионов, которые с катионами щелочных металлов образуют соли разного цвета, что позволяет дифференцировать данные вещества.
Кислотный характер производных 5-нитрофурана дает возможность проводить реакции комплексообразования с ионами тяжелых металлов (Сu 2+ , Со 2+ , Аg + ) – Эти реакции неспецифичны.
Гидролитическое расщепление
Данное свойство связано с наличием в структуре производных 5-нитрофурана азометиновой, амидной и сложноэфирной групп. Оно используется для отличия фурацилина от других веществ этого ряда. Являясь семикарбазоном, фурацилия подвергается гидролизу как в кислой, так и в щелочной среде при нагревании с образованием соответствующих продуктов:
Методы количественного анализа
- Кислотно-основное титрование в неводной среде. Как вещества кислотного характера производные 5-нитрофурана можно титровать в среде протофильных растворителей (диметилформамид, пиридин, бутиламин) стандартами растворами метоксидов натрия или лития. Так, МФ (3 изд., т. III) рекомендует этот метод для фурадонина (среда – диметилформамид, титрант – 0,1 н. раствор лития метоксида), который титруется как одноосновная кислота.
- Метод фотометрии основан на измерении поглощения света в видимой области спектра растворов производных 5-нитрофурана в протофильных растворителях (как окрашенных соединений, имеющих собственные хромофорные группы). Иногда для лучшей ионизации добавляют спиртовые или водные растворы щелочей.
- Йодометрическое определение. Метод обратной йодометрии используется для количественного определения фурацилина, которое основано на окислении остатка гидразина йодом в щелочной среде. Щелочь необходима для гидролиза фурацилина и освобождения остатка гидразина. При этом образуется натрия типойодит, который и окисляет фурацилин:
При дальнейшем добавлении кислоты серной идет реакция:
Выделившийся йод оттитровывают стандартным раствором натрия тиосульфата:
При расчете М(1/z) фурацилина по данной методике z = 4.
Условия проведения методики (малое количество щелочи и короткое время действия реактива – 1
2 мин) должны обеспечить окисление только гидразина, но не альдегида фурфурола.
ПРОИЗВОДНЫЕ ПИРРОЛА
Витамины группы В12
К ЛС данной группы относятся цианокобаламин, гидроксоко- баламин, кобамамнд. По своей структуре витамин В12 – это кобальтовый комплекс нуклеотида бензимидазола и макроциклической корриновой системы:
Нуклеотидная часть молекулы включает нуклеиновое основание (5,6-диметилбензимидазол), углеводный фрагмент (рибоза) и остаток фосфорной кислоты. Корриновая система состоит из 3 пирролиновых циклов (А, В, С) и 1 пирроллидинового (цикл D):
В центре этой системы находится атом кобальта, который соединен координационными связями с гетероатомами азота 3 пирролиновых циклов и 4-й ковалентной связью – с атомом азота пирролидинового кольца D.
Кроме того, кобальт соединен ковалентной связью с цианогруппой и координационной связью с гетероатомом азота 5,6-диметилбензимидазола нуклеотидной части молекулы. Связь кобальта с остатком кислоты фосфорной является электровалентной, т.е. положительный заряд кобальта частично нейтрализован отрицательным зарядом кислоты фосфорной. Таким образом, цианокобаламин представляет собой одновременно и хелат, и внутреннюю соль, где катионом является корриновый фрагмент, а анионом – нуклеотидная часть.
В корриновой части имеются 3 ацетамидные группы (в положениях 2,1, 18) и 4 пропионамидные (во положениях 3, 8, 13, 17), а также 8 метильных групп. Причем в 17
м положении амидная группа замещена остатком аминоспирта.
Таким образом, нуклеотидная и корриновая части молекулы соединены между собой:
- пептидной и сложной эфирной связью (через 1-аминопропа- нол-2, этерифицированный кислотой фосфорной). Поскольку последняя этерифицирована также рибозой, витамин В12 можно рассматривать и как диэфир;
- координационной связью атома кобальта с гетероатомом азота бензимидазола;
- электровалентной связью между остатком фосфорной кислоты и атомом кобальта.
В молекуле цианокобаламина имеется несколько ассиметрических атомов углерода, поэтому лекарственные вещества этой группы оптически активны (левовращающие).
Оксикобаламин отличается от цианокобаламина тем, что атом кобальта связан не с CN-группой, а с оксигруппой. Кроме того, он является солью (гидрохлоридом).
В кобамамиде атом кобальта соединен ковалентной связью не с CN-группой, а с β-5’-дезоксиаденозильным остатком.
Физические и физико-химические свойства
По внешнему виду цианокобаламин, оксикобаламин и кобамамид-кристаллические порошки темно-красного цвета. Цианокобаламин умеренно и медленно растворим в воде, растворим в 95% спирте, практически нерастворим в эфире, хлороформе, ацетоне. Кобамамид трудно растворим в воде; оксикобаламин растворим в воде.
Все указанные лекарственные вещества поглощают свет в УФ- и видимой областях спектра. Поэтому спектрофотометрия широко используется в их анализе: для идентификации, количественной оценки, определения поглощающих примесей. Спектр поглощения цианокобаламина характеризуется 3 полосами поглощения с максимумами при 278, 361 и 550 нм. Поглощение при 278 нм обусловлено наличием фрагмента 5,6-диметилбензимидазола, при 361 нм – корриновой системой с 6 сопряженными двойными связями, при 550 нм – наличием атома кобальта.
Методы анализа
Кроме определения спектральных характеристик, при испытании на подлинность проводят реакции на кобальт и цианогруппу.
Определение кобальта. Предварительно кобальт переводят в ионогенное состояние, для чего лекарственное вещество сплавляют с калия гидросульфатом. Затем плав нейтрализуют щелочью; добавляют кислоту уксусную и натрия ацетат (буферная смесь), а затем раствор нитрозо- R-соли (1 -нитрозо-2-нафтол-3,6-дисульфонат натрия):
Появляется красное окрашивание, сохраняющееся после прибавления кислоты хлороводородной и кипячения. Последнее указывает на прочность комплекса, образованного трехвалентным кобальтом с реактивом:
Определение цианогруппы. Навеску пиан о кобаламина нагревают в пробирке с кислотой щавелевой, под действием которой выделяется кислота циановодородная. Последнюю обнаруживают с помощью фильтровальной бумаги, смоченной раствором бензидина и меди (II) ацетата, в результате чего образуется окрашенное в синий цвет комплексное соединение.
Цианокобаламин (а также оксикобаламин и кобамид) количественно определяют спектрофотометрически с применением стандартного образца лекарственного вещества.
Стабильность и хранение
Цианокобаламин неустойчив в кислой и щелочной средах, так как при этом идет его инактивация как витамина. Наибольшая устойчивость цианокобаламина наблюдается при pH 4,0—6,0. Оксикобаламин и кобамамид устойчивы в слабокислых буферных средах.
Микрофлора поглощает витамины В12, поэтому необходимо предусмотреть хранение в асептических условиях. Окислители, восстановители, соли тяжелых металлов также инактивируют эти вещества.
Цианокобаламин хранят в сухом, защищенном от света месте при комнатной температуре; кобамамид – при температуре не выше 5 °С, а оксикобаламин — при температуре не выше 10 °С (последние два лекарственных вещества являются термолабильными).
Источник
Производные бензопирана. Фармацевтический анализ бензопирана
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ПРОИЗВОДНЫЕ БЕНЗОПИРАНА
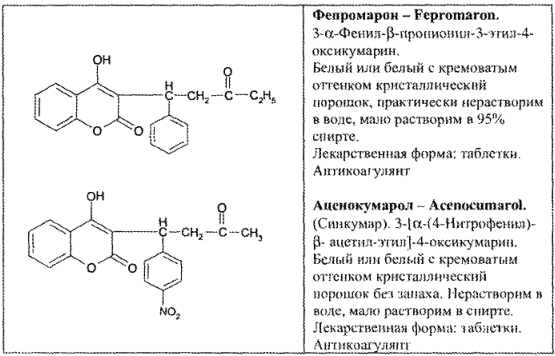
Данная группа включает ЛС различного фармакологического действия: производные кумарина (антикоагулянты), хромановые и фенилхромановые соединения (витамины).
Производные кумарина
Эта группа включает этилбискумацетат (неодикумарин), фепро- марон, аценокумарол (синкумар) (табл. 46).
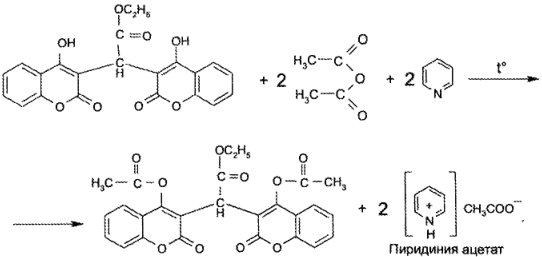
В основе молекулы этилбискумацетата лежит ядро кумарина — лактона о-оксикоричной кислоты. С другой стороны, лекарственное вещество является сложным эфиром (этиловым) замещенной кислоты уксусной и содержит 2 енольных гидроксила. Эти структурные фрагменты обусловливают химические свойства и методы анализа этилбискумацетата и близких к нему по строению фепро- марона и аценокумарола.
Кислотные свойства
Как енолэтилбискумацетат относится к ОН-кислотам. Поэтому он реагирует с раствором натрия гидроксида (эту реакцию применяют при количественном определении), а также дает окрашенную комплексную соль с железа (III) хлоридом (реакция подлинности).
Гидролитическое разложение
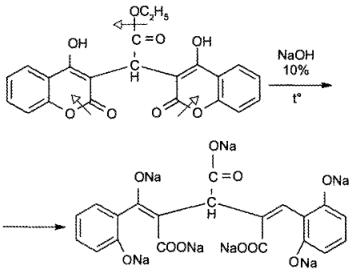
Как лактон и сложный эфир неодикумарин подвергается гидролитическому разложению. Характер продуктов реакции зависит от условий ее проведения.
Так, при нагревании с 10% раствором натрия гидроксида идет раскрытие лактонного цикла с образованием фенолокислоты:
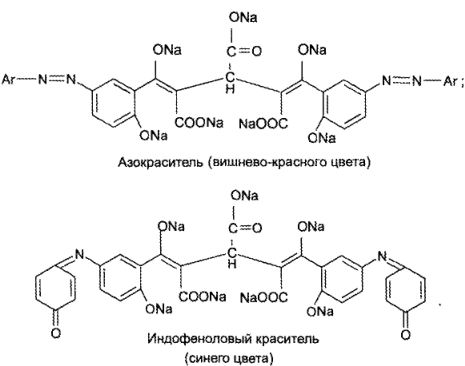
Продукт реакции (уже как фенол) можно идентифицировать с помощью реакций электрофильного замещения – образования азокрасителя (путем сочетания с солями диазония) и индофенолевого красителя (с хинонимином):
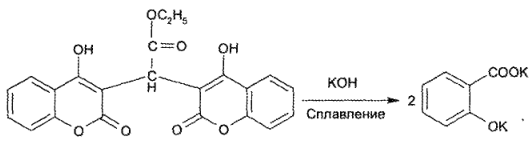
При гидролизе в жестких условиях (сплавление с кристаллическим натрия гидроксидом) происходит деструкция молекулы с образованием натриевой соли кислоты салициловой, которую идентифицируют с железа (III) хлоридом:
Гидроксамовая реакция
За счет лактонного цикла и сложно-эфирной группы неодикумарин вступает в гидроксамовую реакцию, что используют для его качественной и количественной оценки. Реакция не является специфичной, так как ее дают и другие сложные эфиры, лактоны, амиды, лактамы.
Для проведения реакции лекарственное вещество нагревают со щелочным раствором гидроксиламина. При этом образование гидроксамовой кислоты идет ио 3 фрагментам молекулы: сложно-эфирной группы и 2 лактонным циклам. Затем получают окрашенную соль — гидроксамат железа (III) или гидроксамат меди (II).
Реакция ацетилирования
Енольные гидроксилы обусловливают способность неодикума- рина давать сложные эфиры: при действии ангидрида уксусного идет реакция ацетилирования с образованием диацетата, который идентифицируют по Тпл. Данная реакция используется также для количественного определения (см. ниже).
Методы количественного определения
- Алкалиметрия. За счет кислотных свойств неодикумарин после растворения в ацетоне титруют водным раствором натрия гидроксида. В этих условиях этилбискумацетат ведет себя как одноосновная кислота, образуя однозамещенную соль (енолят). M1/z в данном случае равна М лекарственного вещества.
- Кислотно-основное титрование в неводной среде. Навеску этилбискумацетата растворяют в протофильном растворителе (бутила- мине) и титруют стандартным раствором лития гидроксида. Здесь лекарственное вещество ведет себя как двухосновная кислота и М(1/z) равна 1/2 М этилбискумацетата.
- Ацетилирование. Метод основан на реакции этерификации. На 1-й стадии неодикумарин нагревают с ангидридом уксусным в присутствии пиридина. При этом образуется диацетат и выделяется кислота уксусная, связываемая пиридином:
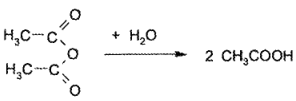
На 2-й стадии избыток ангидрида уксусного подвергают гидролизу, в результате чего образуется кислота уксусная:
На 3-й стадии выделившуюся кислоту уксусную оттитровывают стандартным 0,1 М раствором натрия гидроксида.
Параллельно проводят контрольный опыт.
Содержание этилбискумацетата (в %) определяют по формуле:
где Vk.o. – Vo.o — разница объемов (О,1 М раствора натрия гидроксида. пошедшего на титрование в контрольном и основном опытах), мл;
k — коэффициент поправки к титрованному раствору;
Т — титриметрический фактор пересчета;
Хромановые соединения (Токоферола ацетат, витамин Е)
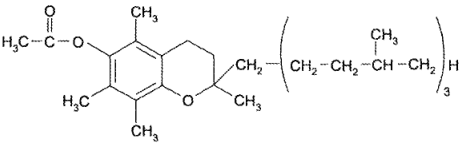
Токоферола ацетат — 6-ацетокси-2,5,7,8-тетраметил-2-(4’,8’,12’- триметилтридецил)-хроман:
Светло-желтая прозрачная вязкая маслянистая жидкость со слабым запахом. На свету окисляется и темнеет. Практически нерастворим в воде, растворим в 95% спирте, очень легко в эфире, хлороформе и растительных маслах.
В основе молекулы токоферола лежит ядро хромана (бензодигидропирана). Применяется в виде сложного эфира (ацетата), который более устойчив.
Токоферол имеет характерное поглощение в УФ-области спектра с максимумом при 285 нм в абсолютном спирте.
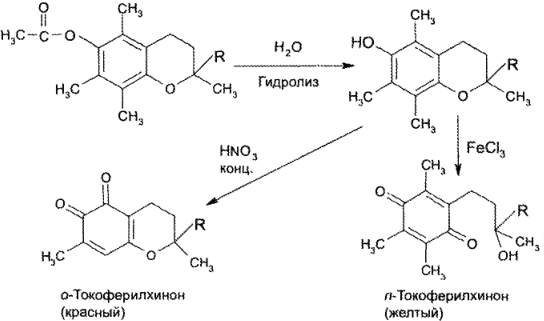
Восстановительные свойства
Характерным свойством токоферола ацетата является способность к окислению из-за наличия в молекуле лекарственного вещества фенольного гидроксила. Химическая структура продуктов окисления и их окраска зависят от характера окислителя. При действии хлорида железа (III), церия сульфата (IV) образуется п- токоферилхинон желтого цвета. Взаимодействие токоферола с сильными окислителями (например, с кислотой азотной концентрированной) приводит к образованию красного цвета о-токоферилхинона:
Слабые окислители действуют на токоферола ацетат только после гидролиза. При взаимодействии лекарственного вещества с железа (III) хлоридом ион Fе 3+ восстанавливается до иона Fе 2+ , который с о-фенантролином или α,α-дипиридилом образует хелатные комплексы оранжево-красного цвета.
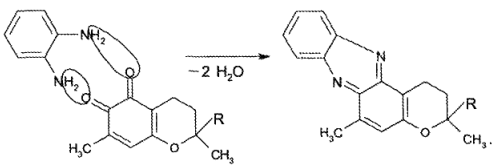
При конденсации продукта окисления токоферола кислотой азотной – о-токоферилхинона – с о-фенилендиамином образуется феназиновый краситель красно-оранжевого цвета с желто-зеленой флтооресценцией:
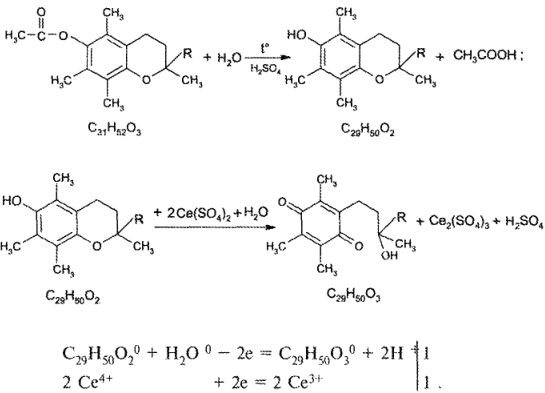
Количественное определение
Токоферола ацетат количественно определяют периметрически, используя выраженные восстановительные свойства лекарственного вещества. После предварительного гидролиза токоферола ацетата (нагревание с раствором кислоты серной) образовавшийся токоферол титруют стандартным раствором церия (IV) сульфата. При этом токоферол окисляется до n-токоферилхинона:
Как видно из уравнения реакции, M1/z равна 1/2 М токоферола ацетата.
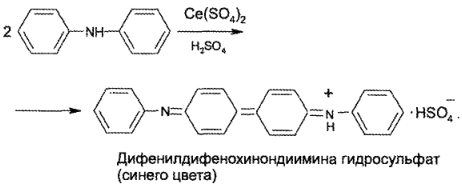
В качестве индикатора применяют дифениламин (бесцветный), который в точке эквивалентности окисляется избыточной каплей титранта до окрашенного в синий цвет дифенилдифенохинондиимина сульфата:
Легкая окисляемость токоферола ацетата, особенно на свету, является причиной его нестабильности при хранении.
Фенилхромановые соединения
К данной группе лекарственных вешеств относятся флавоноиды (витамины группы Р) – рутозид (рутин), кверцетин и дигидрокверцетин.
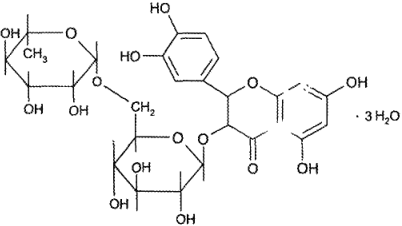
Рутозид (Rutosidum) – 3-рутинозид кверцетина или 3-рамногликозил- 3,5,7,3 ’,4 ’ – не> пентаоксифлавон:
Зеленовато-желтый мелкокристаллический порошок. Практически нерастворим в воде, мало растворим в 95% спирте, практически нерастворим в растворах кислот, эфире, хлороформе, ацетоне и бензоле, растворим в разбавленных растворах едких щелочей.
По химическому строению рутозид является гликозидом. Сахарная часть (дисахарид рутиноза) включает D-глюкозу и L-рамнозу, Агликон — квернетин, относится к флаваноидам, содержащим ядро хромана (дигидробензпирана).
Для рутозида характерно поглощение в УФ-области спектра при 2 максимумах — 259 и 362,5 нм. Это свойство используется для определения подлинности, доброкачественности (при идентификации примеси кверцетина) и количественного анализа.
Кислотные свойства
Наличие фенольных гидроксилов придает соединению кислотные свойства и, как следствие, способность растворяться в разбавленных щелочах с углублением окрашивания до желто-оранжевого цвета.
Образование азокрасителей
Как фенол рутозид способен вступать в реакцию азосочетания с образованием азокрасителя. Для этого необходимо сначала получить соль диазония и добавить ее к щелочному раствору рутина. При этом появляется темно-красное окрашивание.
Реакции на сахарный компонент
Являясь гликозидом, рутозид дает положительную реакцию на сахарный компонент с реактивом Фелинга, что позволяет отличить его от кверцетина (агликона). Для этого рутозид предварительно подвергают кислотному гидролизу при нагревании, в результате чего разрушается гликозидная связь и освобождаются сахара, обладающие восстановительными свойствами. Далее при кипячении с реактивом Фелинга образуется красный осадок меди (I) оксида.
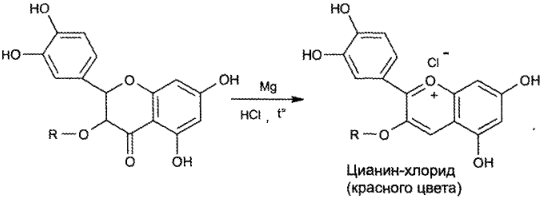
Образование пирилневых солей (цианидиновая проба)
Специфической реакцией подлинности на рутозид и кверцетин является цианидиновая проба. Она основана на образовании окрашенных пирилневых солей при восстановлении водородом флавоноидного фрагмента. Для этого на спиртовой раствор рутозида действуют кислотой хлороводородной концентрированной и порошком магния. Появляется красное окрашивание, присущее цианин-хлориду, — соли бензопирилия или бензопироксония:
Количественное определение
За счет ароматичности системы и наличия сопряженных двойных связей в сочетании с карбонильной группой для рутозида характерно поглощение в УФ-области спектра. Измеряют оптическую плотность спиртового раствора лекарственного вещества при определенной длине волны.
Источник