- Побочные эффекты лекарственных трав
- Вестник «ЗОЖ». Коварные травы или мифы и правда о растениях
- Зверобоя трава (Hyperici herba)
- Владелец регистрационного удостоверения:
- Лекарственная форма
- Форма выпуска, упаковка и состав препарата Зверобоя трава
- Фармакологическое действие
- Показания активных веществ препарата Зверобоя трава
- Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
Побочные эффекты лекарственных трав
- Главная
- →
- Новости
- →
- 2019 год
- →
- Вестник «ЗОЖ». Коварные травы или мифы и правда о растениях
Вестник «ЗОЖ». Коварные травы или мифы и правда о растениях

Во всем мире люди искренне считают, что травки гораздо лучше синтетических таблеток. Спору нет — эффективность фитотерапии проверена веками. Но на самом деле современная «химия» может быть практически безвредной, а ряд трав принимать без консультации специалиста попросту опасно.
Правда о лекарственных растениях
Миф 1. Травы лучше таблеток, потому что содержат множество компонентов.
«Коктейль» из разных компонентов кроме очевидных плюсов, имеет и минусы. Целебные вещества в растениях не всегда сочетаются удачно. Они могут друг друга нейтрализовать, дублировать, оказывать противоположное действие и даже непредсказуемо взаимодействовать между собой.
Лечебные травы, хотя и применяются тысячелетиями, современной наукой изучены гораздо хуже, чем синтетические таблетки. Весьма непросто проанализировать воздействие на организм даже одного химического вещества. Изучить же свойства каждого компонента травки и их взаимодействие во много раз труднее.
К тому же концентрация лечебных веществ неодинакова даже в двух кустиках травы, растущих в одном лесу. Если же травы собраны в разных регионах, разница в целебных свойствах может быть очень значительна. К примеру, женьшень, выращенный в средней полосе России, совсем не так эффективен, как дальневосточный. Поэтому при использовании растений неизбежны передозировки или, наоборот, «недоборы» дозы лекарства. Это может сказываться на качестве лечения.
Миф 2. В лечебных растениях нет никакой «вредной химии».
Несколько столетий назад так все и было. Но сегодня в круговорот веществ в природе попало очень много «химии». Все вредные соединения могут накапливаться и в лекарственных растениях. Уже известны случаи отравлений загрязненными мышьяком китайскими травами.
Миф 3. Травы не чужеродны для человека. Их воздействие ограничивается регуляцией естественных сил организма в лучшую сторону.
К сожалению, большинство растительных лечебных компонентов не копирует биологически активные соединения человека. Как и синтетические лекарства, растительные препараты лишь имеют сходство с веществами-регуляторами человеческого организма. Поэтому у трав возможно и лечебное действие, и побочные эффекты.
Миф 4. Травы не вызывают аллергии.
Это совсем не так. Каждый пятый сегодня страдает поллинозом, который как раз является аллергической реакцией на растения. Поэтому любая трава может вызвать неожиданную сыпь, заложенность носа и более серьезные проявления аллергии.
Не исключены и другие непредсказуемые реакции на прием трав. Известно, например, что китайский лимонник придает бодрость и повышает выносливость. Однако примерно у каждого двадцатого человека лимонник вместо подъема сил вызывает вялость и угнетенность.
Миф 5. Компоненты лечебных трав натуральные, а поэтому безвредные.
Многие травы действительно не вызывают серьезных побочных эффектов. Однако яд кураре делают из южноамериканских растений, а от небольшой передозировки настоя наперстянки может остановиться сердце. Некоторые травы способны повышать давление, разрушать красные кровяные тельца, клетки печени и преподносить другие неприятные сюрпризы.
Миф 6. В связи с достаточно мягким действием растительных средств их можно употреблять сколь угодно долго.
Это ошибочное мнение. При длительном приеме одного и того же растительного средства к нему может возникнуть привыкание, а эффективность заметно снизится. Поэтому специалисты рекомендуют периодически менять травы и сборы из них. В среднем схему траволечения рекомендуется обновлять через каждые 3-4 недели.
Некоторые растения в принципе непригодны для длительного лечения. Накапливаясь в организме, они начинают оказывать выраженное отрицательное воздействие. К таким растениям относятся, например, чистотел, полынь, тысячелистник.
Некоторые лекарственные растения содержат ядовитые и сильнодействующие вещества. Применять их нужно с особой осторожностью, точно соблюдая рекомендации врача и дозировку.
К ядовитым растениям относят багульник, полынь, черемицу, омелу, чистотел, папоротник, можжевельник и многие другие. Они могут отрицательно влиять на нервную систему, кровь, печень и почки.
Список «вредных» растений постоянно расширяется. Так, в научной литературе недавно был опубликован перечень трав, опасных для печени. Как это ни печально, но в него были включены даже такие наши «старые знакомые», как мать-и-мачеха, сенна и валериана. Но даже у неядовитых лекарственных растений много противопоказаний к применению.
Сок из свежих листьев алоэ противопоказан при воспалении почек и мочевого пузыря, геморрое, маточных кровотечениях.
Аралию, заманиху, родиолу розовую, лимонник и женьшень не рекомендуется применять при гипертонии, бессоннице, повышенной нервной возбудимости.
Донник при длительном употреблении вызывает головокружение, головные боли, тошноту, рвоту.
Зверобой нельзя применять при высокой температуре, гипертонии.
Клюква может вызвать обострение язвенной болезни желудка и двенадцатиперстной кишки.
Кукурузные рыльца, крапиву и пастушью сумку нельзя применять при повышенной свертываемости крови.
При подагре и мочекаменной болезни нежелательно есть малину, калину и щавель.
Мелиссу и перечную мяту не рекомендуют при пониженном артериальном давлении.
Препараты из подорожника не назначают при гастритах с повышенной секреторной функцией желудка.
Репчатый лук противопоказан при недугах почек, печени и острых заболеваниях желудка.
При продолжительном приеме солодки возможны нарушения в половой сфере, задержка жидкости в организме, вплоть до появления отеков и повышение артериального давления.
Чабрец не назначают при болезнях почек, печени, желудка, щитовидной железы, атеросклерозе сосудов сердца и головного мозга.
Черная редька и репа противопоказаны при различных заболеваниях сердца, печени, почек, язвенной болезни желудка и двенадцатиперстной кишки и других недугах желудочно-кишечного тракта.
Черноплодную рябину нежелательно употреблять при пониженном давлении, язвенной болезни желудка и двенадцатиперстной кишки, повышенной свертываемости крови.
Хрен и чеснок оказывают раздражающее действие на почки и слизистую оболочку желудочно-кишечного тракта. Поэтому их нельзя есть при острых и хронических воспалительных процессах системы пищеварения и почек.
Шалфей противопоказан при острых воспалительных процессах в почках.
При беременности нельзя применять все ядовитые растения. Опасны также алоэ, женьшень, полынь, зверобой, термопсис, анис, солодка, шалфей. Не рекомендуются будущим мамам чаи с душицей, ромашкой, чабрецом, листьями малины, мать-и-мачехой, зверобоем. Лучше также не использовать пустырник, дягиль, имбирь, тысячелистник, семена укропа, почки березы, тополя и сосны и полевой хвощ. Не применяются у беременных и растительные слабительные: крушина, ревень, сенна.

Если предстоит операция…
Может ли чай из трав повлиять на исход операции? Над этим вопросом мало кто задумывается. Однако недавно в Чикагском университете было проведено крупное научное исследование. Выяснилось, что, вполне безобидные «дары природы» могут непредсказуемо изменить ход наркоза, операции и послеоперационного периода.
Для изучения американские специалисты выбрали самые популярные в США и в мире лекарственные растения.
Оказалось, что препараты с эхинацеей повышают риск аллергических реакций, могут негативно влиять на лечение иммунными препаратами и затруднять заживление раны. Прием эхинацеи необходимо прекратить как можно раньше до операции.
Препараты чеснока, гингко билоба и женьшеня неплохо предотвращают образование тромбов. Однако в случае операции они повышают риск кровотечения. Их прием нужно прекратить за неделю до операции.
Растение кава-кава может увеличивать успокаивающее действие наркоза. Поэтому за сутки до операции препараты из кава-кава отменяют.
Лекарства из зверобоя — прекрасные антидепрессанты. Но они изменяют превращения других лекарств в организме. От зверобоя нужно отказаться за пять дней до операции.
Препараты валерианы могут повысить потребность в средствах для наркоза. Поэтому их прием прекращают за неделю до операции.
Кстати, валериану и другие успокаивающие травы не рекомендуется принимать вместе с противоаллергическими препаратами – димедролом, тавегилом и супрастином. При таком сочетании может усилиться вялость и сонливость.

Правила «травяной» безопасности
При фитотерапии обязательно учитываются сопутствующие заболевания и все возможные эффекты лекарственных растений.
К примеру, многие травы обладают желчегонным действием. Для людей с функциональными проблемами желчного пузыря эти растения чрезвычайно полезны.
Но если у пациента в желчном пузыре есть камни, прием желчегонных противопоказан. Камни могут сдвинуться с места и закупорить желчный проток. В результате потребуется срочная операция.
Кроме сопутствующих заболеваний надо знать совместимость трав с принимаемыми вами химическими препаратами и пищей. Дело в том, что при их «встрече» в организме могут возникнуть совершенно неожиданные реакции.
Например, женьшень, который часто используется как тонизирующее средство, несовместим с кофе и препаратами, содержащими кофеин. Такой «коктейль» может вызвать вместо бодрости повышенную возбудимость и раздражительность. Самый простой способ избежать подобных нежелательных взаимодействий – принимать женьшень и кофе в разное время суток.
Но некоторые сочетания трав и лекарств недопустимы в принципе. Так, при употреблении тетрациклина и сульфаниламидов нельзя одновременно применять зверобой. Это сочетание резко усиливает светочувствительность кожи. И даже несколько минут, проведенных на солнце, могут стать причиной солнечных ожогов.
Прежде чем приступать к лечению травами, проконсультируйтесь с врачом-фитотерапевтом.
Источник
Зверобоя трава (Hyperici herba)
Владелец регистрационного удостоверения:
Лекарственная форма
 | Зверобоя трава |
Форма выпуска, упаковка и состав препарата Зверобоя трава
| Сырье растительное измельченное | 1 пачка |
| трава зверобоя продырявленного | 50 г |
50 г — пачки картонные с вложением пакетов бумажных.
Фармакологическое действие
Средство растительного происхождения. Содержит производные антрацена — главным образом гиперицин, псевдогиперицин; флавоноиды — гиперозид, кверцитин, рутин, изокверцитин, аментофлавон; ксантоны — 1,3,6,7-тетрагидрокси-ксантон; ацилхлороглуцинолы: гиперфорин с небольшими количествами адгиперфорина; эфирные масла; олигомеры; процианидины и другие катехиновые танины; производные кофеиновой кислоты, включая хлорогеновую кислоту.
Оказывает мягкое антидепрессивное, седативное и анксиолитическое действие, а также стимулирующее действие на органы ЖКТ, кровообращение, общее тонизирующее действие.
Полагают, что антидепрессивное действие растения обусловлено способностью его активных веществ ингибировать обратный захват серотонина и других нейротрансмиттеров, а также влиянием на обмен мелатонина.
Благодаря высокому содержанию флавоноидов растение оказывает противовоспалительное действие. Установлено, что гиперфорин ингибирует рост грамположительных бактерий Streptococcus pyogenes и Streptococcus agalactiae. Показана эффективность гиперфорина в отношении пенициллин-резистентных штаммов и метициллин-резистентных штаммов Staphylococcus aureus.
Показания активных веществ препарата Зверобоя трава
Внутрь: симптоматические и реактивные депрессии, состояние беспокойства, нарушения сна. В качестве дополнительного средства при эндогенных депрессиях (особенно в климактерическом периоде), а также при заболеваниях легких, желудка, кишечника, желчного пузыря; хронический колит (в составе комплексной терапии).
Наружно и местно: воспалительные заболевания полости рта (в т.ч. гингивит, стоматит); в качестве дополнительного средства при суставных и мышечных болях, а также при кровоизлияниях и опоясывающем герпесе; для дезинфекции ран.
Источник
Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
Батюшин М.М. 1 , Садовничая Н.А. 1 , Руденко Л.И. 1 , Повилайтите П.Э. 2
1 Кафедра внутренних болезней с основами физиотерапии №2, Нефрологическое отделение ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Ростовское областное патологоанатомическое бюро Министерства здравоохранения Ростовской области, г.Ростов-на-Дону
Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014423 Эл.почта: batjushin-m@rambler.ru, sadovnichaya@list.ru, nephr-roon@rambler.ru
За прошедшее десятилетие отмечен значительный рост популярности «нетрадиционной медицины». Это объясняется такими факторами, как неудовлетворенность методами и эффективностью ранее проводимого лечения, бесконтрольным использованием информации о неблагоприятных побочных действиях фармацевтических препаратов, ростом цен на фармакопейные лекарственные средства и низким уровнем общей культуры населения. В отношении использования сбора лекарственных растений в литературе имеются указания на ограничения их применения, так как их прием при определенных заболеваниях может вызывать нежелательные побочные эффекты. В Европе, США и Канаде постоянно увеличивается доля населения, регулярно использующего фитотерапевтические средства и биологически активные добавки, в странах Азии и Африки более 30% всех случаев острого почечного повреждения развивается как осложнение лечения растительными препаратами [1, 2]. По данным исследования импортированных патентованных азиатских аюрведических растительных продуктов в Калифорнии, было установлено, что 32% из них содержали не декларированные фармацевтические средства и тяжелые металлы (свинец, ртуть, кадмий, мышьяк). Среди не декларированных веществ наиболее часто встречаются: эфедрин, хлорфениламин, колхицин, метилтестостерон, глюкокортикостероиды, нестероидные противовоспалительные препараты [3, 4, 5, 6, 7, 8]. Сегодня в Европе зарегистрировано более 100 препаратов, содержащих растительные флавоноиды. Они обладают антиоксидантной активностью и применяются в основном в лечении нарушений периферического кровообращения.
Потенциальное значение этой проблемы чрезвычайно велико, в частности остается неясной степень взаимодействия фармацевтического препарата с травами и растительными продуктами [9, 10]. Неконтролируемый прием лекарственных трав может превышать потенциальный положительный эффект, особенно среди лиц с заболеваниями почек [11, 12, 13, 14], что связано с непосредственным воздействием растительных препаратов на клетки канальцев и их активной реабсорбцией с достижением высокой концентрации в мозговом слое. Результатом такого воздействия на почки является острое канальцевое повреждение, папиллярный некроз, острый и хронический интерстициальный нефрит, синдром Фанкони, нефролитиаз, артериальная гипертензия, рабдомиолиз [15, 16].
К фитотоксинам, обладающим прямым нефротропным действием относят аристохолиевую кислоту, сапонины, метилсалицилат, флавоноиды, ореллаин, алкалоиды эфедры, охратоксин [17]. На территории России наиболее часто с целью лечения и профилактики заболеваний почек применяются такие лекарственные травы как: пижма, барбарис, берѐза, бессмертник песчаный, брусника, бузина, календула, кукуруза (рыльца), можжевельник, толокнянка, хвощ, шиповник, репешок обыкновенный (Argimonia Eupatoria), а также марена красильная грузинская (Rubia tinctorum var. iberica), дикорастущая трава.
Репешок обыкновенный (Argimonia Eupatoria) – многолетнее травянистое растение, широко распространенное в европейской части России, на территории Западной и Восточной Сибири, Дальнего Востока [18]. В народной и традиционной медицине все части растения применяются при широком спектре заболеваний в качестве желчегонного, противовоспалительного, антиаритмического, гипогликемического, антигельминтного, анальгетического, гемостатического, антигипертонического, антитоксического и антиканцерогенного средства. В европейских странах некоторые виды Agrimonia являются официальными лекарственными растениями и используются в практической медицине как вяжущее, противовоспалительное средство [19]. При проведении биохимического анализа структуры растения в надземной части A.Eupatoria обнаружены вещества фенольной природы (филавоноиды, дубильные вещества, кумарины, изокумарины, оксикоричные кислоты), тритерпеноиды, эфирное масло, полисахариды и др., а в подземных органах растения обнаружены медь, цинк, железо, ванадий, никель, хром, титан, марганец, стронций, цирконий, серебро [20].
Токсические эффекты А. Eupatoria в большей степени связаны не со специфическими токсикантами, а с наличием в нем большого количества гликозидов кумарина и его метаболитами. В 1994 г. на основании углубленного анализа токсикологических исследований экспертами Европейского Совета сделаны рекомендации о снижении допустимого уровня содержания кумарина в продуктах питания до 0,5 мг/кг вследствие его канцерогенного и мутагенного действия.
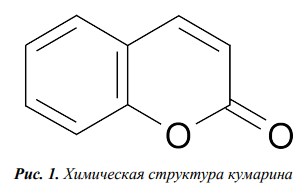
КУМАРИН (2-хроменон) имеет молекулярную массу 146,14 и представляет собой бесцветные кристаллы с запахом свежего сена и горьким вкусом (рисунок 1).
Рис. 1. Химическая структура кумарина
Сообщения о гепатотоксических эффектах для человека, развивающихся вследствие приема кумарин-содержащих лекарственных препаратов, часто противоречивые, вызвали значительный интерес исследователей к изучению его метаболизма и механизма токсического действия [20, 21].
Современные представления о метаболизме кумарина предполагают наличие двух основных путей трансформации данного соединения в организме млекопитающих. Первый этап трансформации кумарина реализуется по двум направлениям: в результате 7-гидроксилирования кумарина образуется малотоксичный 7-гидроксикумарин, элиминирующийся из организма млекопитающих с мочой; в процессе 3-гидроксилирования образуется 3-гидроксикумарин, промежуточным метаболитом в данном процессе является токсичный 3,4-эпоксид, подвергающийся дальнейшей трансформации с образованием о-гидроксифенилальдегида, окисляющегося до о-гидроксиэтанола и о-гидроксифенилуксусной кислоты. Рядом авторов было показано, что доминирование одного из двух направлений метаболизма кумарина в организме обусловливает межвидовые различия в проявлении гепатотоксических свойств данного соединения [22, 23]. Риск осложнений при приеме кумарина возрастает при сочетанном приеме НПВС, антикоагулянтов прямого и непрямого действия.
В экспериментальных работах [24, 25] установлено, что кумарин при однократном введении в больших дозах крысам вызывает центрилобуллярный некроз гепатоцитов. Это свидетельствует о том, что метаболизм кумарина [3-l4C] в данном случае проходил с образованием более токсичных метаболитов. Исследования in vitro показали, что химически активные [3-l4C]-кумариновые метаболиты, образующиеся при участии цитохром P450-зависимых энзимов, способны ковалентно связывать микросомальные протеины [26]. Было сделано предположение, что токсическим метаболитом в данном случае может выступать 3,4-эпоксид.
Нами представлен случай нефротоксического действия алкалоидов кумарина и его метаболитов при употреблении отваров и настоев Репешка обыкновенного.
Пациентка А. 43 лет, поступила в нефрологическое отделение клиники РостГМУ с жалобами на легкую ноющую боль в поясничной области с обеих сторон, усиливающуюся при физической нагрузке, пастозность голеней и стоп, периодически повышающееся артериальное давление до 220/140 мм рт. ст., не связанное с психоэмоциональными и/или физическими нагрузками, сопровождающееся головной болью и головокружением. Из анамнеза известно, что в 1990 году в течение всего периода первой беременности выявлялась протеинурия до 3,3 г/л, не сопровождающаяся отечным синдромом и артериальной гипертензией, в течение 5 лет после родов протеинурия сохранялась на уровне 0,5-1,0 г/л. В 1995 г. впервые зарегистрирован высокий уровень артериального давления (АД) – 150/100 мм рт. ст. Антигипертензивную терапию не получала, однако с 1999 г. артериальная гипертензия приобрела злокачественный характер, с повышением уровня системного АД до 200/120 мм рт. ст., по поводу чего в 2000 году проходила обследование в стационаре, где был поставлен диагноз гипертонической болезни II стадии, 3 степени, риск 3 (высокий), тогда же была подобрана антигипертензивная терапия, позволявшая контролировать АД на уровне 130-150/80-90 мм рт. ст., но пациентка данные рекомендации не соблюдала, а самостоятельно приобрела фитопрепарат (Репешок обыкновенный), отвар и настои которого, принимала более полугода непрерывно по несколько раз в сутки. В 2001 году, во время прохождения планового медицинского осмотра выявлен нефросклероз справа, дальнейшего наблюдения и лечения не проходила. В 2008 году при выполнении ультразвукового исследования почек выявлен конкремент правой сморщенной почки, по данным реносцинтиграфии функция правой почки отсутствует.
Помимо приема фитопрепаратов постоянно использует дипиридамол в дозе 75 мг/сутки, эналаприл 10 мг/сутки с 2001 года, в 2011 году уровень протеинурии составил 0,044 г/л, уровень артериального давления до 240/140 мм ртутного столба.
По данным клинико-лабораторного обследования в нефрологическом отделении клиники РостГМУ со стороны ОАК на себя обращали внимание ускорение СОЭ до 32 мм/час, признаки анемии легкой степени тяжести (эритроцитов 2,52х1012/л, гемоглобин 100 г/л), снижение количества тромбоцитов (75х103 /л), со стороны свертывающей системы крови по данным коагулограммы выявлены признаки гипокогуляции, характеризующиеся снижением АПТВ до 20 сек., протромбиновое время 10 сек., МНО 0,5, тромбиновое время 6 сек., фибриноген 1,98 г/л, со стороны биохимических показателей крови отмечалась гиперхолестеринемия до 10,79 мМ/л, гиперазотемия (креатинин крови 129 мкМ/л, мочевина 14,9 мМ/л), уровень АСТ достигал 68 Ед/л, АЛТ – 51 Ед/л. В ОАМ – протеинурия, характерная для нефритического синдрома (до 0,4 г/л). Снижение концентрационной функции почек, проявляющееся снижением СКФ до 45,5 мл/мин (по формуле MDRD), изостенурией (по данным пробы Фольгарда). Суточная протеинурия не превышала 0,495 г/сутки, по данным суточной экскреции солей с мочой отмечается высокая экскреция кальция до 9,73 мМ/сутки, и мочевой кислоты до 9,13 мМ/сутки. За все время наблюдения состояние пациентки оставалось стабильным, уровень АД в пределах 130-140/70-80 мм рт. ст., суточный диурез около 1500-1700 мл. По данным УЗИ почек отмечаются диффузные изменения паренхимы почек, уменьшение размеров, микролит правой почки.
Таким образом, клиническая картина болезни соответствовала аутоиммунному заболеванию почек, на что указывали наличие протеинурии, мочевой синдром, характеризующийся микрогематурией, снижением азотвыделительной функции почек, наличием артериальной гипертензии, тем не менее, нельзя было исключить наличие хронического повреждения канальцевого эпителия, преимущественно в проксимальных отделах, с нарушением реабсорбции, без формирования клиники острого канальцевого некроза, что позволило заподозрить наличие специфического патологического процесса, связанного с токсическим влиянием метаболита кумарина на канальцевый эпителий почек. Следует также учесть наличие процесса нефросклероза в правой почке, вероятно, обусловленного мочекаменной болезнью в анамнезе.
Пациентке была выполнена пункционная нефробиопсия левой почки с последующим морфологическим исследованием биоптата с целью верификации патологического процесса и определения тактики терапии. В результате получены следующие данные.
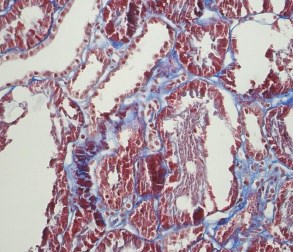
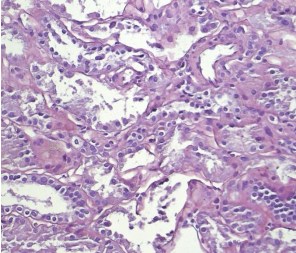
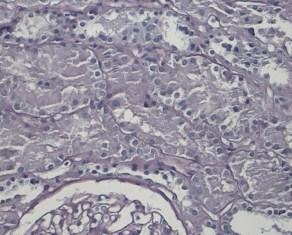
Светооптически 1 из 9 клубочков склерозирован полностью, остальные гипертрофированы. В одном клубочке выраженная интракапиллярная гиперклеточность и пролиферация базальных мембран. Остальные клубочки не имеют признаков выраженных пролиферативных изменений, за исключением сегментарного расширения парамезангиальных зон. Сегментарного склероза капиллярных пучков не наблюдается. В интерстиции слабый диффузный и мелкоочаговый фиброз. Резко выраженная гидропическая дистрофия эпителия канальцев вплоть до вакуолизации (рисунки 2, 3, 4).
Рис. 2. Х20 массон1 – резко выраженные дистрофические изменения эпителия канальцев, его слущивание
Рис. 3. Х20 ШИК – резко выраженные повреждения эпителия канальцев – слущивание фрагментов цитоплазмы и целых клеток в просвет канальцев
Рис. 4. Х20 ШИК – расширение и гиперклеточность мезангиальных зон
Окраска на амилоид отрицательна. Иммуноморфологически: IgA в клубочках: отрицательно, в канальцах: отрицательно, IgG в клубочках: отрицательно, в канальцах: отрицательно, IgM в клубочках: единичное редкое пунктирное, в канальцах: единичные цилиндры, C3 комплимент: единичные зерна в клубочках и в капсуле, а также зернистое в стенках артериол, C1q комплимент: отрицательно. Каппа: отрицательно в клубочках, единичные очаги в интерстиции. Лямбда: отрицательно в клубочках, единичные очаги в интерстиции. Электронномикроскопически: толщина и структура базальных мембран в пределах нормы, депозитов не обнаружено. Имеются протяженные очаги распластывания малых отростков подоцитов, пролиферация мезангиальных клеток отсутствует. Результаты были интерпретированы как очаговое распластывание малых отростков подоцитов, а также тубулопатия неясного генеза. Особое внимание в клинической картине на себя обращало постепенное нарастание протеинурии, артериальной гипертензии на фоне снижения фильтрационной функции почек и канальцевой дисфункции. Подобная двойственность клинических проявлений препятствовала пониманию сути патологического процесса в почках, и не позволяла в полной мере проводить медикаментозную терапию, отвечающую патогенетическим и этиологическим принципам. Указание в анамнезе на длительный прием фитопрепаратов позволило предположить токсическое воздействие метаболитов кумарина на функциональное состояние почек, однако в доступной литературе нет прямых указаний на прямое нефротоксическое действие кумарина. Исследователи ограничивают область токсических влияний кумарина и его метаболитов на функцию печени и гемостаза. Действительно, в рассматриваемом клиническом примере отмечаются как нарушения гемостаза, характеризующиеся гипокоагуляцией, так и печеночная дисфункция. Однако по данным нефробиопсии отмечаются признаки токсического процесса на уровне канальцев почки, характеризующегося резко выраженной гидропической дистрофией эпителия канальцев вплоть до вакуолизации, слабым диффузным и мелкоочаговым фиброзом интерстиция. Эти изменения соотносятся с изменениями клубочков, характеризующимися выраженной интракапиллярной гиперклеточностью и пролиферацией базальных мембран, сегментарным расширением парамезангиальных зон, наличием очагов распластывания малых отростков подоцитов.
Таким образом, впервые в литературе описан случай прямого нефротоксического воздействия кумарина и его метаболитов. Повреждение канальцевого эпителия почек метаболитами кумарина обуславливается во многом изначальным повреждением гломерулярной базальной мембраны, а также дисморфизмом подоцитов, что обуславливает повышенную готовность канальцевого эпителия к повреждению на фоне усиления процессов реабсорбции в связи с дефектами гломерулярной базальной мембраны и подоцитов. В свою очередь, низкая молекулярная масса кумарина и его метаболитов позволяет свободно проникать через гломерулярный фильтр, что, в условиях повреждения базальной мембраны и подоцитов, приводит к критическому повышению его в первичной моче и обуславливает токсическое действие на уровне канальцев почки.
Литература
1. Ермоленко, В.М. Острая почечная недостаточность / В.М. Ермоленко, А.Ю. Николаев – М.: Гэотар-Медиа, 2010. – 400 с.
2. Angell, M. Alternative medicine – the risks of untested and unregulated remedies / M. Angell, J.P. Kassirer // N. Engl. J. Med. – 1998. – V.339. – P.839-841.
3. Fugh-Berman, A. Herb-drug interactions / A. Fugh-Berman // Lancet. – 2000. – V.355. – P.134-138.
4. Recent patterns of medication use in the ambulatory adult population of the United States: the Spone survey / D.W. Kaufman, J.P. Kelly, L. Rosenberg et al. // JAMA. – 2002. –V.287. – P.337-344.
5. Screening methods for drugs and heavy metals in Chinese patent medicines / A. Au, R. Ko, F. Boo et al. // Bull. Environ. Contam. Toxicol. – 2000. – V.5. – P.112-119.
6. Chopra, A. Ayurvedic medicine: core concept, therapeutic principles, and current relevance/ A. Chopra, V. Doiphode. // Med. Clin. North. Am. – 2002. – V.86. – P.75-89.
7. Ernst, E. Heavy metals in traditional Indian remedies / E. Ernst // Eur. J. Clin. Pharmacol. – 2002. – V.57. – P.891-896.
8. The use and safety of non-allopathic Indian medicines / N. Gogtay, H. Bhatt, S. Dalvi, N. Kshirsagar // Drug Saf. – 2002. – V.25. – P.1005-1019.
9. Indian herbal remedies for diabetes as a cause of lead poisoning / R.W. Keen, A.C. Deacon, H.T. Delves et al. // Postgraduate Medical Journal. – 1994. – V.70. – P.113-114.
10. Ko, R.J. Adulterants in Asian patent medicines / R.J. Ko // N. Engl. J. Med. – 1998. – V.339. – P.847.
11. Arlt, V. Aristolochic acid as a probable human cancer hazard in herbal remedies: a review / V. Arlt, M. Stiborova, H. Schmeiser // Mutagenesis. – 2002. – V.17. – P.265-277.
12. Trends in alternative medicine use in the United States, 1990-1997: results of a follow-up national survey / D.M. Eisenberg, R.B. Davis, S.L. Ettner et al. // JAMA. – 1998. – V.280. – P.1569-1575.
13. Ernst, E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review / E. Ernst // J. Intern. Med. – 2002. – V.252. – P.107-113.
14. Foote, J. Medicinal herb use and the renal patient / J. Foote, B. Cohen // J. of Renal Nutrition. – 1998. – V.8. – P.40-42.
15. International Agency for Research on Cancer (IARC). Some traditional herbal medicines, some mycotoxins, nafhtalene and styrene. In IARC Monographs on the Evaluation of Carcinogenic Risks of Chemicals to Humans. Lyon. France: IARC, 2002. – Р.82.
16. Herbs and the kidney/ C. Isnard Bagnis, G. Deray, A. Baumelou et al. // Am. J. Kidney Dis. – 2004. – V.44. – №1. – P.1-11.
17. Morris L. Side-effects of coumarin / L. Morris, P.D. Welsby // Postgrad. Med. J. – 1995. – №71. – P.701-702.
18. British Herbal Pharmacopoeia. – 1996. – 212 p.
19. Advances in research on chemical constituents and pharmacological activities of Agrimonia pilosa / G. Hong, Y.H. Dai, P.X. Liu et al.// Pharm. Care and Research. – 2008. – V.8. – № 5. – P.362-366.
20. Карташова, Г.С. Содержание дубильных веществ в Agrimonia pilosa Ledeb. / Г.С. Карташова, И.В. Гравель, Е.Г. Таран // Растительные ресурсы. – 1991. – Т.27. – №1. – С.139-143.
21. Wei, Y. Isolation of hyperoside and luteolin-glucoside from agrimonia pilosa ledeb using stepwise elution by high-speed countercurrent chromatography / Y. Wei, Y. Ito // J. of Liquid Chromatography and Related Technologies. – 2007. – V.30. – №9-10. – P.1465–1473.
22. Separation and determination of flavonoids in Agrimonia pilosa Ledeb. by capillary electrophoresis with electrochemical detection / X. Xu, X. Qi, W. Wang, G. Chen // J. of Separation Science. – 2005. – V.28. – №7. – P.647-652.
23. Analysis of the volatile components of Agrimonla Pilosa Ledeb by gas chromatography-mass spectrometry / Y.W. Li, L.F. Huang, C. Liang et al. // J. of Central South University (Science and Technology). – 2007. – V.38. – №3. – P. 502-506.
24. Фитохимическое исследование растений флоры Сибири / Д.Л. Макарова, В.В. Величко, Н.Е. Ким и др.// Фармация. – 2008. – №3. – С.19-22.
25. 500 важнейших лекарственных растений / В.К. Лавренов, Г.В. Лавренова. – М., 2003. – 510 с. 26. Comparative metabolism and kinetics of coumarin in mice and rats / S.L. Born, A.M. Api, R.A. Ford et al. // Food Chem. Toxicol. – 2003. – №41. – P.247-258.
Статья опубликована в журнале «Вестник урологии». Номер №3/2013 стр. 30-39
Источник