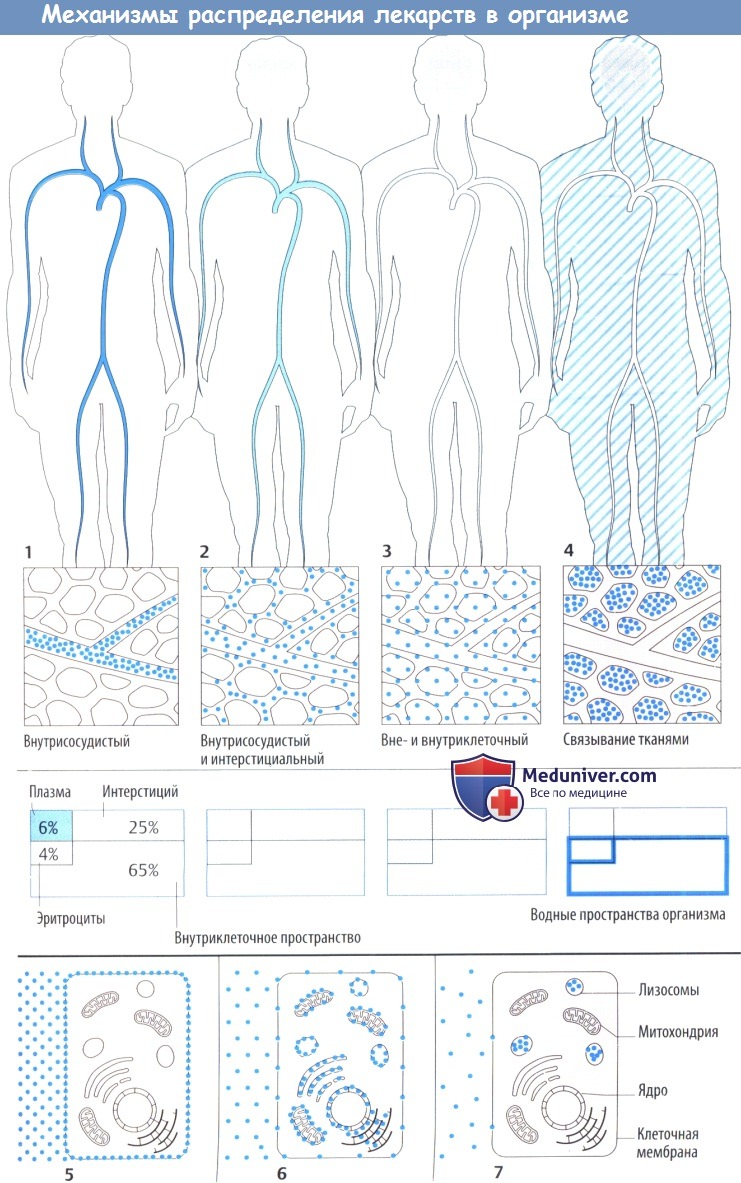
Особенности распределения лекарственных веществ
Лекарственное средство после захвата организмом распределяется в кровь и через нее в различные ткани организма. Распределение может ограничиваться внеклеточным пространством (плазма + интерстициальное пространство) или может включать и внутриклеточное пространство.
Некоторые лекарственные средства активно связываются тканевыми структурами, поэтому их концентрации в плазме значительно падают еще до начала выделения.
После распределения в кровь макромолекулы остаются в основном в сосудистом пространстве, т. к. они не могут проникнуть через гистогематический барьер или даже фенестрированный эндотел ий капилляров. Это свойство используется при потере крови, когда необходимо восполнить объем циркулирующей крови, например, путем инфузии растворов с декстраном.
Более того, в сосудистом пространстве преимущественно находятся вещества, обладающие высоким аффинитетом к белкам плазмы (определение объема плазмы с помощью связанных с белком красителей). Несвязанное (свободное) лекарственное средство покидает кровоток, но с различной скоростью, т. к. гистогематический барьер имеет неодинаковое строение в сосудах различных органов. Эти локальные отличия не показаны на приведенных рисунках.
Распределение в организме определяется свойством проникать сквозь мембранные барьеры. Гидрофильные вещества (инулин) не захватываются клетками и не связываются структурами клеточной поверхности, поэтому могут использоваться для определения внеклеточного объема жидкости. Липофильные вещества диффундируют сквозь клеточную мембрану; в результате достигается равномерное распределение в жидкостях организма.
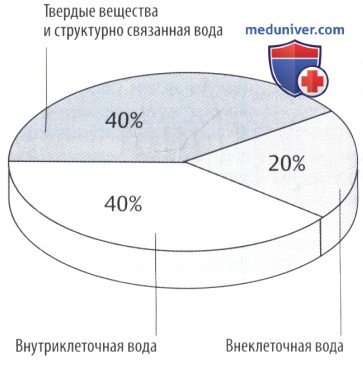
Масса тела может снизиться, как показано на секторной диаграмме. Другие подразделы указаны на рисунке ниже.
Отношение объема интерстициальной/внеклеточной жидкости варьирует в зависимости от возраста и массы тела. В процентном отношении объем интерстициальной жидкости высокий у недоношенных детей или у здоровых новорожденных (до 50% массы тела) и снижается при ожирении и старении.
Концентрация (с) раствора соответствует количеству (D) вещества, растворенного в объеме (V); из этого следует, что с = D/V. Если известна доза лекарственного препарата (D) и его концентрация в плазме (с), то можно вычислить объем распределения (V) по формуле: V=D/c. Тем не менее это кажущийся (теоретический) объем распределения (Vapp), т. к. при расчете предполагается равномерное распределение в организме.
Равномерное распределение нехарактерно при связывании лекарственных средств клеточными мембранами или мембранами внутриклеточных органелл либо при накоплении внутри органелл. В таких случаях концентрация в плазме уменьшается и Vapp может превысить фактическую величину имеющегося объема жидкости. Наоборот, если значительная часть молекул лекарственного вещества связана с белками плазмы, то с увеличивается, а вычисляемый Vapp может быть меньше, чем биологическое значение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Венгеровский / 2 Распределение лекарств
РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОРГАНИЗМЕ
После всасывания в кровь или непосредственного введения в кровоток лекарственные средства распределяются в водной фазе организма, включающей кровь, внеклеточную и внутриклеточную воду (70% массы тела). У детей в связи с большим, чем у взрослых, содержанием воды в организме, возрастает объем распределения сердечного гли-козида дигоксина. холиноблокатора атропина, антибиотиков-амино-гликозидов. Эти препараты назначают в дозе, увеличенной на 1 кг массы по сравнению с дозой у взрослых. При обезвоживании объем распределения лекарственных средств уменьшается с ростом их концентрации и усилением фармакологических эффектов.
При внутривенном вливании высокая концентрация лекарственных средств вначале создается в органах с обильным кровоснабжением — головном мозге, сердце, печени, почках, легких, эндокринных железах, получающих 2/3 минутного объема крови. Спустя 6-10 минут лекарства перераспределяются в органы с меньшим кровоснабжением — скелетные мышцы и жировую ткань. При введении внутрь. в мышцы и под кожу. всасывание и распределение происходят параллельно.
Кровь и хорошо перфузируемые органы относят к центральной камере; мышцы, кожу и жировые депо — к периферической камере. Понятие камеры условно, так как за ним не стоят анатомические образования, это фармакокинетическая модель.
Истинный объем распределения — объем жидких сред организма, в которых растворено лекарственное средство. Очевидный объем распределения является абстрактным понятием. Он включает истинный объем распределения и объем распределения части дозы, депонированной в связи с белками крови и в жировой ткани. Другими словами, — это объем жидких сред организма, в которых могла бы распределиться вся введенная доза, чтобы создать концентрацию, равную концентрации в плазме крови. Объем распределения зависит от физико-химических свойств лекарственного средства (молекулярная масса, растворимость в воде и липидах, степень диссоциации), возраста, пола больного, массы жировых депо, функционального состояния печени, почек и сердечно-сосудистой системы.
Из крови лекарственные средства поступают в органы, преодолевая гистогематические барьеры — капиллярную стенку, гематоэнце-фалический, гематоофтальмический и плацентарный барьеры.
Капилляры легко проницаемы для лекарственных средств. Липидорастворимые препараты диффундируют через эндотелий и базальную мембрану, водорастворимые — через цементирующее вещество (гиалуроновая кислота) или широкие поры, занимающие 0,2% поверхности капиллярной стенки. Транспорт по капиллярным порам возможен для соединений с молекулярной массой, не больше массы инсулина (5-6 кДа). При лучевой болезни и воспалении активируется гиалуронидаза, что увеличивает проницаемость капилляров.
Гематоэнцефалический и гематоофтальмический барьеры
Гематоэнцефалический барьер (ГЭБ) состоит из двухмембранного слоя эндотелиоцитов, базальной мембраны (волокна, перициты) и астроцитарной муфты. Капилляры образуют межэндотелиальную связь без пор и фенестров. Прочность межэндотелиальных контактов поддерживается высокомолекулярными белками — кадгеринами. Эндотелий капилляров мозга не способен к пиноцитозу.
Перициты являются аналогами гладких мышц — поддерживают тонус базальной мембраны и выполняют сократительную функцию. Аминопептидаза этих клеток расщепляет нейромедиаторы пептидной структуры. Перициты, синтезируя фактор роста, стимулируют регенерацию эндотелия.
Астроцитарная муфта образована отростками астроцитов и покрывает 85-90% поверхности ГЭБ. Пресинаптическая мембрана астроцитов контактирует с эндотелием и базальной мембраной. Астроциты обладают многофункциональностью. Они регулируют обмен нейроме-диаторов и иммунный ответ мозга, участвуют в синтезе миелина, активном транспорте ионов. В астроцитах продуцируется растворимый пептидный фактор, необходимый для формирования плотных контактов эндотелия.
Такое строение ГЭБ характерно для всех отделов головного мозга, кроме гипоталамо-гипофизарной области, где базальная мембрана имеет перикапиллярные пространства, а сам барьер обильно фенестрирован.
Ограничение диффузии в направлении кровь — мозг обусловлено особенностями морфо-функциональных систем ГЭБ. Основное значение имеют:
• высокая электрическая резистентность эндотелия, препятствующая транспорту гидрофильных соединений;
• низкая активность пиноцитоза;
• наличие ферментных систем, инактивирующих провоспалительные цитокины;
• специфичность рецепторов и ферментов барьера.
Через ГЭБ проникают несвязанные с белками молекулы размером менее 10-15 нм. Типы транспорта — простая диффузия липофильных веществ, облегченная диффузия глюкозы, аминокислот, ионов кальция, магния, йода, активная диффузия.
Осмотически активные средства (маннит), повреждая ГЭБ, усиливают отек мозга и способствуют поступлению в него эндогенных токсических веществ (билирубин).
При менингите, арахноидите, гипоксии, черепномозговых травмах, шоке проницаемость ГЭБ возрастает. У больных тяжелым менинго-кокковым менингитом концентрация антибиотика рифампицина в головном мозге составляет 26% от дозы. при менингите средней тяжести — 14.3%, при легком менингите — 5,2%.
Удаление лекарственных средств из мозга происходит при участии сосудистого сплетения желудочков по типу секреции веществ в почечных канальцах или с током спинномозговой жидкости через ворсинки паутинной оболочки.
Гематоофтальмический барьер разделяет кровь капилляров и внутриглазную жидкость в камерах глаза. В среды глаза хорошо проникают липидорастворимые препараты.
Плацентарный барьер разделяет кровообращение матери и плода. Проникновение через этот барьер зависит от физико-химических свойств лекарственных средств, их концентрации в крови, морфо-функционального состояния плаценты в разные сроки беременности, плацентарного кровотока. К плоду поступают несвязанные с белками, липидорастворимые лекарственные средства с молекулярной массой менее 1 кДа. не проникают четвертичные азотистые соединения и высокомолекулярные вещества (плазмозаменители, гепарин, пептиды). Типы транспорта через плаценту — простая диффузия, активный перенос и пиноцитоз.
Проницаемость плацентарного барьера значительно повышается с 32-35-й недели беременности. В этот срок происходит истончение плаценты (с 25 до 2 мкм), увеличивается количество ворсин, расширяются спиральные артерии, растет перфузионное давление в межворсинчатом пространстве.
Особенности кровообращения плода увеличивают опасность повреждающего действия лекарственных средств. После прохождения через плаценту лекарства попадают в пупочную вену, затем 60-80% крови направляется в печень через воротную вену, а остальные 20-40% пуповинного кровотока через шунт поступают в нижнюю полую вену и системный кровоток без детоксикации в печени.
Некоторые лекарственные средства — сердечный гликозиддигитоксин, противотуберкулезный препарат фтивазид — накапливаются в тканях плода, создавая концентрации в 1,5-2 раза большие, чем в крови матери. Другие препараты
— антибиотики, кофеин, витамин Е- обнаруживаются в крови плода в меньших (на 50-70%) количествах, чем у матери.
В связи с опасностью эмбриолетального, эмбриотоксического, тератоген-ного и фетотоксического эффектов многие лекарственные средства противопоказаны при беременности. Известно, что частота врожденных уродств в популяции равна 2-3%, при этом в 25% случаев они объясняются наследственными причинами, в 10% — отрицательным влиянием факторов внешней среды, в 65% — нежелательным действием лекарственных средств.
ДЕПОНИРОВАНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В крови лекарственные средства транспортируются в форме депо с белками. Слабые кислоты связываются с альбуминами, слабые основания-с кислыми ai-гликопротеинами и липопротеинами (табл. 2.1). Адсорбция на белках обратима и происходит при участии вандерва-альсовых, водородных, ионных, дипольных сил взаимодействия, алкилирование белков наблюдается редко. Реакция между лекарственными средствами и белками протекает в течение 20 миллисекунд.
Связанная с белками фракция, не оказывая фармакологическое действие, возмещает удаленные из циркуляции молекулы активной свободной фракции. Более чем на 90%, с белками связываются -адреноблокатор анаприлин, противоэпилептический препарат дифенин, нестероидные противовоспалительные средства, нейролептик амина-зин, трициклические антидепрессанты, сердечный гликозид дигитоксин, мочегонное средство фуросемид. Специфические транспортные белки есть у витаминов, гормонов, ионов железа.
Белки плазмы и форменные элементы крови, связывающие лекарственные средства
Источник
Распределение лекарственных средств в организме
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Распределение лекарственных средств в организме
Распределение лекарственных средств в организме определяется множеством факторов, в зависимости от которых лекарство будет распределяться в организме равномерно или неравномерно. Следует сказать, что большинство лекарственных средств распределяется неравномерно и лишь незначительная часть – относительно равномерно (ингаляционные средства для наркоза).
Распределение лекарственных средств. Факторы
Наиболее важными факторами, влияющими на характер распределения лекарственного средства, являются:
- растворимость в липидах,
- степень связывания с белками плазмы крови,
- интенсивность регионарного кровотока.
Растворимость в липидах лекарственного средства определяет способность его проникать через биологические барьеры. Это прежде всего, стенка капилляров и клеточные мембраны, являющиеся основными структурами различных гистогематических барьеров, в частности, таких как, гематоэнцефалический и плацентарный барьеры.
Неионизированные жирорастворимые лекарственные средства легко проникают через клеточные мембраны и распределяются во всех жидких средах организма. Распределение лекарственных средств, плохо проникающих через клеточные мембраны (ионизированные лекарственные вещества), осуществляется не столь равномерно. Проницаемость ГЭБ возрастает при повышении осмотического давления плазмы крови. Различные заболевания могут изменять распределение лекарств в организме. Так развитие ацидоза может способствовать проникновению в ткани лекарств – слабых кислот, которые меньше диссоциируются в таких условиях.
Иногда распределение лекарственного вещества зависит от сродства препарата к тем или иным тканям, что приводит к их накоплению в отдельных органах и тканях. В качестве примера можно назвать образование тканевого депо в случае использования препаратов, содержащих йод (J) в тканях щитовидной железы. При использовании тетрациклинов последние могут избирательно накапливаться в костной ткане, в частности, зубах. Зубы в таком случае, особенно у детей, могут приобрести желтую окраску.
Такая избирательность действия обусловлена сродством тетрациклинов к биологическим субстратам костной ткани, а именно образованием тетрациклинкальциевых комплексов по типу хелатов (hela – клешня рака). Данные факты важно помнить, особенно педиатрам и акушер-гинекологам.
Некоторые препараты могут в больших количествах накапливаться внутри клеток, образуя клеточные депо (акрихин). Происходит это за счет связывания лекарственного вещества с внутриклеточными белками, нуклепротеидами, фосфолипидами.
Некоторые средства для наркоза в силу своей липофильности могут образовывать жировые депо, что также следует учитывать.
Депонируются лекарственные средства, как правило, за счет обратимых связей, что в принципе, определяет продолжительность их нахождения в тканевых депо. Однако если образуются стойкие комплексы с белками крови (сульфадиметоксин) или тканей (соли тяжелых металлов), то нахождение этих средств в депо существенно удлиняется.
Следует также иметь ввиду, что после всасывания в системный кровоток большая часть лекарственного вещества в первые минуты попадает в те органы и ткани, которые наиболее активно перфузируются кровью (сердце, печень, почки). Медленнее происходит насыщение лекарственным средством мышц, слизистных оболочек, кожи и жировой ткани. Для достижения терапевтических концентраций лекарственных веществ в этих тканях требуется время от нескольких минут до нескольких часов.
Наиболее наглядно влияние состояния гемодинамики на распределение лекарственных средств прослеживается в условиях патологии. Дело в том, что нарушения гемодинамики могут существенно изменять кинетику распределения. Так, при геморрагическом шоке или при застойной сердечной недостаточности перфузия большинства органов уменьшается. Нарушение скорости гломерулярной фильтрации и печеночного кровотока приводят к снижению соответственно почечного и печеночного клиренса, что сразу же скажется возрастанием концентрации препарата в плазме крови. Соответственно, будут увеличены интенсивность и длительность действия препарата. В качестве примера можно указать на увеличение продолжительности действия тиопентала при шоке.
Многие лекарственные вещества обладают сильным физико-химическим сродством к различным белкам плазмы крови. Наиболее важными в этом отношении являются альбумины и в меньшей степени кислые альфа-гликопроитеиды. Такое средство лекарства приводит в конечном счете к тому, что после всасывания оно может циркулировать в крови не только в свободной форме, но и в форме, связанной с белками. Это так называемое, экстраполярное (внеклеточное) депо лекарственного вещества, его своеобразный резервуар в крови. Фракция связанного с белками плазмы препарата является временным депо и предупреждает резкие колебания концентрации несвязанного вещества в крови и жидких средах организма.
Связывание лекарственных веществ с белками плазмы ограничивает их концентрацию в тканях и в месте действия, так как только свободный (несвязанный) препарат может проходить через мембраны. Вещество же, находящееся в комплексе с белком, лишено специфической активности. Связывание с белками снижает диффузию лекарственного вещества в клетку и поэтому замедляет процесс метаболизма. Связывание с белками снижает количество лекарственного вещества, способного фильтроваться в почечных клубочках, в результате чего замедляется и процесс его выведения (экскреция).
Практически ощутимо, если лекарственное вещество связывается с белками очень активно, то есть более чем на 90%. Сила взаимодействия белков крови и лекарства выражается сродством или аффинитетом. Из этого определения (положения) вытекают важный вывод:
Если А – лекарство, а О – белок, то А + В = АО
Как видно из данного уравнения, свободная и связанная части лекарственного вещества находятся в состоянии динамического равновесия. Так как лекарство активно только лишь в свободном состоянии, то в связи с белком оно неактивно. Несколько упрощенное сравнение можно допустить, что в свободном состоянии лекарство действует на фармакологические рецепторы тканей как ключ к замку, а в связи с белком – этот ключ не работает.
Распределение лекарственных средств. Связь с белками
- От силы связывания лекарства с белком зависит скорость поступления лекарственного вещества в ткани. Поскольку активность лекарственного вещества определеяется частью, способной к диффузии, то препараты с высокой степенью аффинитета, высоким сродством к белкам, такие, как длительно действующие сульфаниламиды (аффинитет > 90%), действуют медленно и содержатся в интерстициальной (межклеточной) жидкости и в клетках тканей в невысоких концентрациях. Другим примером является сердечный гликозид (дигитоксин), связывающийся с белками на 97%. После приема этого препарата внутрь он начинает действовать лишь через 5-6-7 часов.
- От степени аффинитета лекарственные средства с белками плазмы зависит длительность их действия. Дигитоксин после 1-кратного приема оказывает фармакологический эффект в течение 2-3 дней, а остаточное его действие реализуется даже через несколько недель (14-21 день). Если при хронической сердечной недостаточности, связываеия лекарств с белками плазмы снижается, то при хронической легочной недостаточности или в послеоперационном периоде повышается (примерно на 10%). У больных со сниженной функции почек процент связывания с белками кислых лекарственных средств со свойствами кислот уменьшается.
- Степень аффинитета лекарства с белками крови влияет на различие эффектов лекарственных веществ у людей с различной патологией. Например, при развитии у больного с ожоговой болезнью глубокой гипопротеинемии фракция свободного лекарственного вещества увеличивается, что в такой ситуации требует снижения терапевтических доз препарата. Аналогичная ситуация может развиться при голодании, когда, если не будет снижена доза лекарства, на обычную его дозу разовьется токсический эффект (аналогично и при лучевой болезни).
- Одновременное применение препаратов, связывающихся с одними и теми же радикалами белковых молекул может вызвать эффект конкуренции их за связь с белками. Если в таком случае эти препараты обладают различной связывающейся способностью, то есть различным аффинитетом, может произойти внезапное повышение концентрации одного из них, иногда до опасного уровня.
Распределение лекарственных средств. Метаболизм
После всасывания и распределения препараты могут:
1) метаболизироваться под влиянием адекватных ферментов;
2) изменяться спонтанно, превращаясь в другие вещества без воздействия ферментов;
3) либо могут выводиться из организма (или экскретироваться) в неизменном виде.
Некоторые лекарственные вещества, спонтанно изменяются (эмбихин), превращаясь в другие вещества при соответствующих изменениях кислотности среды в организме. Таким образом, в живом организме лекарственные вещества подвергаются определенным изменениям или биотрансформации.
Под биотрансформацией (или превращением, или метаболизмом) понимают комплекс физико-химических и биохимических превращений лекарственных веществ, способствующих их переводу в более простые, ионизированные, более полярные и, следователно, водорастворимые компоненты (метаболиты), которые легче выводятся из организма. Другими словами, какой бы структурой ксенобиотик не обладал, встречающийся с ним адекватный фермент переводит его в состояние, удобное для выведения из организма (как правило ксенобиотик становится менее липофильным) или в состояние для использования в качестве энергетического и пластического материала (кокарбоксилаза, натрия нуклеинат).
Хотя некоторые лекарственные вещества биотрансформируясь, образуют метаболиты, более активные по сравнению с вводимыми в организм веществами, подавляющее большинство лекарств инактивируется, разлагается, трансформируется до более простых, фармакологически менее активных и менее токсичных метабонитов. Биотрансформация введенных лекарств происходит преимущественно в печени, но может в почках, стенке кишечника, легких, мышцах и других органах. Процессы биотрансформации сложны и обычно включают ряд последовательлных стадий, каждая из которых опосредуется определенным ферментом крови.
Типы реакций метаболизма лекарственных препаратов в организме:
1. Синтетические
2. Несинтетические — к этим реакциям относятся окисление, восстановление, гидролиз. Все несинтетические реакции метаболизма, называемые также метаболической трансформацией лекарственных препаратов, также можно разделить в зависимости от локализации 2-х основных биотрансформирующих систем на 2 группы:
- микросомальные реакции – основная группа реакций, по которым биотрансформируются большинство лекарственных средств, это реакции катализируемые ферментами эндоплазматического ретикулума гепатоцитов
- немикросомальные – реакции, катализируемые ферментами другой локализации.
То есть, если микросомальная биотрансформирующая система, представлена ферментами эндоплазматического ретикулуна гепатоцитов печени, то немикросомальная система – ферментами иной локализации.
Микросомальные реакции окисления или восстановления лекарственных средств, а точнее их отдельных активных групп в структуре лекарственной молекулы, происходят при участии монооксигеназных систем, основными компонентами которых являются цитохром Р-450 и никотин-амидаденин-динуклеотид фосфорированный восстановленный (НАДФ Н).
Эти цитохромы являются первичными компонентами окислительной ферментной монооксигеназной системы. В большинстве случаев фармакологическая активность таких метаболитов становится меньше активности исходного вещества.
Дальнейшее окисление лекарственных веществ происходит под влиянием других окислительных ферментов, таких как оксидазы и редуктазы, при обязательном участии НАДФ и молекулярного кислорода.
Микросомальные ферменты в основном катализируют процессы окисления многих лекарственных средств, то реакции восстановления и гидролиза этих средств, связаны не только с микросомальными, но и немикросомальнми энзимами. Хотя немикросомальные ферменты участвуют в биотрансформации небольшого числа лекарственных средств, они все же играют важную роль в их метаболизме. Немикросомальная биотрансформация препаратов происходит также в печени, но может протекать в плазме крови и другиз тканях (желудке, кишечнике, легких).
В основе синтетических реакций лежит образование парных эфиров лекарственных средств с глюкуроновой, серной, уксусной кислотами, а также с глицином и глутатионом, что помогает созданию высокополярных соединений, хорошо растворимых в воде, мало растворимых в липидах, плохо проникающих в ткани и в большинстве случаев фармакологически неактивных. Естественно, что эти метаболиты хорошо выводятся из организма. Таким образом, синтетические реакции ведут к образованию, синтезу нового метаболита и осуществляется с помощью реакций коньюгации, ацетилирования, метилирования и пр.
В качестве примера, биотрансформации лекарственных средств по синтетическим реакциям можно привести следующую иллюстрацию. В печени взрослых антибиотик левомицетин подвергается коньгации с клюкуроновой кислотой на 90% и только на 10% его экскретируется с мочой в неизменном виде. Образующиеся глюкурониды легко биотрансформируются и выводятся. Таким же путем из органинзма выводятся эстрогенные и глюкокортикоидные препараты, алкалоиды опия, салицилаты, барбитураты и другие средства.
С точки зрения эволюции более древний путь биотрансформации – это присоединение к ксенобиотику (коньюгация) высокополярных групп: глюкуроновой кислоты, сульфата, глицина, фосфата, ацетила, эпоксидной группы, делающих ксенобиотики более растворимыми в воде. Эволюционно более молодой путь – окислительно-восстановительный (реакции окисления, восстановления, гидролиза) рассматривается как начальная фаза биотрансформации.
Продукты окисления или восстановления (I фаза) обычно подвергаются затем коньюгированию (II фаза). Таким образом, можно сказать, что реакции I фазы биотрансформации лекарственных средств обычно являются несинтетическими, тогда как реакции II фазы – синтетические.
Как правило, только после II фазы биотрансформации образуются неактивные или малоактивные соединения, поэтому именно синтетические реакции можно считать исинными реакциями дезинтоксикации ксенобиотиков, в том числе и лекарств.
С практической точки зрения важным является то обстоятельство, что с помощью ряда средств можно активно влиять на процессы микросомального преобразования лекарств. Замечено, что под влиянием лекарственных средств может развиваться как индуцирование (возрастание активности), так и депрессия микросомальных ферментов. Веществ, стимулирующих биотрансформацию путем индукции синтеза ферментативных белков печени, значительно больше, чем веществ, подавляющих этот синтез. К таким веществами индукторам, которых в настоящее время описано более 200, относят фенобарбитал, барбитураты, гексобарбитал, кофеин, этанол, никотин, бутадион, нейролептики, димедрол, хинин, кордиамин, многие хлорсодержащие пестициды и инсектициды.
В активации этими веществами ферментов печени участвует микросомальная глюкуронилтрансонфаза. При этом возрастает синтез РНК и микросомальных белков. Важно помнить, что индукторами усиливается не только метаболизм лекарств в печени, но и их выведение с желчью.
Все эти вещества ускоряют процессы метаболизма печени в 2-4 раза лишь за счет индуцирования синтеза микросомальных ферментов. При этом ускоряется метаболизм не только вводимых вместе с ними или на их фоне лекарственных препаратов, но и их самих. Однако есть и большая группа веществ (ингибиторы), подавляющих и даже разрушающих цитохром Р-450, то есть основной микросомальный фермент.
К числу таких лекарственных средств относится группа местных анестетиков, антиаритмических средств (анаприлин или индерал, вискен, эралдин), а также циметицин, левомицетин, бутадион, антихолинэстеразные средства, ингибиторы МАО. Эти вещества пролонгируют эффекты препаратов, введенных вместе с ними. Кроме того, многие из ингибиторов вызывают явление аутоингибирования метаболизма (верапамил, пропранолол). Из сказанного следует, что надо при комбинации лекарств у больного учитывать такую возможность. Например, индукция микросомальных ферментов печеночных клеток фенобарбиталом лежит в основе применения этого препарата для устранения гипербилирубинемии у новорожденных с гемолитической болезнью.
Распределение лекарственных средств. Толерантность в лекарствам
Снижение эффективности лекарственных средств при их повторном применении называется толерантностью. Использование того же фенобарбатала в качестве снотворного приводит к постепенному развитию привыкания, т. е. к толерантности, что диктует необходимость повышения дозы лекарства. Особым видом привыкания является тахифилаксия.
Тахифилаксия – возникающее очень быстро привыкание, иногда уже после первого введения вещества. Так, введение эфедрина внутривенно повторно с интервалом в 10-20 минут вызывает меньший подъем АД, чем при первой иньекции. Аналогичная ситуация прослеживается при закапывании растворов эфедрина в нос.
Вещества-индукторы, активируя микросомальные ферменты, способствуют усиленному выделению из организма витамина Д, в результате чего может развиться размягчение костей и произойти патологический перелом. Все это примеры взаимодействия лекарств.
Необходимо также помнить, что фармакологические средства можно разделить на 2 группы по скорости инактивации в печени:
- первые окисляются с малой скоростью, например, дифенин, карбамазенин;
- вторые – со средней или большой скоростью, например, имизин, изадрин, лидокаин, анаприлин.
Кроме того, метаболизм лекарственных веществ зависит как от вида и рода животных, расовой принадлежности больного, так и от возраста, пола, питания (у вегетарианцев скорость биотрансформации лекарств меньше, если в пище много белков – метаболизм усилен), состояния нервной системы, пути применения, от одновременного использования других лекарственных средств.
Более того, важно помнить, что у каждого человека своя, генетически детерминированная скорость биотрансформации. По этому поводу можно сослаться на пример с алкоголем, когда имеется индивидуальная особенность работы алькогольдегидрогеназы у индивидуума. Эти особенности индивидуальной работы ферментов в зависимости от генотипа изучает фармакогенетика.
Великолепным примером генетической зависимости может служить инактивация противотуберкулезного средства изониазида (фтивазида) путем ацетилирования. Установлено, что скорость этого процесса генетически обусловлена. Имеются лица, которые медленно инактивируют изониазид. При этом его концентрации в организме снижаются более постепенно, чем у людей с быстрой инактивацией препарата. Среди европейской популяции медленных ацетиляторов, по данным некоторых авторов отмечается 50-58, 6%, а быстрых – до 30-41, 4%. При этом, если народы Кавказа и шведы в основном быстрые ацетиляторы, то эскимосы – наоборот – относятся к медленным ацетиляторам.
Зависимость индивидуальной биотрансформации и изучает наука фармакогенетика.
У медленных ацетиляторов определенная доза лекарственного средства дает более высокую концентрацию в крови, а потому у них может быть больше побочных эффектов. Действительно изониазид содает у 20% больных с туберкулезом, медленных ацетиляторов, осложнения в виде периферической нейропатии, а у быстрых ацетиляторов – только в 3% случаев.
Заболевания печени меняют биотрансформацию лекарственных веществ в данном органе. Для веществ, медленно трансформирующихся в печени, важную роль играет функция печеночных клеток, уровень активности которых снижается при гепатите, циррозе, уменьшая инактивацию этих веществ. Такие многофакторные особенности биотрансформации лекарств делают необходимым изучение данной проблемы в каждом конкретном случае.
Распределение лекарственных средств. Экскреция лекарств
Последним этапом взаимодействия лекарств с живым организмом является их выведение или экскреция.
Лекарственные препараты, за исключением препаратов для ингаляционного наркоза, как правило, экскретируются не через те структуры, в которых происходила абсорбция (всасывание). Основными путями экскреции являются почки, печень, ЖКТ, легкие, кожа, слюнные железы, потовые железы, молоко матери. Нас в клиническом плане особенно интересуют почки.
Выведение лекарств почками определяется тремя процессами, осуществляемыми в нефроне:
1) пассивной клубочковой фильтрацией;
2) пассивной диффузией через канальцы или реабсорбцией;
3) активной канальцевой секрецией.
Как видим, для лекарств характерны все физиологические процессы в нефроне.
Неионизированные лекарственные вещества, хорошо абсорбирующиеся, могут подвергаться фильтрации в почечных клубочках, но из просвета почечных канальцев они могут вновь диффундировать в клетки, выстилающие канальцы. Таким образом, только очень небольшое количество препарата появляется в моче.
Ионизированные лекарственные вещества, плохо абсорбирующиеся, экскретируются почти полностью путем клубочковой фильтрации и не реабсорбируются.
Пассивная диффузия – двунаправленный процесс, и лекарственные вещества могут диффундировать через стенку канальцев в любом направлении в зависимости от концентрации их и pH среды (например, акрихин, салицилаты).
Значение pH мочи влияет на экскрецию некоторых слабых кислот и оснований. Так, слабые кислоты быстро экиминируются при щелочной реакции мочи, например барбитураты и салицилаты, а слабые основания быстро экскретируются при кислой среде (фенамин). Поэтому при остром отравлении барбитуратами необходимо подщелачивать мочу, что достигается в/венным введением растворов гидрокарбоната натрия (соды), последнее улучшает экскрецию снотворного.
Если же значение pH мочи не соответствует оптимальнму для экскреции лекарственного средства значению, действие этих лекарственных веществ может быть пролонгировано.
При щелочной реакции мочи канальцевая реабсорбция слабых кислот минимальна, так как основная масса этих веществ находится в ионизированном состоянии в щелочной среде. Аналогичная ситуация в отношении слабых оснований при кислой реакции мочи. Выведение слабых оснований и кислот может быть ускорено, если высокий диурез поддерживается введением маннитола и диуретиков (мочегонных), а также корригируется значением pH мочи до оптимального применительно к данному препарату.
При патологии почек способность их экскретировать лекарственные вещества снижается. В результате даже при использовании нормальных доз препаратов уровень их в крови повышается и пролонгируется действие лекарств. В связи с этим при назначении препаратов типа, аминогликозидных антибиотиков (стрептомицин, гентамицин), кумариновых антикоагулянтов, больным со сниженной функцией почек (почечная недостаточность), требуется особый режим наблюдения.
В заключении данного раздела несколько слов о термине “Элиминация”. В литературе часто термины “элиминация” и “экскреция” употребляют как синонимы.
Элиминация – это более широкий термин, соответствующий сумме всех метаболических (биотрансформация) и экскреторных процессов, в результате которых активное вещество исчезает из организма.
Распределение лекарственных средств. Кумуляция
Следствием недостаточности экскреции или элиминации может быть накопление или кумуляция лекарственного средства в организме, в его тканях. Кумуляция – (аккумулятор – накопитель) есть следствие недостаточности экскреции и элиминации, и, как правило, связана с патологией органа экскреции (печени, ЖКТ и др. ) или с усилением связывания с белками плазмы, что снижает количество вещества, способного фильтроваться в клубочках.
Имеются три основных пути борьбы с кумуляцией:
- уменьшение дозы лекарственного вещества;
- перерыв в назначении лекарств (2-3-4 дня-2 недели);
- на первом этапе введение большой дозы (дозы насыщения), а потом перевод больного на низкую, поддерживающую дозу. Таким образом, используют, например, сердечные гликозиды (дигитоксин).
Источник