Взаимодействие лекарственных веществ с рецепторами.
Способность вещества связываться с рецепторами клетки называется аффинностью 1 . Аффинность обусловлена тем, что пространственная конфигурация лекарства может напоминать конфигурацию эндогенного лиганда этого рецептора. Внутренней активностью называют способность лекарственного вещества вызывать активацию рецептора. В зависимости от величины внутренней активности все лекарственные вещества можно разделить на несколько групп:
Агонисты или миметики (от греч. agonistes– соперник;mimeomai— подражать) – вещества, которые связываясь с рецепторами способны их активировать, что вызывает развитие ответа, характерного для данного типа рецепторов. Считают, что внутренняя активность у агонистов равна 1,0 (т.е. они вызывают полный ответ ткани).
Антагонисты или блокаторы (от греч. antagonisma– соперничество, противоборство) – это лекарственные вещества, которые связываются с рецепторами, но не вызывают их активации (т.е. их внутренняя активность равна нулю). Антагонисты экранируют циторецепторы и препятствуют развитию ответа при действии эндогенных агонистов.
Парциальные агонисты – это вещества, которые связываются с рецепторами и вызывают их активацию, однако, даже если они займут все рецепторы, эти вещества не способны вызвать максимальный ответ для данного типа рецепторов. Т.е. внутренняя активность таких агонистов меньше 1,0 и составляет обычно 0,3-0,6.
Действие парциального агониста будет зависеть от того, с какими рецепторами они взаимодействуют – с покоящимися или с рецепторами, которые уже активированы полными агонистами. Если парциальный агонист взаимодействует с покоящимися рецепторами, то он вызывает их активацию и ответ ткани возрастает с нуля до некоторой величины (30-60%), т.е. это типичное агонистическое воздействие. Если парциальный агонист действует на ткань, рецепторы которой уже активированы полным агонистом, то он начинает вытеснять агонист из связи с рецептором и занимать его место. Поскольку эффект парциального агониста уступает полному – ответ ткани снижается со 100% до более низкой величины (30-60%), т.е. это типичное блокирующее действие (см. схему 2).
Иногда выделяют также понятие агонистов-антагонистов. Агонисты-антагонисты – это вещества с низкой аффинностью, которые могут взаимодействовать не с одним, а с несколькими типами рецепторов, при этом они одни рецепторы активируют, а другие блокируют.
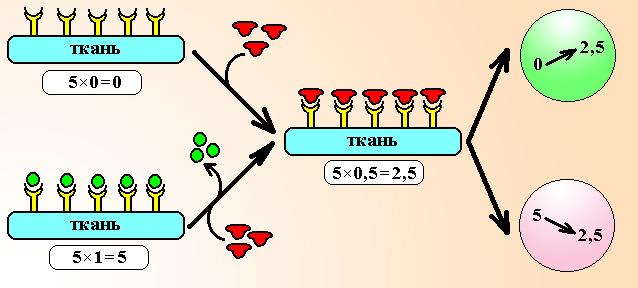
Схема 2. Действие парциальных агонистов. Предположим, что имеется тест-ткань, несущая всего 5 рецепторов. Если рецепторы свободны, ответ ткани равен нулю. После добавления парциального агониста с внутренней активностью 0,5 он будет активировать рецепторы и общий ответ ткани составит 50,5=2,5 ЕД. Если рецепторы уже заняты полным агонистом, ответ ткани максимальный (51,0=5 ЕД), при добавлении к системе парциального агониста он начинает вытеснять лиганд из связи с рецептором и будет активировать их слабее полного агониста. Общий ответ ткани при этом уменьшится и составит 50,5=2,5 ЕД, т.е. возникнет эффект блокады.
Можно показать, что чем больше изначальное число активированных рецепторов в ткани, тем будет более выражен блокирующий эффект парциального агониста.
Инверсные агонисты – это вещества, которые связываются с рецепторами и вызывают эффект обратный тому, который возникает при действии обычного агониста. Т.е. внутренняя активность реверсных агонистов меньше нуля (-1,0). Инверсные агонисты не следует путать с антагонистами. Антагонист предупреждает эффект агониста, блокируя рецептор, инверсный агонист – вызывает при взаимодействии с рецептором зеркально противоположный эффект. Примером реверсных агонистов могут служить -карболины. Диазепам является агонистом бензодиазепин-ГАМК рецепторного комплекса и вызывает при активации рецептора развитие седативного и снотворного эффектов. Флумазенил – антагонист этих рецепторов, если его ввести в организм пациента, то воспроизвести снотворное действие диазепама не удается.-карболины при взаимодействии с бензодиазепиновым рецептором будут вызывать судороги (качественно противоположный снотворному действию диазепама эффект).
Источник
Новости медицины и производства лекарственных средств
В основе механизма действия ЛС, как правило, лежит их способность инициировать (запускать) сложные биохимические и/или биофизические процессы, которые в конечном итоге изменяют и/или оптимизируют функциональную активность клетки-мишени.Лекарственные средства могут реализовывать свое действие в отношении органов и/или клеток-мишеней путем:
• прямого химического взаимодействия;
• физико-химического взаимодействия на мембране клетки;
• действия на специализированные ферменты;
• действия на регуляторные гены;
• действия на специфические рецепторы.
Прямое химическое взаимодействие ЛС.
Этот механизм действия ЛС встречается достаточно редко и может реализоваться вне клетки, например, в просвете желудка или кишечника. Суть его заключается в том, что ЛС вступает в прямую химическую реакцию с молекулами и/или ионами, образующимися в организме в норме или при патологическом состоянии. Примером прямого химического взаимодействия может служить химическая реакция нейтрализации соляной кислоты желудка при приеме антацидных ЛС.
Физико-химическое взаимодействие ЛС на мембране клетки.
Одной из основных функций цитоплазматической мембраны является осуществление ионного обмена между цитоплазмой и внеклеточной средой. Трансмембранный ионный обмен может осуществляться в том числе и через специальные потенциалзависимые трансмембранные ионные каналы — натриевые, калиевые, кальциевые, хлорные и т.д. Некоторые лекарства, достигая клеточной мембраны, взаимодействуют с этими каналами и изменяют их функциональную активность. Так, например, в основе антиаритмического действия препарата IA класса — хинидина — лежит его способность блокировать прохождение ионов Na + через трансмембранные натриевые каналы.
Действие ЛС на специализированные ферменты.
Относительно небольшое количество ЛС реализует свой фармакологический эффект путем изменения активности некоторых специализированных клеточных ферментов. Лекарственные средства, повышающие активность клеточных ферментов, называют индукторами ферментов. Таким действием обладает, например, снотворный и противосудорожный препарат фенобарбитал, который значительно усиливает активность микросомальных ферментов печени. Биологическое значение этого эффекта фенобарбитала и близких к нему ЛС будет рассмотрено далее.
Лекарственные средства, угнетающие активность специализированных ферментов, называют ингибиторами ферментов. Так, например, антидепрессант из группы ингибиторов моноаминоксидазы (МАО) препарат пирлиндол реализует свое антидепрессивное действие путем подавления активности фермента МАО в ЦНС.
Способность ингибировать активность фермента ацетилхолинэстеразы лежит в основе фармакологической активности антихолинэстеразных ЛС, например физостигмина. Известно, что в физиологических условиях ацетилхолинэстераза инактивирует (разрушает) ацетилхолин — нейромедиатор, передающий возбуждение в синапсах парасимпатической нервной системы. Физостигмин, подавляя активность ацетилхолинэстеразы, способствует накоплению в синапсах парасимпатической системы нейромедиатора ацетилхолина, в результате чего тонус парасимпатической нервной системы повышается, что на системном уровне проявляется развитием брадикардии, снижением артериального давления (АД), усилением моторики желудочно-кишечного тракта (ЖКТ), сужением зрачка и т.д.
Лекарственные средства могут взаимодействовать с ферментами обратимо и необратимо. Так, например, препарат эналаприл обратимо ингибирует активность ангиотензинпревращающего фермента, что влечет за собой, в частности, понижение АД, тогда как фосфорорганические отравляющие вещества необратимо подавляют активность ацетилхолинэстеразы.
Действие ЛС на регуляторные гены. В настоящее время ученые предпринимают попытки создания ЛС, реализующих свои фармакологические эффекты путем прямого воздействия на физиологическую активность регуляторных генов. Особенно перспективным это направление представляется после того, как в 2000 г. была расшифрована структура генома человека. Полагают, что избирательная нормализация функции регуляторных генов под воздействием ЛС позволит добиться успеха в лечении многих, в том числе ранее неизлечимых, болезней.
Действие ЛС на рецепторы. Прежде чем перейти к особенностям взаимодействия ЛС с рецепторами, необходимо уточнить, что мы понимаем под термином «рецептор» (от лат. recipio — брать, принимать).
Из курса физиологии известно, что под термином «рецептор» понимают высокоспециализированные образования, способные воспринимать, трансформировать и передавать энергию внешнего сигнала в нервную систему. Такие рецепторы называют сенсорными (от лат. sensus — чувство, ощущение, восприятие).
К сенсорным рецепторам относятся рецепторы органов слуха, зрения, обоняния, вкуса, осязания и т.д. Сенсорные рецепторы этих органов относятся к так называемым экстерорецепторам.
Если наличие органов чувств, реагирующих на внешние стимулы раздражения, было известно с давних времен, то наличие сенсорных рецепторов и внутри организма подвергалось сомнению вплоть до середины XIX в. Впервые о наличии такого рода рецепторов и внутри организма высказал предположение русский физиолог И.Ф. Цион, показавший в 1866 г. падение АД вследствие раздражения аорты в опыте на кролике. Это открытие дало начало для поиска и изучения рецепторов, расположенных внутри организма, а сами эти рецепторы получили название интерорецепторов.
К началу XX в. было выявлено достаточное количество сенсорных интерорецепторов и доказана их важная роль в регуляции физиологических функций организма.
В 1905 г. Дж. Лэнгли (J. Langley) доказал, что при нанесении ЛС на клеточную мембрану фармакологический эффект развивается в том случае, если оно нанесено только на определенный ее участок. Причем этот участок составляет лишь небольшую часть общей площади клеточной поверхности. Это наблюдение позволило Дж. Лэнгли сделать заключение о том, что на клеточной мембране существуют специализированные рецепторные участки, взаимодействующие с ЛС.
Однако приоритет в создании рецепторной теории действия ЛС принадлежит немецкому физиологу П.Эрлиху (P. Ehrlich), который в 1906 г. впервые ввел термин «рецептор» и сформулировал постулат «лекарственное вещество не действует, если не фиксируется на мембране клетки». Согласно теории П.Эрлиха, молекула ЛС имеет две функционально активные группы, одна из которых обеспечивает его фиксацию на поверхности клетки в области лекарственного рецептора, а вторая функциональная группа взаимодействует с рецептором и запускает сложную цепь биохимических реакций, обеспечивающих изменение ее (клетки) физиологической активности.
Таким образом, еще в начале XX в. стало очевидно, что существует, как минимум, два класса интерорецепторов: сенсорные рецепторы, осуществляющие передачу информации о состоянии внутренних органов и тканей организма в ЦНС; клеточные рецепторы, которые взаимодействуют с ЛС, изменяющими функциональную активность клеток-мишеней.
Сразу же следует оговориться, что в дальнейшем в тексте во избежание путаницы в терминологии рецепторы для ЛС и биологически активных веществ, т. е. клеточные, или циторецепторы, будут обозначаться термином «рецептор», тогда как сенсорные интерорецепторы будут обозначаться термином, характеризующим их функциональную активность, например, «барорецепторы», «болевые рецепторы» и т.д.
Открытие П.Эрлихом на клеточной мембране рецепторов для ЛС послужило отправной точкой для развития фармакологической науки, в частности фармакодинамики, одной из основных задач которой является изучение рецепторных механизмов действия ЛС.
В настоящее время выявлена структура большого числа клеточных рецепторов, особенности взаимодействия с ними тех или иных биологически активных соединений, что позволило, с одной стороны, понять механизм действия известных ЛС, а с другой стороны, явилось основой для создания новых высокоэффективных ЛС.
Естественно, трудно себе представить, что в организме человека в процессе эволюции образовались рецепторы к различным синтетическим (полученным химическим путем) ЛС, тем более, что подавляющее большинство представленных на современном фармацевтическом рынке ЛС были синтезированы в последние 50 лет и менее. Доказано, что рецепторный аппарат клетки — очень древнее функционально-структурное образование. Так, a- и b-адренорецепторы (рецепторы, взаимодействие с которыми норадреналина и адреналина влияет на функциональную активность клетки) обнаружены не только в клетках животных, но и на клеточных мембранах клеток растений, например в клетках растения ниттела, где a- и b-адренорецепторы регулируют движение протоплазмы (содержимого клетки).
Тогда что же представляют собой рецепторы для ЛС, открытые П.Эрлихом, и почему с ними они взаимодействуют?
В настоящее время не вызывает сомнений, что так называемые лекарственные рецепторы на самом деле являются рецепторами для эндогенных (вырабатываемых в организме) биологически активных веществ, участвующих в регуляции функциональной активности внутренних органов и тканей организма. К таким биологически активным соединениям относятся вещества, выделяющиеся из нервных окончаний в момент передачи нервного сигнала, а также гормоны, витамины, аминокислоты и т.д. Для каждого эндогенного биологически активного вещества существуют строго специфичные для него рецепторы. Так, например, вырабатываемое в организме биологически активное вещество адреналин может активировать строго специфичные для него a- и b-адренорецепторы, а глюкокортикостероиды — гормоны коры надпочечников — взаимодействуют только со строго специфичными для них глюкокортикостероидными рецепторами.
Синтетические ЛС, реализующие свои эффекты путем взаимодействия с рецепторным аппаратом клетки, по своей химической структуре в той или иной мере подобны эндогенным биологически активным соединениям, взаимодействующим с аналогичными рецепторами. Так, например, синтетическое вазоконстрикторное (вызывающее сужение сосудов) ЛС фенилэфрин по своей химической структуре близок к эндогенному биологически активному веществу норадреналину, поэтому так же как и норадреналин, обладает способностью стимулировать a-адренорецепторы.
Иногда в связи с особенностями своего химического строения ЛС могут взаимодействовать не с самим рецептором, а с прилежащим к нему участком клеточной мембраны. Так как в данном случае ЛС взаимодействует не с самим рецептором, а с прилегающим к нему участком клеточной мембраны, говорят не о возбуждающем или блокирующем влиянии на рецептор, а об аллостерическом (от греч. allos — другой, иной) воздействии, или эффекте. В результате может происходить изменение как структуры прилежащей к рецептору мембраны, так и отдельных компонентов самого рецептора, что может повлечь за собой изменение чувствительности рецептора к специфичному для него биологически активному веществу. В тех случаях, когда чувствительность рецептора к биологически активному веществу повышается, говорят о сенситизации (от лат. sensus — чувство) или о сенсибилизации (от лат. sensibilis — чувствительность) рецептора, а в тех случаях, когда чувствительность рецептора понижается, говорят о десенситизации рецептора.
Особенность аллостерического воздействия заключается в том, что ЛС, обладающее такого рода механизмом действия, непосредственно на передачу нервного импульса не влияет, но видоизменяет ее в желаемом направлении. Например, в основе механизма действия анксиолитиков (противотревожных ЛС; синонимы: транквилизаторы), по своей химической структуре являющихся производными бензодиазепина, лежит феномен аллостерического возбуждения постсинаптических бензодиазепиновых рецепторов. Возбуждение последних в свою очередь, способствует активации тормозных постсинаптических рецепторов гамма-аминомасляной кислоты (ГАМК-рецепторов), что клинически проявляется устранением таких симптомов невротических заболеваний, как чувство беспокойства, тревоги, страха и т.д.
Рецепторы, взаимодействуя с которыми, биологически активное вещество или ЛС каким-либо образом изменяет функциональное состояние клетки-мишени, называют специфическими.
Помимо специфических рецепторов, выделяют так называемые неспецифические для ЛС рецепторы. В специальной медицинской литературе эти рецепторы также называют «местом потери» ЛС. Связываясь с такими рецепторами, лекарства не оказывают какого-либо биологического эффекта, а сами становятся биологически неактивными. Примером такого вида рецепторов могут служить рецепторы, расположенные на белках плазмы крови, в частности, на водорастворимых белках — альбуминах.
Структура рецепторов достаточно сложна, но большинство из них представляют собой белковые макромолекулы или гликопротеины, в состав которых могут также входить ионы, липиды, нуклеиновые кислоты и т.д. Рецептор, т.е. образующая его белковая макромолекула, характеризуется определенным, специфическим для каждого рецептора пространственным расположением входящих в него химических групп. Белковая макромолекула, образующая рецептор, может быть интегрирована (погружена) в липидный бислой цитоплазматической мембраны или локализоваться внутри клетки. Основной функцией клеточного рецептора является «распознавание» химического сигнала, передающегося ему посредством эндогенного биологически активного вещества и/или ЛС и трансформация его в соответствующий биохимический и/или биофизический ответ клетки.
Ранее полагали, что ЛС или эндогенные биологически активные вещества взаимодействуют с рецепторами по типу «ключ и замок», т.е. рецептор имеет такую структуру, которая позволяет ЛС находить «свой» рецептор, соединяться с ним и как бы «включать» и «выключать» его. Однако с развитием медицинской науки стало очевидно, что это не совсем так. В настоящее время уже достаточно хорошо изучены особенности молекулярных процессов превращения внеклеточных сигналов во внутриклеточные, регулирующие функцию клетки, т.е. механизмы, в результате которых реализуется эффект взаимодействия эндогенных биологически активных веществ или ЛС с рецепторами.
При взаимодействии с рецептором эндогенного биологически активного вещества и/или подобно ему действующего ЛС происходит конформация — пространственное изменение формы — белковой макромолекулы, что является пусковым механизмом для различных внутриклеточных процессов, определяющих реакцию клетки-мишени на медиатор и/или ЛС. Например, активацияb2-адренорецепторов гладких мышц бронхов под влиянием b2-адре-ностимулятора фенотерол влечет за собой повышение активности фермента аденилатциклазы, который способствует накоплению в клетке циклического аденозинмонофосфата (цАМФ) и, как следствие этого, расслаблению клетки.
В общем биологическом плане клеточные рецепторы можно рассматривать как строго специализированные «органы чувств» клеток, посредством которых они воспринимают «информацию», исходящую, например, из ЦНС и/или эндокринной системы. Несмотря на столь важную роль рецепторного аппарата, рецепторы занимают лишь незначительную часть мембраны клеток. Например, М-холинорецепторный аппарат клетки занимает не более 1/6 000 площади ее поверхности.
Изучение особенностей взаимодействия ЛС с рецептором, с одной стороны, позволяет понять основу молекулярного механизма его действия, а с другой стороны, позволяет получить информацию о том, какие изменения следует провести в структуре ЛС, чтобы усилить его способность взаимодействовать с данным рецептором, т. е. позволяет вести целенаправленный синтез новых высокоэффективных ЛС.
В физиологических условиях разные клеточные рецепторы функционируют не самостоятельно, а находятся в постоянном взаимодействии друг с другом, регулируя тем самым специфическую активность клетки. Так, например, активация b-адренорецепторов сердечной клетки эндогенным норадреналином вызывает, в частности, учащение числа сердечных сокращений, а активация М-холинорецепторов сердечных клеток эндогенным ацетилхолином, напротив, вызывает урежение числа сердечных сокращений.
Большой вклад в понимание рецепторных механизмов действия ЛС внесло открытие пре- и постсинаптических рецепторов. Синапс (от греч. synopsis — соединение, связь) представляет собой специализированную зону контакта между нервными клетками или другими возбудимыми структурами организма, обеспечивающую передачу приходящей информации и сохранение ее информационной значимости. Изучение структуры и функциональной роли синапсов было начато в конце XIX в. после того, как испанский гистолог С. Рамон-и-Кахаль (S.Ramon у Cajal) высказал предположение о наличии в ЦНС специализированной передающей системы. Свое название синапсы получили в 1897 г., когда английский физиолог Ч.Шеррингтон (Ch. Sherrington) предложил этот термин для обозначения зоны контакта между нервными клетками.
В настоящее время выделяют три вида синапсов:
1) «электрические» синапсы, в которых передача информации осуществляется путем перехода электрического сигнала с пре- на постсинаптическую мембрану. Такой вид синапсов носит название эфапс (от греч. ephapsis — плотный контакт);
2) «химические» синапсы, в которых передача информации осуществляется посредством специальных биологически активных веществ — нейромедиаторов (от греч. neuron — нерв и лат. mediator — посредник; синонимы: медиатор);
3) «смешанные» синапсы, в которых передача информации осуществляется и химическим, и электрическим путем.
Фармакологические эффекты подавляющего большинства ЛС, влияющих на функции синапсов, реализуются путем их воздействия на тот или иной этап передачи сигнала в химических синапсах, т.е. в синапсах второго вида.
Как правило, химические синапсы классифицируют по нейромедиаторам, осуществляющим в них передачу нервного импульса, следующим образом:
• синапсы, в которых в качестве медиатора выступает ацетилхолин, называют холинергическими;
• синапсы, в которых в качестве медиатора выступают адреналин и норадреналин, называют адренергическими;
• синапсы, в которых в качестве медиатора выступают АТФ и аденозин, называют пуринергическими;
• синапсы, в которых в качестве медиатора выступает гамма-аминомасляная кислота, называются ГАМК-ергические и т.д.
Структура синапса в настоящее время достаточно хорошо изучена. Синапс состоит из пресинаптического отростка нервной клетки (окончания аксона) и воспринимающего «сигнал» аппарата, расположенного на мембране эффекторной («исполнительной») клетки.
Источник