Основные биологически активные вещества лекарственных растений
Одним из перспективных источников фитопрепаратов считаются лекарственные растения, содержащие флавоноиды, которые в силу широкого распространения в растениях и большого структурного разнообразия в настоящее время находятся в центре внимания исследователей в области фармакогнозии, фармации и медицины [1–3, 8–11]. Флавоноиды – наиболее многочисленный класс природных фенольных соединений, для которых характерно структурное многообразие, высокая и разносторонняя активность и малая токсичность. Широкая амплитуда биологической активности флавоноидов связана с многообразием их химических структур и вытекающих из них различных физико-химических свойств. Этот интерес связан с тем обстоятельством, что флавоноиды, будучи эволюционно адекватными организму человека, обусловливают антиоксидантные, ангиопротекторные, гепатопротекторные, желчегонные, диуретические, нейротропные и другие важнейшие фармакологические свойства [1, 5–13]. Причем именно вышеперечисленные фармакологические эффекты в наибольшей степени привлекают ученых в области создания новых растительных лекарственных препаратов.
При этом важно отметить, что только за последние 10–15 лет число фармакопейных растений, содержащих флавоноиды, увеличилось с 11 до 30 видов [4, 6, 8]. Вместе с тем созданию лекарственных препаратов на основе флавоноидных растений препятствует недостаточная степень изученности их химического состава, зависимостей в ряду «химическая структура – спектральные характеристики» и «компонентный состав – фармакологические свойства». Это приводит к отсутствию системного подхода в трактовке совокупной значимости действующих веществ в плане проявления фармакологических эффектов, а также научно обоснованных технологий получения и анализа лекарственных средств. Кроме того, в настоящее время остро стоит проблема объективной стандартизации сырья лекарственных растений и фитопрепаратов, содержащих флавоноиды, поскольку во многих случаях в методиках анализа отсутствует доказательная база или же не используются современные инструментальные возможности. В этом контексте весьма актуальной проблемой является совершенствование имеющейся нормативной документации, а также разработка новых стандартов качества на ЛРС, лекарственные субстанции и препараты, особенно в связи с подготовкой к изданию Государственной Фармакопеи Российской Федерации XII издания.
Цель настоящих исследований – разработка методологических подходов к созданию и стандартизации лекарственного растительного сырья и фитопрепаратов, содержащих флавоноиды.
Материалы и методы исследования
В качестве объектов исследования служили фармакопейные растения, лекарственное растительное сырье, флавоноиды, выделенные из ЛРС. При этом исследовали цветки бессмертника песчаного [Helichrysum arenarium (L.) Moench.], цветки пижмы обыкновенной (Tanacetum vulgare L.), траву эрвы шерстистой (Aerva lanata L.), цветки василька синего (Centaurea cyanus L.), траву полыни эстрагон (Artemisia dracunculus L.), траву горца почечуйного (Polygonum persicaria L.), траву перца водяного (Polygonum hydropiper L.), листья гинкго двулопастного (Ginkgo biloba L.), траву репешка аптечного (Agrimonia eupatoria L.), плоды и цветки боярышника кроваво-красного (Crataegus sanguinea Pall.), цветки липы сердцевидной (Tilia cordata Mill.).
В работе использованы тонкослойная хроматография, колоночная хроматография, высокоэффективная жидкостная хроматография, спектрофотомерия, 1Н-ЯМР-спектроскопия, масс-спектрометрия, различные химические превращения. 1Н-ЯМР- спектры получали на приборах «Bruker AM 300» (300 МГц), масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena). Воздушно-сухое растительное сырье подвергали исчерпывающему экстрагированию 70 % спиртом этиловым, полученные водно-спиртовые экстракты упаривали под вакуумом до густого остатка и далее подвергали хроматографическому разделению на силикагеле L 40/100. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ-этанол (9:1), хлороформ-этанол-вода (26:16:3), а также н-бутанол-ледяная уксусная кислота-вода (4:1:2).
Результаты исследования и их обсуждение
С целью систематизации фармакопейных растений, содержащих флавоноиды, нами разработана классификация (таблица), позволяющая учитывать всю совокупность биологически активных соединений (БАС) с точки зрения биологической активности, стандартизации и технологии получения лекарственных препаратов.
Классификация фармакопейных растений, содержащих флавоноиды
Наименование группы фармакопейных растений
Наименование лекарственного растения
Фармакопейные растения, содержащие флавоноиды в качестве ведущей группы БАС
Бархат амурский, бессмертник песчаный, бессмертник итальянский, боярышник кроваво-красный, бузина черная, василек синий, володушка многожильчатая, володушка круглолистная, гибискус сабдариффа, гинкго двулопастный, горец перечный, горец почечуйный, горец птичий, гречиха посевная, датиска коноплевая, десмодиум канадский, зверобой продырявленный, зверобой пятнистый, земляника лесная, золотарник канадский, лабазник вязолистный, лапчатка серебристая, леспедеца двухцветная, леспедеца копеечниковая, лимон, расторопша пятнистая, овес посевной, очиток большой, репешок аптечный, солянка холмовая, софора японская, стальник полевой, фасоль обыкновенная, фиалка трехцветная, хвощ полевой шлемник байкальский, эрва шерстистая
Фармакопейные эфиромасличные растения, содержащие флавоноиды
Арника горная, береза повислая, береза бородавчатая, липа сердцевидная, мята перечная, пижма обыкновенная, полынь эстрагон, ромашка аптечная, ромашка душистая, тополь черный, тысячелистник обыкновенный
Фармакопейные растения, содержащие горечи и флавоноиды
Одуванчик лекарственный, пустырник пятилопастный, трилистник водяной
Фармакопейные растения, содержащие сапонины и флавоноиды
Астрагал шерстистоцветковый, каштан конский обыкновенный, солодка голая, солодка уральская
Фармакопейные растения, содержащие витамины и флавоноиды
Арония черноплодная, календула лекарственная, смородина черная, сушеница топяная, череда трехраздельная, шиповник коричный, шиповник собачий
Фармакопейные растения, содержащие простые фенолы и флавоноиды
Фармакопейные растения, содержащие дубильные вещества и флавоноиды
Сабельник болотный, скумпия кожевенная, черемуха обыкновенная, черника обыкновенная
Фармакопейные алкалоидоносные растения, содержащие флавоноиды
Пассифлора инкарнатная, чай китайский, чистотел большой
В соответствии с данной классификацией в первой группе находятся лекарственные растения, содержащие флавоноиды в качестве ведущей группы БАС. В группах 2-8 флавоноиды выступают второй группы БАС, причем в данном случае акцент сделан не только на вкладе флавоноидов в фармакологический эффект, но и на их использовании в качестве критерия подлинности, качества сырья, а также как источника получения лекарственных средств.
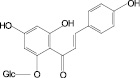
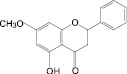
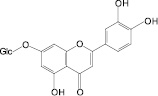
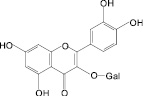
На основе результатов сравнительного изучения химического состава сырья и лекарственных препаратов фармакопейных растений научно обоснованы методологические подходы к стандартизации ЛРС, содержащего флаваноны, халконы, флавоны, флавонолы, антоцианы, наиболее широко распространенные в растениях. Эти подходы заключаются в комплексном и обоснованном использовании методов ТСХ, ВЭЖХ, спектрофотометрии и использовании соответствующих ГСО (изосалипурпозид, пиностробин, цинарозид, гиперозид, рутин, цианидин-3-О-глюкозид).
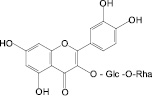
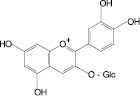
Обосновано использование в методиках качественного и количественного анализа сырья и препаратов, содержащих преимущественно флаваноны (перца водяного трава), халконы (бессмертника песчаного цветки), флавоны (пижмы обыкновенной цветки, полыни эстрагон трава), флавонолы (горца почечуйного трава, боярышника кроваво-красного цветки и плоды, липы цветки, эрвы шерстистой трава, репешка аптечного трава), антоцианы (василька синего цветки), соответствующих ГСО изосалипурпозида (халкон), пиностробина (флаванон), цинарозида (флавон), гиперозида и рутина (флавонолы), цианидин-3-О-глюкозида (антоцианы).
На основе результатов фармакогностических, химических, технологических и фармакологических исследований сырья флавоноидосодержащих фармакопейных растений обоснована целесообразность создания антиоксидантных, гепатопротекторных, диуретических, ноотропных, анксиолитических фитопрепаратов, в том числе импортозамещающих лекарственных средств.
Особого внимания заслуживают нейротропные свойства флавоноидов, которые стали привлекать исследователей сравнительно недавно. Среди фармакопейных растений, содержащих флавоноиды, в качестве источника нейротропных лекарственных препаратов применяются два вида – зверобой продырявленный и гинкго двулопастный [4–6, 8]. При изучении флавоноидов листьев гинкго двулопастного выявлено, что вклад в ноотропную активность вносит гинкгетин, являющийся одним из характерных и диагностических компонентов сырья данного растения [8]. Впервые обнаружена анксиолитическая активность для лекарственного препарата «Гинкго двулопастного настойка», при этом показана значимость всего флавоноидного комплекса листьев гинкго двулопастного для проявления наиболее полного спектра нейротропной активности.
Уточнен характер антиоксидантного действия для индивидуальных соединений, относящихся к разным классификационным группам флавоноидов, на ферментативные и неферментативные звенья антиоксидантной защиты, что позволило сформулировать рекомендации по созданию комбинированных гепатопротекторных лекарственных препаратов, в случае которых антиоксидантная составляющая актуальной в плане проявления терапевтического эффекта. При этом необходимо отметить, что именно благодаря изучению воздействия флавоноидов, а именно флаволигнанов плодов расторопши пятнистой [3, 7] на функцию печени, особенно гепатоцитов, появилось понятие «гепатопротекторные свойства» и, как следствие, фармакологическая группа – гепатопротекторы, причем произошло это сравнительно недавно – в 90-е годы XX столетия [3, 4, 6].
В ходе исследований выявлены также особенности влияния на выделительную функцию почек водных и водно-спиртовых извлечений. Проведено сравнительное исследование диуретической активности водно-спиртовых извлечений из листьев толокнянки обыкновенной (препараты сравнения), травы эрвы шерстистой, цветков пижмы обыкновенной, травы репешка аптечного аптечного и цветков бессмертника песчаного. Установлено, что настой и препарат «Эрвы шерстистой настойка» обладают быстрым развитием диуретического эффекта и короткой продолжительностью действия. Для препаратов «Пижмы настойка» и «Бессмертника песчаного настойка», а также соответствующих настоев характерно быстрое развитие эффекта и длительное диуретическое действие, тогда как в случае препарата «Толокнянки настойка» наблюдается длительный латентный период в сочетании с продолжительным диуретическим действием.
Результаты проведенных исследований позволили создать методологическую базу для совершенствования стандартизации ЛРС, содержащего флавоноиды, а также расширить возможности целенаправленного поиска новых сырьевых источников для получения эффективных отечественных фитопрепаратов и лекарственных субстанций с антиоксидантной, диуретической, ноотропной и анксиолитической активностью. Внедрение результатов данных исследований будет способствовать успешной реализации Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года, одним из главных приоритетов которой является разработка новых конкурентоспособных импортозамещающих лекарственных препаратов, в том числе растительного происхождения.
Рецензенты:
Первушкин С.В., д.фарм.н., профессор, заведующий кафедрой фармацевтической технологии, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ, профессора А.А. Лебедева, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Источник
Основные биологически активные вещества лекарственных растений
На современном этапе развития фармации, несмотря на очевидные успехи химического синтеза новых соединений, обладающих фармакологической активностью и являющихся основой производства новых лекарственных средств, не утрачивают своей актуальности фитопрепараты. Для производства всего ассортимента фитопрепаратов используется разнообразное лекарственное растительное сырье (ЛРС). Вполне естественно, что фармакологическая активность лекарственных средств растительного происхождения определяется комплексом биологически активных соединений (БАС), которые извлекаются из ЛРС в процессе получения субстанций или изготовления фитопрепаратов. Комплекс БАС в составе любого растения представлен разнообразными химическими соединениями, синтезируемыми в биохимических реакциях первичного и вторичного метаболизма.
В большинстве учебных материалов и в значительном количестве научных работ в классификации БАС растительного происхождения нет последовательности и единообразного подхода, зачастую преобладают архаизмы и устойчивые сленговые понятия.
Так, термин «сердечные гликозиды», широко используемый в учебной литературе стран СНГ [4, 5, 7, 9, 11], не имеет ничего общего с классификацией гликозидов по типу связи генина с агликоном. Соединения, которые относят к этому классу представляют собой типичные О-гликозиды, широко распространенные в растениях, а их агликоны имеют совершенно разную химическую структуру и тем более биогенетическое происхождение. Гликозидирование в известном смысле является способом транспортирования агликонов [19] по органам растений и в этой связи можно говорить только о форме существования агликона. Название «сердечные» или «кардиотонические» отражает фармакологическую активность подобных соединений, но и сумма флавоноидных гликозидов боярышника также обладает подобной активностью. При этом агликоны карденолидов имеют стероидный скелет, в то время как флавоноиды такого скелета не имеют.
В существующей классификации сапонинов выделяют тритерпеновые сапонины и стероидные сапонины [7, 9] или даже «тритерпеновые сапонины стероидного происхождения» [4]. Вместе с тем любые сапонины имеют своим биогенетическим предшественником тритерпеновое соединение сквален [12] и в этом случае все сапонины могут быть только тритерпеновой природы и различаются только структурой.
В.А. Куркин [3, 4] сделал попытку построить классификацию фенольных соединения, выделив в качестве «новой» группы соединений широко известный с середины 20-го века класс соединений [2, 14] – фенилпропаноидов, имеющих скелет С6–С3. В предложенной классификации [4] выглядит искусственным выделение таких групп, как «фенилпропаноиды фенилэтанового происхождения» и фенилпропанов – соединениий вида С6–С3, имеющие бескислородную боковую цепь С3 (эвгенол, анетол). Все фенольные соединения, за исключением нескольких соединений хиноидной структуры, синтезируются по схеме: шикимовая кислота → фенилаланин → фенилпропаноид и этот путь биосинтеза именуется фенилпропаноидным («phenylpropanoid pathway» [14, 16]). Фенилпропан по определению не может быть производным фенилпропаноида – только в обратном порядке. В то же время и эвгенол и анетол по своей химической структуре имеют ненасыщенную связь С=С и являются, таким образом, фенилпропенами, которые уже могут быть производными фенилпропаноидов. В случае же с «фенилпропаноидами фенилэтанового происхождения» перед нами просто олигосахариды, имеющие два разных агликона – фенилпропаноид и фенилэтаноид.
Автор [4] также вводит термины флаволигнаны и, по аналогии с ним, ксанто- и кумаринолигнаны. Термин флавонолигнан («flavonolignane») был предложен Р. Хенселем и А. Пельтером еще в 1968 году, хотя позднее они же признали неудачность данного термина, т.к. подобные соединения ничего общего с лигнанами не имеют [15]. Действительно лигнаны – это димеры монолигнолов [10], соединенных по принципу «хвост к хвосту», а неолигнаны по принципу «голова к хвосту» [18]. Номенклатура ИЮПАК [17] также не предусматривает введенных в [4] групп флаво-, ксанто-, и кумаринолигнанов, а класс неолигнанов – в понимании [4] не соответствует неолигнанам в общепринятой номенклатуре современной органической химии [17].
Выделение класса хинонов по принципу общности биосинтеза, сделанное в [4], также не обосновано т.к. синтез хинонов происходит по крайней мере тремя различными путями [10, 18]. Они могут быть объединены в отдельную группу только по принципу наличия в их структуре хиноидного ядра. В этом случае становится очевидным, что «антраценпроизводные соединения» [4, 7, 9, 11, 13] по сути не являются производными антрацена в том числе и потому, что в растениях сам антрацен не синтезируется. Один тип соединений, имеющий углеродный скелет антрацена, для обозначения которых может использоваться термин «антраценоид», образуются по поликетидному пути биосинтеза – 1,8-антрахинон (подгруппа хризацина) или в результате взаимодействия шикимовой и мевалоновой кислот – второй тип антраценоидов – 1,2-антрахинон (подгруппа ализарина).
На настоящий момент только классификация алкалоидов, созданная в середине прошлого века А.П. Ореховым, не потеряла своей актуальности и продолжает действовать после небольших уточнений в терминологии – в частности термин «алкалоиды с атомом азота в боковой цепи» [7, 11, 16] или используемый в [4] термин «экзоциклические алкалоиды» более терминологически правильно называть «изоциклическими» [1].
Отмеченные выше недостатки в используемых системах классификации природных БАС необоснованно затрудняют понимание и усвоение студентами курса фармакогнозии, т.к. разрывают логические связи с базовыми фундаментальными науками.
Деление метаболизма растений на «первичный» и «вторичный» в рассматриваемом контексте явно устарело т.к. не позволяет объяснить отнесение группы азотных соединений (аминокислот, а также витаминов, хлорофилла) – синтез которых может происходить в процессах вторичного метаболизма к БАС первичного метаболизма.
Решая подобную проблему, Дж. Харборн и П. Дей предложили [18] в первичном метаболизме рассматривать различные пути биосинтеза первичных метаболитов, таких как углеводы, липиды, аминокислоты, нуклеиновые кислоты, белки. В то же время для описания синтеза вторичных метаболитов авторы ввели понятие «специального метаболизма», в котором синтезируются фенолы, изопреноиды и вторичные азотсодержащие соединения (алкалоиды). Более целесообразно с позиций фармакогнозии и оправдано использование выделение в процессе биосинтеза БАС следующих типов метаболизма:
1. Углеводно-липидный метаболизм – здесь синтезируются (из БАС, рассматриваемых в курсе фармакогнозии) моно-, олиго и полисахариды, высшие жирные кислоты, липиды, а также, в цикле Кребса, карбоновые кислоты.
2. Азотный метаболизм – ассимиляция нитратов начинается в реакции с α-кетоглутаровой кислотой и первичным продуктом ассимиляции является глутамат [6, 18]. В дальнейшем перенос аминогруппы происходит в процессе переаминирования, а углеродные скелеты всего многообразия аминокислот формируются на различных стадиях циклов Кальвина и Кребса, а других азотсодержащих соединений – в процессе биосинтеза изопреноидных и фенольных соединений. Таким образом, в процессе азотного метаболизма синтезируются как первичные метаболиты – протеиногенные аминокислоты, так и вторичные метаболиты, которые включают наряду с алкалоидами, цианогенные гликозиды и непротеиногенные аминокислоты.
Источник