- Оригинальный лекарственный препарат дженерик
- Оригинал или дженерик: в чем разница?
- Оригинальный препарат и дженерик – в чем отличия?
- Алена Герасимова (Dalles) Разработчик сайта, редактор
- Оригинальные лекарства – дорогая инновация
- Клинические испытания – ворота к инновациям
- Патент на здоровье…
- Что такое дженерики
- Можно ли заменять оригинальные лекарства дженериками?
- Дженерик вместо оригинального препарата по рецепту
- Дженерики и оригинальные ЛС
Оригинальный лекарственный препарат дженерик
Оригинал или дженерик: в чем разница?
Часто в аптеках мы оказываемся перед непростым в своей неочевидности выбором — какое лекарство купить? У нас в руках рецепт от врача, в котором прописано международное непатентованное наименование препарата — то есть действующее вещество, а фармацевт предлагает на выбор несколько цветастых упаковок. При этом, кроме названия, они существенно отличаются ценой: один продают в несколько раз дороже, чем другой. Как так происходит?
Лекарства, которые мы встречаем в аптеке, легко разделить на две группы, — оригинальные лекарственные препараты и дженерики.
Первые — это впервые полученное (выделенное или синтезированное) вещество, которое прошло все доклинические испытания, клинические исследования и защищено патентом на установленный срок. Второе — препарат, в основу которого входит вещество, аналогичное патентованному. При этом взаимозаменяемость этих препаратов доказана, а стандарты качества соответствуют предписаниям ВОЗ.
При выборе дженерика ориентируйтесь на фирму — нередко их производят те же компании, что выпускают оригинальные лекарства.
Разница заключается в технологии производства и в длине пути препарата в аптеку. Так, оригинальное лекарство идет по схеме: «синтез вещества — исследование его свойств — доклинические испытания — внесение поправок и изменений по их результатам — клинические испытания — производство лекарства — раскрутка с нуля и продвижение на рынке». Путь дженерика исключает первые ресурсозатратные ступени, сокращаясь до «получение сертификата — производство лекарства — продвижение на рынке». Понятно, что при таком раскладе себестоимость оригинала в разы выше, что сказывается на его оптовой и розничной цене. При этом производители дженериков могут сэкономить на технологии, так как патент распространяется только на молекулу действующего вещества. Например, если в оригинальном препарате при производстве на таблетку наносят специальное напыление, благодаря которому лекарство в течение нескольких часов равномерно поступает в кровь, и концентрация его поддерживается на высоком уровне, то в дженерике ингредиенты могут смешать и просто спрессовать таблетку. При приеме такого лекарства пиковая концентрация вещества в крови достигается моментально, а потом резко сходит на нет — и не всегда это правильный подход к лечению. Тот же самый препарат, произведенный по-другому в рамках закона, может действовать не в пример хуже оригиналу, но и стоить в разы дешевле.
Для того чтобы контролировать эти процессы, ВОЗ требует от производителей дженериков, прежде чем запустить лекарство в оборот, подтвердить его биологическую эквивалентность — то есть содержание действующего вещества и эффективность, равнозначные оригиналу. Также в идеале производитель должен подтвердить терапевтическую и фармэквивалентность — и каждое такое лицензирование увеличивает стоимость препарата.
По стандартам показатели воздействия на организм оригинала и дженерика могут различаться на 15–20 %, примесей может быть не больше 32%.
Однако даже в таких случаях есть вероятность столкнуться с менее эффективным лекарством, произведенным легально по всем стандартам и со всеми сертификатами, но из плохоочищенного сырья китайского или индийского производства.
В последнее время в Интернете часто можно встретить таблицы, которые составляют энтузиасты от народной фармакологии, — в них в левом столбце под шапкой «Дорогие препараты» мы встречаем названия оригинальных лекарств, а в правом под шапкой «Дешевый аналог» — названия дженериков, и это сравнение сложно назвать корректным. В любом случае лучше здраво оценивать свою ситуацию, исходя из всех имеющихся вводных, и помнить, что качественный дженерик будет входить скорее в среднюю ценовую категорию, нежели стоить 30 рублей за упаковку.
Контрафакт поможет отличить неряшливая бумажная упаковка, поплывшие буквы на ней, текст инструкции с ошибками, непривычные форма и цвет таблеток, отсутствие на них рисок или штампов, подозрительно низкая цена.
Подытоживая, отметим плюсы:
- дженерик позволяет не терять бесценное время: эти препараты доступнее, в отличие от патентованных;
- дженерик стоит меньше, иногда в десятки раз;
- хороший дженерик эффективен: если правильно подобрать дозировку, то разница может быть почти незаметна;
- дженерик позволяет делать самостоятельный выбор.
- сырье для дженерика может использоваться недостаточно качественное или быть плохо очищенным;
- дополнительные компоненты, которых нет в оригинале, могут вызывать аллергию или побочные эффекты;
- изменение рецептуры может плохо повлиять на течение болезни и лечение: эффект будет слишком сильным или слабым.
Источник
Оригинальный препарат и дженерик – в чем отличия?
» data-image-caption=»» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/originalnyj-preparat-ili-dzhenerik-900×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/originalnyj-preparat-ili-dzhenerik.jpg» title=»Оригинальный препарат и дженерик — в чем отличия?»>
Алена Герасимова (Dalles) Разработчик сайта, редактор
- Запись опубликована: 03.08.2020
- Время чтения: 1 mins read
В последние годы в фармакотерапии наблюдается рост доли дженериков. Хорошо ли это для пациентов? Чтобы ответить на этот вопрос, нужно понять, что такое дженерики, как создаются оригинальные лекарства, и наконец, чем отличается непатентованный препарат от оригинального (кроме названия и цены).
Многие европейские страны поддерживают дженерики. Оценки специалистов показывают, что их доля на рынке лекарств уже составляет около 70-80%.
Оригинальные лекарства – дорогая инновация
Фармацевтическая компания разрабатывает препарат с определенным активным веществом, начинает производство и открывает продажи. Так на аптечных полках появляются новые оригинальные лекарства.
Выход на рынок с новым активным веществом или новым препаратом – это сложный процесс, который может длиться несколько лет. Кроме того, разработка лекарств несет в себе огромный риск множества лабораторных испытаний, часто заканчивающихся дорогостоящими неудачами. Нетрудно догадаться, что разработка состава, годы исследований, клинические испытания и решение официальных вопросов по допуску к испытаниям и лицензированию стоят миллионы долларов.
По какому маршруту пойдет новый препарат, прежде чем он попадет в аптеки?
- Первый этап – лабораторное исследование, которое также является попыткой изучить возбудителя или механизм заболевания, против которого направлено лекарство. Из многих тысяч молекул с многообещающими свойствами исследовательские группы обычно выбирают только несколько сотен или несколько десятков вариантов, обладающих наибольшим терапевтическим потенциалом.
- Затем активные вещества направляют на стадию доклинических исследований. С предметных стекол лабораторного микроскопа, группы веществ, отфильтрованных еще раз, переносятся для тестирования на животных. Начальная стадия тестирования обычно длится несколько лет и позволяет оценить эффективность препарата, его потенциал и побочные эффекты. Все это сводит к минимуму риск побочных эффектов в клинических испытаниях на людях.
Испытание лекарств
Клинические испытания – ворота к инновациям
Когда несколько молекул пережили испытания, показав себя с лучшей стороны, их направляют на клинические испытания. Опыты обычно делятся на несколько этапов, в которых принимают участие группы здоровых людей и пациентов с различными заболеваниями. Клинические испытания определяют, среди прочего, безопасную дозировку, влияние на конкретное заболевание, наиболее распространенные побочные эффекты.
На последнем этапе клинических испытаний проверяется эффективность нового препарата. И даже если все исследовательские группы оценили эффективность и прочие достоинства – это не означает конец процесса вывода нового препарата на рынок. Производитель проходит сложный и длительный процесс регистрации – документирование всех выполненных анализов, предоставление толстых папок с медицинской документацией за все годы исследований активного вещества.
Патент на здоровье…
Учитывая, сколько времени и денег фармацевтическая компания тратит на создание лекарства с определенным веществом, неудивительно, что производители имеют право на патентную защиту для своего открытия. Патент позволяет производить и продавать новый препарат только компании, которая успешно пошла по пути инноваций.
Патентная защита длится 20 лет, возможно продление патента до 25 лет. Только по истечении этого времени появляется возможность представить на рынке дженерик, то есть препарат, воссоздающий действие оригинального препарата.
Что такое дженерики
В производстве дженериков все очень серьезно. Непатентованное лекарственное средство, то есть заменитель, или, другими словами – эквивалент исходного лекарственного средства, должно не только содержать такое же активное вещество, что и исходное лекарственное средство, но и также отвечать нескольким ограничительным требованиям.
Универсальный препарат должен иметь:
- одинаковую форму, например, капсула / таблетка / порошок для растворения в воде;
- такую же биодоступность – т. е. количество активного вещества, которое из заданной дозы количественно попадет в кровоток и будет в равной степени абсорбировано;
- идентичное фармакологическое действие.
Препарат-дженерик также тестируется, но в этом случае задача – подтвердить его эффективность по сравнению с оригиналом. То есть измеряется:
- доступность лекарства, что отражает качество препарата;
- токсичность;
- биоэквивалентность – определяется в многоступенчатой биофармацевтической системе классификации.
Когда дженерик наконец поступит в продажу, монополия единственного производителя на рынке автоматически прекращается. Производство дженерика гораздо дешевле, а сокращение расходов на фармакотерапию распространяется не только на отдельного пациента, но и на страну.
Иными словами, дженерики – точные копии оригинальных препаратов, кроме одной детали: дженерики могут содержать другие вспомогательные вещества, при условии, конечно, что это не снижает их эффективность.
Иногда, однако, это может оказать негативное влияние на лечение. Например: на основе исходного препарата создается дженерик, который работает также, но имеет лактозу в покрытии. Люди, которые не переносят лактозу, не смогут использовать это лекарство.
По этой причине производитель непатентованного лекарственного средства не может, например, похвастаться клиническими испытаниями, проведенными для контрольного лекарственного средства.
Оригинальный препарат и дженерик – в чем отличия
Можно ли заменять оригинальные лекарства дженериками?
Да! При условии, что пациент хорошо его переносит. Экономия на разнице в цене между оригинальными и непатентованными лекарствами существенная, а эффективность аналогичная.
Однако что произойдет, если непатентованное лекарство будет давать побочные эффекты, которые не вызывало оригинальное лекарство? В России – ничего, придется купить оригинал. А во многих Европейских странах пациент с осложнениями имеет право обратиться в Национальный фонд здравоохранения, и ему покроют расходы на лечение побочных эффектов заменителя.
С экономической точки зрения, проблема дженериков и оригинальных лекарств основана на балансе потери и приобретения выгоды, и наиболее важную роль здесь играет врач, задача которого состоит в оценке риска использования заменителя лекарства в конкретном случае. Также врач должен информировать пациента о наличии любых других вспомогательных веществ, присутствующих в дженерическом препарате или, наоборот, в оригинальном лекарстве, если требуется заменить непатентованную терапию терапией оригинальным препаратом.
Без подробных данных, включающих не только стоимость лечения с использованием дженериков, но и общую стоимость, включая лечение побочных эффектов, невозможно оценить, дешевле ли медикаментозная терапия с использованием дженериков. Также невозможно классифицировать дженерики и оригинальные препараты, разделяя их на лучшие и худшие. Одно можно сказать наверняка: необходимость в использовании дженериков заключается в недостаточной доступности или дороговизне оригинальных лекарств.
Дженерик вместо оригинального препарата по рецепту
Фармацевт обязан по просьбе пациента, который приходит в аптеку с рецептом на более дорогой оригинальный препарат, предложить дженерик в том же количестве и той же дозе, что и препарат, прописанный в рецепте. Исключение составляют случаи, когда врач указывает в рецепте «не менять».
Но решение о замене лекарственного средства в фармакотерапии – от исходного лекарственного средства до аналога и наоборот всегда следует согласовывать с врачом – такое решение должно быть очень хорошо продуманным.
Источник
Дженерики и оригинальные ЛС
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
По данным ВОЗ, в 2008 году глобальные расходы на здравоохранение составили 5,7 триллионов долларов (www.who.int.), по мнению экспертов ВОЗ ни в одной стране мира в настоящее время нет достаточных средств на здравоохранение. Причина этого — рост цен на медицинские услуги и ЛС. Для снижения стоимости фармакотерапии ВОЗ и другие международные организации рекомендуют проведение политики дженерических замен ЛС.
Дженерики (генерики) – это ЛС, которые содержат ту же активную субстанцию, что и оригинальный препарат. Когда срок действия патента на оригинальное ЛС заканчивается, на фармацевтический рынок поступают дженерики — «копии» оригинальных ЛС. В соответствии с законом, дженерик не должен быть запатентован. Дженерик выходит на фармацевтический рынок при соблюдении двух условий: доказаны эквивалентность дженерика и оригинального ЛС по качественному и количественному составу (фармацевтическая эквивалентность) и биоэквивалентность (фармакокинетическая эквивалентность). В то же время в нашей стране до недавнего времени для дженериков не проводилось испытаний для установления клинической терапевтической эквивалентности на больных и клинической терапевтической эффективности со специальным вниманием к безопасности и переносимости при применении у пациентов. Эти две стадии испытаний всегда проводятся для оригинальных препаратов и требуют больших финансовых затрат. В частности, по данным FDA для дженерика рабепразола ОН-ТАЙМ (компания – производитель ТЕВА) не проводились исследования клинической и терапевтической эквивалентности. Именно поэтому дженерики всегда дешевле оригинальных ЛС.
В РФ доля дж енериков на фармацевтическом рынке превышает 70%, однако их эффективность и безопасность часто остается без внимания. В настоящее время в Европейском Союзе и в США отрицательно относятся к фармакокинетической эквивалентности как к единственному способу оценки взаимозаменяемости ЛС. Все чаще слышатся требования о проведении клинических исследований наиболее важных для здоровья общества дженериков. Как было уже сказано, в связи с введенными новыми законодательными нормами, к 2018 году сведения о взаимозаменяемости дженериков должны быть внесены в их инструкцию. Клиническая терапевтическая эквивалентность подразумевает проведение как ограниченных, так и крупных клинических исследований эффективности дженерика при конкретном заболевании, должно быть проведено также изучение сравнительной эффективности оригинального и воспроизведенного препарата [22].
Возникли такие требования потому, что стало очевидным наличие различий в отношении к дженерикам между лечащими врачами и регулирующими органами, регистрирующими ЛС. Поскольку дженерик и оригинальный препарат содержат одну и ту же активную субстанцию, врач полагает, что дженерик, который он выписывает пациенту, терапевтически эквивалентен оригинальному препарату. Однако это не всегда так. Почему же дженерики, которые содержат такую же активную субстанцию и характеризуются сходной с оригинальным ЛС биоэквивалентностью могут обладать худшей терапевтической эффективностью?
В первую очередь, согласно законодательству дженерик может содержать 95% активной субстанции [23]. Дженерики могут производиться с использованием другого технологического процесса, что может влиять как на количество, так и на состав примесей. Например, в оригинальном препарате ксеникал (ингибитор кишечных липаз фирмы Hoffman-La Roche) методами высокоэффективной жидкостной хроматографии и масс-спектрометрии обнаружено 3 примеси, а в дженерике орсотен (КRKA) – 13 [24]. Однако наличие определенного вида примесей даже в небольших количествах может снижать терапевтическую эффективность ЛС. Кроме того, может различаться и форма субстанции: она может быть как аморфной, так и в виде различных кристаллов. Для омепразола, например, запатентовано около 10 различных кристаллических форм. Они могут различаться по растворимости, химической реакционноспособности (например, по скорости гидролиза или окисления), механическим изменениям (например, таблетки крошатся при хранении, при этом кинетически предпочтительная форма может превращаться в термодинамически более стабильную), по чувствительности к распаду при высокой влажности.
Кроме того, все ЛС – это комбинированные препараты, которые помимо активной субстанции (химического реагента с определенными свойствами) содержат значительное количество дополнительных химических соединений, обеспечивающие его доставку к органам-мишеням, консервацию во время хранения, облегчающие всасывание или растворение в биологических жидкостях и т.д. Чтобы получить максимальный эффект ЛС, его употребляют не в виде собственно активной субстанции, то есть, химического вещества, а в сочетании со вспомогательными веществами, обеспечивающими и поддерживающими его лекарственное действие. Изменение состава и количества дополнительных компонентов ЛС, даже при наличии той же самой активной субстанции, может снизить терапевтическую эффективность препарата-дженерика , по сравнению с оригинальным ЛС, хотя фармацевтически они могут быть эквивалентными.
С целью определения биоэквивалентности оригинального ЛС и дженерика проводят двухфазное перекрестное (исследуемый препарат и препарат сравнения) рандомизированное исследование биоэквивалентности для определения значений AUC, Cmax и Tmax, обычно с участием 18–36 пациентов. При этом биоэквивалентность подтверждается, если границы двустороннего 90%-ного доверительного интервала для отношения среднегеометрических значений показателя AUC и Cmax/AUC для изучаемого препарата и препарата сравнения находятся в пределах 80-125%, а для показателя Сmax – в пределах 70-143%. Однако существуют ЛС, для которых характерна высокая вариабельность фармакокинетических параметров между отдельными субъектами. Если эти очень вариабельные ЛC характеризуются еще и высокой вариабельностью в партии (то есть, т. е., при переходе от таблетки к таблетке), то это создает дополнительный вклад в варибельность фармакокинетических параметров. Проблема изучения биоэквивалентности препаратов с высокой вариабельностью фармакокинетических параметров заключается не только в необходимости включения в исследование биоэквивалентности большего количества здоровых добровольцев, но и в том, что в популяции есть индивидуумы, которые по-разному реагируют на одну и ту же активную субстанцию, представленную в разных формулировках [25].
Все это в совокупности может привести к тому, что дженерик и оригинальное ЛС могут существенно различаться. Исследование, в котором сравнивался оригинальный кларитромицин (фирма Abbott Laboratories) и 65 его дженериков, находящихся на фармацевтическом рынке 18 стран, подтвердило это [26]. Было обнаружено, что в 6 препаратах-дженериках содержание активного вещества не соответствовало стандартам компании-разработчика, у 28 препаратов количество высвобождавшегося при растворении активного компонента было ниже, чем у оригинального, у 12 ЛС был превышен 3%-ный лимит посторонних примесей и 0,8% лимит для 6,11 ди-O-метилэритромицина A. В итоге 46 дженериков из 65 не соответствовали критериям компании, разработавшей оригинальное ЛС.
Немногочисленные работы, в которых сравнивалась терапевтическая эквивалентность дженериков и оригинальных препаратов ИПП, подтверждают, что они не всегда эквивалентны терапевтически. Cравнение эффективности оригинального омепразола и дженериков (Omeprazole-Towa, Ovulance, Omerap) в подавлении секреции кислоты показало, что днем эффективность действия, измеряемая по проценту времени с внутригастральным рН более 4, сравнима для всех препаратов и значительно выше, чем у плацебо. Однако в течение ночи наблюдались прорывы секреции кислоты, вследствие чего процент времени с рН более 4 при лечении Omeprazole-Towa и Omerap был незначительно выше, чем при лечении плацебо [27].
Сравнение эффекта Париета и одного из дженериков рабепразола, проведенное украинскими исследователями показало, что есть существенные различия в их терапевтической эффективности [28]. Если антисекреторный эффект Париета достигался через 100 минут после приема, то дженерик рабепразола начинал действовать лишь через 160 минут, длительность удержания внутригастрального рН выше 4 при приеме дженерика была почти в 2 раза меньше, чем у Париета, и, наконец, при проведении эрадикации Н. pylori с использованием в качестве ИПП Париета и дженерика рабепразола эффективность составила 92 и 66%, соответственно. Это означает, что врач, выписывающий пациенту дженерик с неисследованной терапевтической эквивалентностью, руководствуясь общепринятым мнением, что «это то же самое, но дешевле», может быть разочарован результатами лечения.
Рис. 17. Париет® 20 мг и ОН-ТАЙМ, рабепразол компании «Тева» 20 мг, исследование биоэквивалентности, 47 здоровых добровольцев
Public Assessment Report UK MHRA (Агентство по регулированию лекарств и медицинских изделий Великобритании http://www.mhra.gov.uk/home/groups/par/documents/websiteresources/con102788.pdf 
И, наконец, недавно полученные данные по прямому сравнению фармакокинетических параметров Париета и дженерика рабепразола, проведенные с использованием 47 здоровых добровольцев, показывают, что AUC для дженерика рабепразола (ОН-ТАЙМ, компания –производитель Тева) составляет лишь 93,6% от оригинального препарата, а Сmax – 91,5% (рис. 19).
Необходимость исследования терапевтической эквивалентности оригинальных препаратов и дженериков ИПП можно обосновать следующим фактом: доказано, что биодоступность ИПП снижается при обострении язвенной болезни двенадцатиперстной кишки [18]. Графически это явление наиболее ярко продемонстрировано на примере дженерика лансопразола, для которого проводилось фармакокинетическое исследование при однократном введении в дозе 20 мг у здоровых добровольцев, у пациентов с гастродуоденитом и с язвенной болезнью двенадцатиперстной кишки в различные фазы заболевания (рис. 20). Оказалось, что у больных с обострением язвенной болезни, по сравнению со здоровыми добровольцами, относительная биодоступность препарата f=54,0%, f I =49,5%, максимальная степень всасывания 40,9%.
Относительная биодоступность (относительная степень всасывания) f (при расчете за период времени от нуля до бесконечности), f I (при расчете за период времени от нуля до забора последней пробы крови) и максимальная степень всасывания (f II ) здесь рассчитываются как отношения средних значений соответственно AUC0-∞ , AUC0-t и Cmax у больных с обострением язвенной болезни и здоровых добровольцев.
Рис. 18. Динамика усреднённых концентраций лансопразола в плазме крови после однократного приёма лансопразола в дозе 30 мг 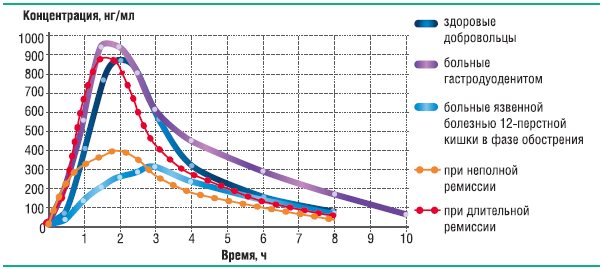
Абсорбция лансопразола резко снижается при обострении язвенной болезни и при неполной ремиссии (стадия «красного» рубца), и всасывание восстанавливается через 6 месяцев после обострения. Данное явление не может быть объяснено генетическими особенностями пациентов, так как подобную динамику фармакокинетических показателей мы наблюдали у одних и тех же пациентов в различные фазы заболевания. Таким образом, фармакокинетика лансопразола у здоровых добровольцев и у больных с обострением язвенной болезни двенадцатиперстной кишки неодинакова, следовательно, биоэквивалентность дженерика и оригинального лансопразола, как и других ИПП у больных с язвенной болезнью, не может быть гарантирована.
Сравнительное исследование фармакокинетики дженерика омепразола и оригинального препарата эзомепразола показало, что при однократном применении обоих препаратов в одинаковых дозах (20 мг) значения Cmax и AUC эзомепразола превышают таковые омепразола, что подтверждает данные о более высокой биодоступности эзомепразола за счет снижения биотрансформации с помощью CYP2С19. При обострении язвенной болезни абсорбция обоих ЛС снижается, но в разной степени (рис. 21). Относительная биодоступность дженерика омепразола f=61,0%; f I =61,1%; максимальная степень всасывания f II =46,7%. Относительная биодоступность оригинального препарата эзомепразола f=66,5%; f I =70,3%; максимальная степень всасывания f II =65,0%.
Табл. 2. Параметры сравнительной фармакокинетической оценки биодоступности дженериков омепразола, лансопразола и оригинального эзомепразола и Париета у здоровых добровольцев и пациентов с обострением язвенной болезни двенадцатиперстной кишки при однократном пероральном приеме [18] 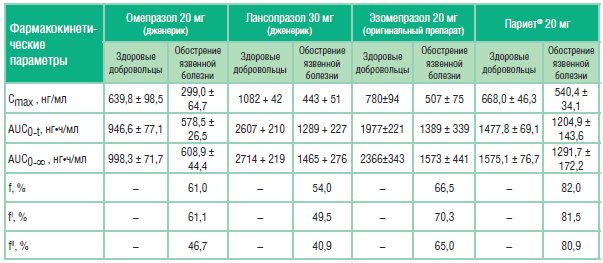
Наиболее стабильную биодоступность при обострении язвенной болезни демонстрирует оригинальный рабепразол – Париет. Его относительная биодоступность f=82,0%; f I =81,5%; и максимальная степень всасывания f II =80,9% (рис. 21). Усредненные фармакокинетические кривые для Париета у здоровых добровольцев и у больных с обострением язвенной болезни представлены на рис. 22.
Рис. 19. Динамика концентрации Париета (оригинального рабепразола) в плазме крови здоровых добровольцев и больных язвенной болезнью после однократного приема 20 мг препарата 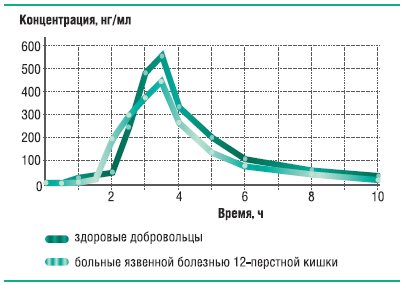
Таким образом, для присутствующих на российском фармацевтическом рынке и широко используемых препаратов ИПП нами было показано, что при обострении язвенной болезни биодоступность дженериков снижается на 38,9-50,5%, а оригинальных препаратов – на 18,0-33,5%; максимальная степень всасывания снижается у дженериков на 53,3-59,1%, а у оригинальных препаратов на 19,1-35,0%.
Причины снижения биодоступности ИПП при обострении язвенной болезни не изучались. Возможно, каким-то образом изменяется активность метаболизирующих энзимов или ферментов транспортеров. Вероятно, вспомогательные вещества, входящие в лекарственные формы производителей каким-то образом влияют на стабильность ИПП в лекарственных формах или на абсорбцию через воспаленные слизистые оболочки. До формирования каких-либо выводов необходимо проведение полноценных лабораторных и клинических исследований. Однако некоторые данные уже могут быть представлены к обсуждению: обеспечение стабильности лекарственной формы в средах с различными значениями рН.
Одним из методов сравнения дженериков, согласно рекомендациям ВОЗ, являются испытания in vitro, так называемое испытание дозированной формы по тесту «растворение». Для ИПП тест «растворение» особенно актуален, так как все они неустойчивы в кислоте, и для сохранности доставки активного действующего вещества в тонкий кишечник применяют лекарственные формы, заключенные в полимерные кишечнорастворимые оболочки.
Лекарственные формы ИПП испытывают по тесту «растворение» в средах с низкими (обычно рН 1,2) и высокими (pH≥6,8) значениями рН. При рН 1,2 лекарственные формы ИПП разрушаться не должны. При максимально высоких значениях рН (индивидуальные для разных ИПП значения максимального рН выбирают исходя, например, из значений изоэлектрической точки и т.д) активное действующее вещество должно полностью высвобождаться из лекарственной формы. То есть, при выполнении данного теста определяется стабильность лекарственных форм ИПП в условиях, приближенных по значениям рН к внутрижелудочному содержимому и внутрипросветному содержимому тонкой кишки.
Однако при выполнении стандартного теста «растворение», который может продемонстрировать одинаковые кривые растворения оригинального препарата и дженерика, не учитывается, что при промежуточных значениях рН кинетика растворения может не быть одинаковой и зависеть от качества кишечнорастворимых полимерных оболочек. Почему нужно знать, одинаково ли высвобождаются лекарственный препарат и дженерик при промежуточных значениях рН? Например, потому, что практически для всех пациентов с обострением язвенной болезни характерно наличие высокоамплитудных колебаний внутрижелудочного рН, связанных с дуоденогастральным рефлюксом, при которых после значительного повышения рН происходит достаточно быстрое его снижение до очень кислых значений за счет высокой интенсивности кислотопродукции. Если таких высокоамплитудных колебаний нет, это свидетельствует о торпидном течении язвенной болезни. Дуоденогастральный рефлюкс характеризуется быстрыми подъемами внутрижелудочного рН выше 4. О патологическом дуоденогастральном рефлюксе, характерном для большинства кислотозависимых заболеваний пищеварительного тракта, свидетельствуют быстрые подъемы рН выше 7.
Практически у всех больных с обострением язвенной болезни двенадцатиперстной кишки во время дуоденогастрального рефлюкса рН поднимается до 3 или 4, 7, а часто и до 9. Если предположить, что полимерная оболочка лекарственной формы ИПП частично растворяется на высоте рефлюкса, то последующее снижение рН должно привести к разрушению частично или полностью высвободившегося некислотоустойчивого активного действующего вещества.
Кроме того, известно, что через несколько дней курсового применения эффективных антисекреторных препаратов среднесуточные значения внутрижелудочного рН превышают значения 4, и это является необходимым условием для, например, успешного заживления эрозий в пищеводе. Если лекарственное средство в кишечнорастворимой оболочке будет нестабильным при этом значении рН, тем более, при рН 3, препарат будет разрушаться уже в желудке.
Был проведен тест «растворение» дженерика омепразола и оригинального препарата эзомепразола в средах с рН=3 и рН=4. Результаты представлены на рис. 23.
Табл. 3. Доля омепразола и эзомепразола в растворе в зависимости от времени экспозиции в средах с рН=3 и рН=4 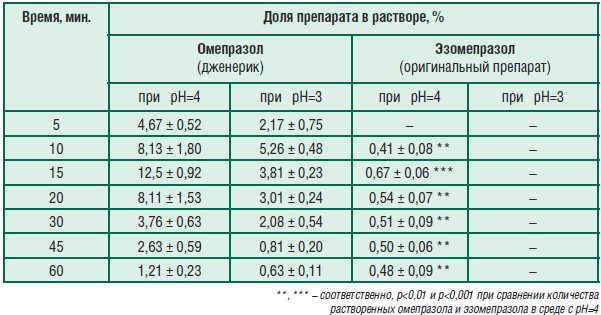
Показано, что при обоих значениях рН в растворе оказывается большее количество дженерика, чем оригинального препарата, вне зависимости от времени экспозиции препаратов в среде растворения. При этом качество лекарственного средства в кишечнорастворимой оболочке тем выше, чем меньше действующего вещества выходит в раствор при заданных в тесте условиях. Истинное количество массы действующего вещества, которое растворяется при данных значениях рН, установить не представляется возможным из-за их нестабильности в кислой среде (рН 4 – все еще кислая среда). Анализ результатов исследования показал, что в условиях, аналогичных по уровню рН и длительности экспозиции в среде растворения условиям в просвете желудка при дуоденогастральном рефлюксе, дженерик в большей степени, чем оригинальный препарат, высвобождается из кишечнорастворимой лекарственной формы. Производители оригинального препарата, вероятно, используют кишечнорастворимый полимер, более устойчивый к действию дуоденогастрального рефлюкса, также как и к условиям среды желудка при курсовом применении антисекреторных средств, чем производители исследованного дженерика. Если есть вероятность, что неустойчивый в кислой среде препарат выпускается в кишечнорастворимой оболочке худшего качества, разрушающейся при фармакологической кислотосупрессии или при высокоамплитудных колебания рН, связанных с дуоденогастральным рефлюксом у больных с обострением язвенной болезни двенадцатиперстной кишки, соответствие дженерика оригинальному препарату должно подтверждаться не стандартным тестом «растворения», а клиническими исследованиями терапевтической эквивалентности. Однако до недавнего времени в РФ указанные доводы никак не были учтены в регламенте проведения лабораторных и клинических исследований, необходимых для регистрации препаратов – дженериков. В настоящее время, согласно 429-ФЗ до 2018 года для каждого дженерика должна быть подтверждена взаимозаменяемость.
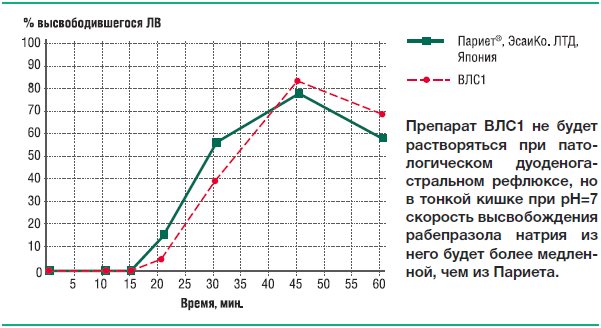
Мы имеем честь представить вам результаты исследования, которое очевидно станет основополагающим для дальнейших испытаний ЛС, выпускающихся в кишечнорастворимых лекарственных формах. В тесте сравнительной кинетики растворения была изучена растворимость таблеток оригинального рабепразола (Париет) и двух воспроизведенных лекарственных средств с действующим веществом рабепразол (ВЛС1 и ВЛС2), зарегистрированных в РФ для медицинского применения. Исследуемые ЛС были приобретены в аптеках г. Москвы в июле-сентябре 2015 года. Условия проведения сравнительного теста растворения выбирались с расчетом, что они будут имитировать патологический дуоденогастральный рефлюкс и курсовую кислотосупрессию, которая возникает вследствие применения самих же сравниваемых ИПП. Кинетику растворения рабепразола изучали в итоге в средах с рН 7,0 и рН 4,0.
Усредненные значения количества рабепразола натрия, высвободившегося в раствор из изучаемых лекарственных средств (таблетки 20 мг), приведены в таблице 4.
Как видно из представленных данных, высвобождение рабепразола в среде растворения с рН=7,0 из препарата ВЛС2 начинается с 12-ой минуты, а из препаратов Париет и ВЛС1 – с 20-й минуты. Согласно данным по фармакокинетике рабепразола и сведениям по доле времени, в течение которого при патологическом рефлюксе внутрижелудочный рН превышает значение 7,0, это означает, что рабепразол будет выходить из лекарственной формы ВЛС2 под влиянием патологического дуоденогастрального рефлюкса уже в желудке. К 45 минутам в раствор переходит из препарата Париет 79,2% рабепразола натрия, из препарата ВЛС1 – 82,4%, из препарата ВЛС2 – 72,3%.
В среде растворения с рН 4,0 высвобождение рабепразола натрия происходит только из таблеток ВЛС1, что свидетельствует о неустойчивости его кишечнорастворимой оболочки в среде желудка с рН 4,0 (оптимальные среднесуточные значения рН при адекватной курсовой кислотосупрессии).
Усредненные профили растворения Париета и ВЛС1; Париета, ВЛС2 в среде растворения рН 7 представлены на рисунках 24 и 25. Усредненный профиль растворения препарата ВЛС1 в среде растворения рН 4,0 представлен на рисунке 26.
Эти данные означают, что у ВЛС1 через несколько дней от начала его курсового применения, когда среднесуточные значения рН содержимого желудка установятся на оптимальных значениях, будет преждевременно разрушаться собственная кишечнорастворимая оболочка. Таким образом, можно ожидать, что при курсовом применении ВЛС1 будет сам снижать собственную клиническую эффективность.
Рис. 20. Усредненные профили кинетики высвобождения рабепразола натрия из препаратов Париет® и ВЛС1 в фосфатном буферном растворе рН 7,0
Рис. 21. Усредненные профили кинетики высвобождения рабепразола натрия из препаратов Париет® и ВЛС2 в фосфатном буферном растворе рН 7,0 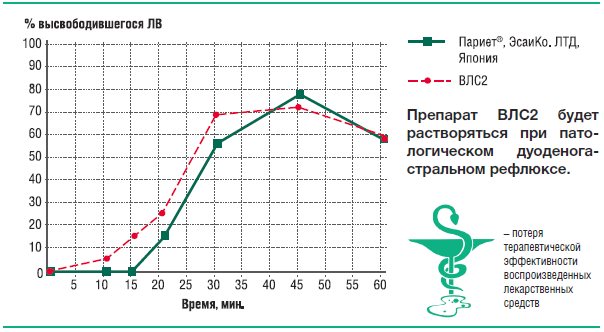
ВЛС2 не будет вызывать подобного эффекта, однако, он неустойчив к действию патологического дуоденогастрального рефлюкса, и на подъеме рН≥7 его кишечнорастворимая оболочка теряет герметичность, а некислотоустойчивый рабепразол оказывается беззащитным перед следующим за рефлюксом падением рН.
Таблица 4. Результаты кинетики растворения исследуемых препаратов рабепразола 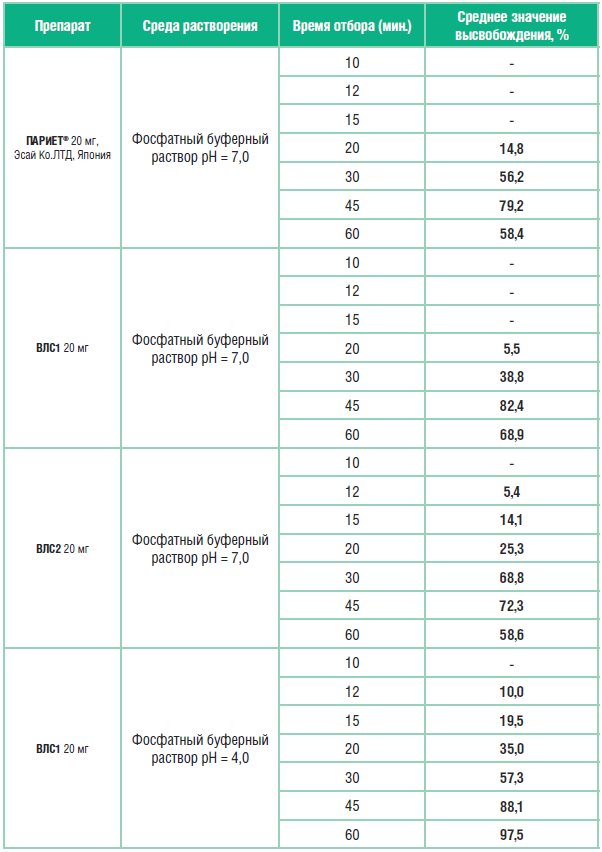
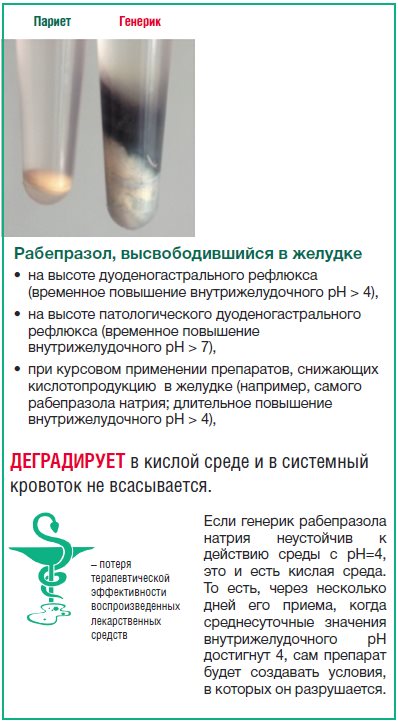
Как это происходит, представлено на рисунке 23. В одной пробирке в одном растворе, имитирующем действие патологического дуоденогастрального рефлюкса, находятся таблетки Париета и ВЛС2. На фотографии видно, что растворяется только одна таблетка. Обе таблетки были извлечены из раствора и высушены. Видно, что таблетка, расположенная на поверхности справа, сохранила свою форму и герметичность. Она только утратила надпись (Париет). Оболочка таблетки слева (ВЛС2) разорвана по шву, обнажая содержимое.
Рис. 22. Усредненные профили кинетики высвобождения рабепразола натрия из препаратов Париет® и ВЛС1 в фосфатном буферном растворе рН 4,0 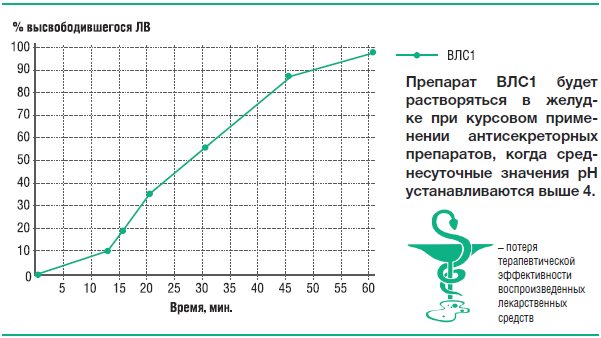
Если во время патологического дуоденогастрального рефлюкса из лекарственной формы высвобождается рабепразола натрий, то при восстановлении гиперацидности, связанной с высокой интенсивностью внутрижелудочной кислотопродукции, препарат частично разрушается уже в желудке. Т.е. биодоступность рабепразола снижается (Рис. 24).
| Рис. 23. Разрушение таблетки генерика рабепразола в среде, имитирующей условия дуоденогастрального рефлюкса | Рис. 24. Последствия контакта рабепразола натрия, высвободившегося в желудке из кишечнорастворимой оболочки, с кислой средой |
 |  |
Таким образом, ВЛС1 и ВЛС2, представленные на российском фармацевтическом рынке, не будут обладать должным фармакодинамическим эффектом и клинической эффективностью у больных с кислотозависимыми заболеваниями пищеварительного тракта, по сравнению с оригинальным препаратом (Париет).
Данная проблема касается не только препаратов рабепразола натрия, выпускаемых в таблетках, покрытых кишечнорастворимой оболочкой. На рисунках 25 и 26 представлены 3 образца пеллет (содержимого капсул: гранул, покрытых кишечнорастворимыми оболочками) разных ИПП, помещенных в среду с рН=4. Время экспозиции в данном растворе 30 мин. В образце слева пеллеты разрушены, раствор над ними мутный. В образце справа внешних признаков повреждения пеллет нет (есть незначительное их окрашивание), однако, наблюдается помутнение раствора над ними. В образце посередине наблюдается сохранение целостности, исходной окраски пеллет и прозрачность раствора над ними.
Рис. 25. Состояние пеллет разных ИПП через 30 мин. экспозиции в растворе с рН=4 
Рис. 26. Состояние пеллет разных ИПП через 30 мин. экспозиции в растворе с рН=4 (контрастный фон для демонстрации помутнения раствора над пеллетами) 
Источник