- Орфанные препараты
- Правовое регулирование орфанных заболеваний и орфанных препаратов в РФ
- Преференции для орфанных лекарственных препаратов
- Обеспечение орфанными лекарственными препаратами
- Орфанные препараты — новая категория на фармрынке
- Нередкие редкие (орфанные) заболевания
- Редкие болезни известных людей
- Примеры списка орфанных заболеваний
- Орфанные («сиротские») препараты. Справка
Орфанные препараты
Статья подготовлена 15.11.2016
Младший юрист Юридической фирмы « BRACE »
Впервые термин «орфанные болезни» (редкие заболевания, «болезни-сироты») появился в 1983 г. в США при принятии закона об орфанных болезнях (Orphan Drug Act). Это такие болезни, как: фенилкетонурия, муковисцидоз, множественная миелома, хронический миелолейкоз, болезнь Гоше, глиома и другие. Сегодня понятие орфанных заболеваний закреплено в законодательствах многих стран, к примеру, в Австралии, Японии, Сингапуре. В 1999 г. аналогичный американскому закон был принят Европейским парламентом.
Правовое регулирование орфанных заболеваний и орфанных препаратов в РФ
В России, где орфанными заболеваниями страдают по разным подсчетам от 1,5 до 5 миллионов жителей, нет отдельного федерального закона, регулирующего орфанные заболевания и препараты. Впервые в российском законодательстве определение понятия орфанных заболеваний было дано в 2011 году в Федеральном законеот 21.10.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (далее ФЗ — №323) в ст. 44. Согласно указанному закону орфанными заболеваниями признаются заболевания, которые имеют распространенность не более 10 случаев заболевания на 100 тысяч населения. В 2014 г. понятие орфанных лекарственных препаратов было введено в ФЗ от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
Для того, чтобы получить статус орфанного препарата, необходимо наличие определенных критериев. Препарат должен быть предназначен для лечения заболеваний, не превышающих 10 случаев такого заболевания на 100 тысяч населения. В ЕС, например, помимо вышеуказанных факторов, также важно, чтобы орфанный препарат предназначался для пациентов с заболеванием, для которого не существует официально признанных удовлетворительных методов диагностики, профилактики и лечения. Если препарат для лечения заболевания существует, то необходимо доказать, что новый продукт имеет преимущества по сравнению с лекарством, которое уже имеет статус орфанного. Более того, в ряде зарубежных стран орфанным лекарственным препаратом может быть признан препарат, расходы на разработку которого превышают потенциальные доходы от выхода на рынок.
Стоит отметить, что российское законодательство рассматривает понятие орфанного препарата гораздо уже, чем зарубежные правопорядки, ограничиваясь лекарственными препаратами для лечения и диагностики редких заболеваний (диагностика, лечение и предотвращение заболевания – например, ЕС). При этом лечение должно быть связано с механизмом развития заболевания, что, по мнению многих врачей, является необоснованным ограничением.
Преференции для орфанных лекарственных препаратов
Российское законодательство содержит ряд льгот для орфанных лекарственных средств. ФЗ № 61 предполагает возможность ускоренной процедуры экспертизы орфанных препаратов в целях последующей государственной регистрации (80 рабочих дней). Сначала происходит экспертиза всех документов, предоставляемых для определения возможности рассматривать препарат в качестве орфанного, на основании копий документов, заверенных в установленном порядке, о регистрации препарата на территории других государств в качестве орфанного лекарственного препарата. Затем, если решение будет положительным, проводятся следующие виды экспертизы, предусмотренные законодательством, — (1) качества и (2) соотношения ожидаемой пользы к риску. Для орфанных препаратов признаются результаты доклинических и клинических исследований, которые были выполнены за пределами РФ в соответствии с правилами надлежащей лабораторной практики и правилами надлежащей клинической практики, что, например, в ЕС является общим правилом, а в России считается исключением.
Одним из главных недостатков существующей системы создания и регистрации орфанных препаратов в РФ является отсутствие налоговых стимулов и льгот, увеличенных сроков эксклюзивности на рынке в отличие от других стран. К примеру, срок эксклюзивности товара в ЕС – 10 лет; в США – 7 лет; в Японии — 5 лет, т.е., после вывода препарата на рынок по этому показанию в течение определенного срока больше не будет зарегистрировано ни одного препарата. Утверждение статуса орфанного для препарата в Японии дает право производителю на возмещение 50% затрат на разработку препарата, снижение налогов на 6% и другие финансовые льготы. Если производитель орфанного препарата в Японии получил прибыль от его реализации, он обязан вернуть часть этих денег в фонды, из которых были выделены деньги на производство препарата и его разработку.
Однако у таких преференций есть и обратный эффект. Так, власти США, стараясь сделать терапию доступнее, в 2013 году снизили цены на определенные препараты, применяемые для борьбы с орфанными заболеваниями. В результате получилось, что эта мера пациентов с редкими заболеваниями так и не коснулась: существует ряд орфанных лекарственных средств, предназначенных для лечения более распространенных заболеваний, и снижение цен затронуло именно этих пациентов. Также одной из проблем в США является то, что фармацевтические компании, используя все преференции для выпуска орфанных лекарственных средств, в дальнейшем продают их как препараты для широкого пользования .
Обеспечение орфанными лекарственными препаратами
В Российской Федерации существует Федеральный регистр граждан, страдающих орфанными заболеваниями.Согласно ч. 9 ст. 83 ФЗ № 323, обеспечение граждан зарегистрированными в установленном порядке на территории России лекарственными препаратами для лечения заболеваний, включенных в перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни гражданина или его инвалидности, осуществляется за счет средств бюджетов субъектов РФ. Такое распределение полномочий с учетом цен на орфанные лекарственные препараты приводит к тому, что зачастую потребность пациентов в лечении не удовлетворяется, как результат, многочисленные судебные споры об обязании обеспечить пациента лекарственными средствами в рамках реализации конституционного права гражданина на охрану здоровья.
В нашей стране нет четких технологий фармакотерапии орфанных больных, а стоимость лечения больного не сопоставима с бюджетом субъектов РФ, на которых и отпущено лекарственное обеспечение таких больных. В 2013 г. была сделана попытка передачи финансирования на уровень федерального бюджета в виде внесения законопроекта о таком изменении в Государственную Думу, однако законопроект так и не был принят.
Таким образом, на сегодняшний день российское законодательство не содержит достаточных гарантий как для разработчиков орфанных лекарственных препаратов, так и для пациентов, страдающих редкими заболеваниями.
Источник
Орфанные препараты — новая категория на фармрынке
Роза Ягудина о росте количества орфанных препаратов и их роли в лечении пациентов
Нередкие редкие (орфанные) заболевания
Редкие болезни известных людей
Примеры списка орфанных заболеваний
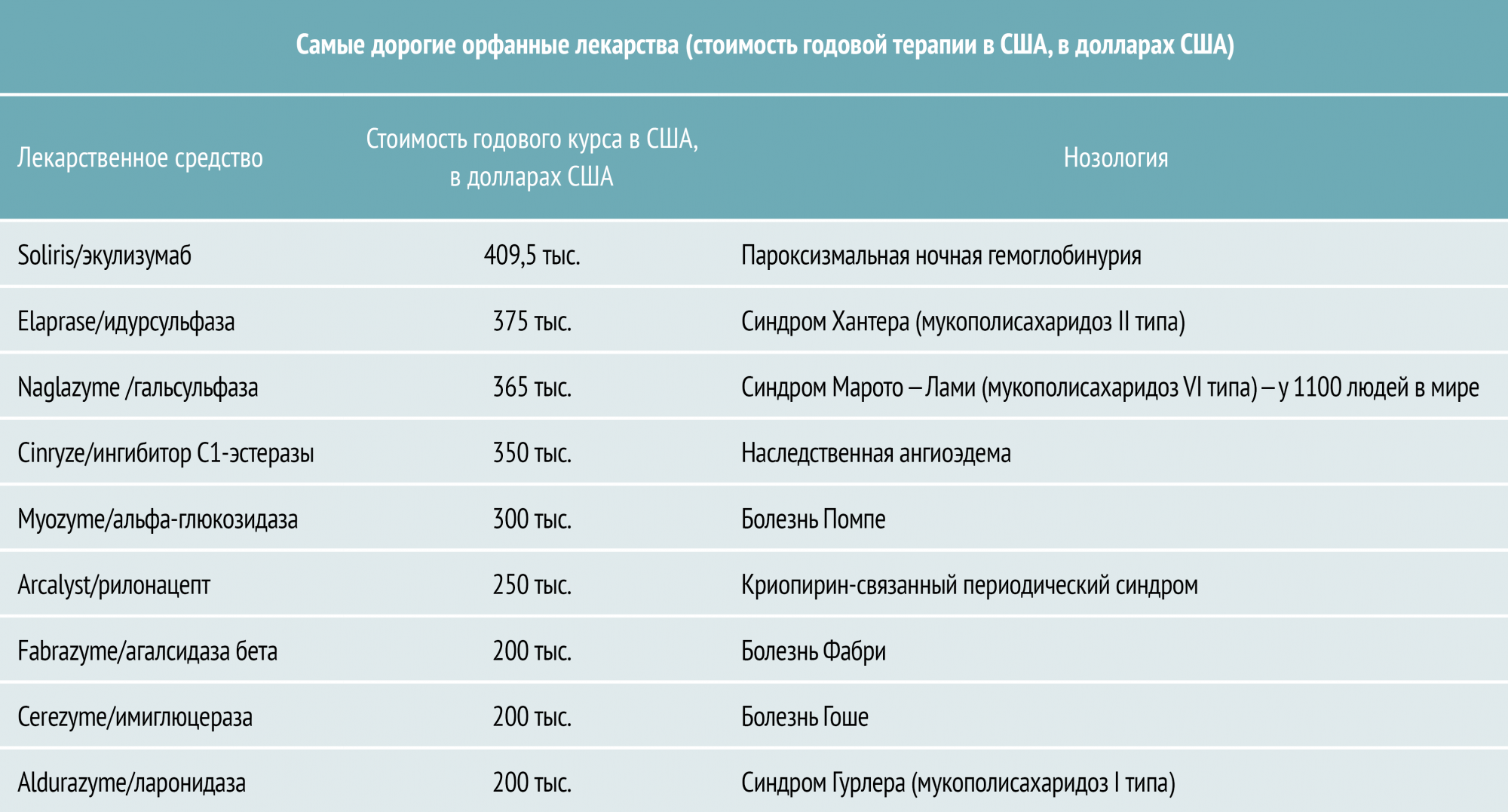
Почему так дорого?
- Всероссийское общество гемофилии
- Общероссийская общественная организация инвалидов — больных рассеянным склерозом
- Межрегиональная общественная организация «Помощь больным муковисцидозом»
- Межрегиональная общественная организация «Содействие инвалидам с детства, страдающим болезнью Гоше, и их семьям»
- Региональная общественная организация помощи больным несовершенным остеогенезом
- «Хрупкие дети»
- Межрегиональная общественная организация «Содействие больным саркомой»
- Ассоциация нервно-мышечных болезней «Надежда»
- Благотворительный фонд «Подари жизнь»
Материалы об орфанных препаратах и заболеваниях:
Системные васкулиты как пример редких, орфанных заболеваний
Первичные системные васкулиты — редкие (орфанные) заболевания, и врачи, работающие в обычных лечебных учреждениях, а не в специализированных центрах, просто не могут накопить необходимого опыта в распознавании и лечении этих болезней.

Новые открытия и актуальные проблемы в мире лекарств
Сегодня орфанным препаратам стали уделять повышенное внимание. Появились препараты для лечения таких редких болезней, как мукополисахаридоз II типа, болезнь Ниманна-Пика и так далее.

Оригинальные лекарственные препараты и дженерики
В «лекарственном портфеле» многих инновационных компаний присутствуют орфанные препараты, которые окупаются долго и не приносят большой прибыли. Их разработка и производство являются следствием осознания ответственности перед каждым пациентом в отдельности.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
19 августа 2021
Редакция не несет ответственности за информацию, размещенную в рекламных материалах. Мнение редакции может не совпадать с мнением наших авторов. Все материалы, опубликованные в журнале, охраняются законом «Об авторском праве». Любое воспроизведение статей, перепечатка либо ссылка на них допускаются исключительно с письменного согласия редакции.
Источник
Орфанные («сиротские») препараты. Справка
Орфанными называются лекарства, предназначенные для лечения редких заболеваний.
Термин «орфанные болезни» (болезни-сироты) впервые появился в США в 1983 году при принятии законодательного акта «Orphan Drug Act». Он определил 1600 редких болезней, причины возникновения которых и лечение были слабо изучены. В Европе к орфанным болезням относят врожденные и приобретенные заболевания, частота которых не превышает пяти случаев на 10 тысяч больных.
Помощь таким больным часто затруднена из-за отсутствия методов лечения, а также лекарств, так как их разработка и производство не дают коммерческого успеха.
В России редкими (то есть возникающими у одного человека из двух тысяч) болезнями страдает от 1,5 до 5 млн человек.
Отечественное законодательство не содержит понятия «орфанных препаратов», не существует механизмов, стимулирующих появление этих препаратов в России.
В России фармацевтическим компаниям не выгодно ни производить, ни ввозить такие лекарства. Для ввоза требуется государственная регистрация, а процесс ее получения долог и капиталоемок. В результате десятки наименований жизненно необходимых лекарств отсутствуют на российском рынке, ограничивая доступ граждан, страдающих редкими заболеваниями, к медицинской помощи.
В России проблема обеспечения орфанными препаратами во многом решается усилиями общественных организаций. Благотворительные организации, помогающие больному получить лекарство, сначала получают заключение консилиума врачей одной из федеральных клиник, это заключение идет в Росздравнадзор, где через какое-то время выдают разрешение на ввоз. Затем волонтеры едут, например, в Германию и просят в аптеках продать им лекарство (эти лекарства считаются госпитальными, на Западе их покупают клиники, а не частные лица). Затем возвращаются и платят на таможне НДС 20% и пошлину 10% — таковы ставки для незарегистрированных лекарств.
Поскольку понятия орфанных лекарств не существует в законе, а препараты не зарегистрированы в России, официально собирать благотворительные пожертвования на их покупку также нельзя.
В западных странах выход таких препаратов на рынок стимулируется государством. В США, странах ЕС, Японии и некоторых других странах производителям орфанных лекарств предоставляются преференции на всех этапах жизни препарата. Самая главная преференция, которую дает «сиротский» статус, — эксклюзивность в отношении медицинских показаний. Это значит, что в течение десяти (ЕС), семи (США) и пяти (Япония) лет после вывода препарата на рынок по этому показанию больше не будет зарегистрировано ни одного препарата. Дело в том, что разработка орфанных препаратов занимает гораздо больше времени, чем разработка любых других, — до 15 лет. Одна из причин — очень долгий набор пациентов в клинические исследования, который может длиться годами (нормальная скорость набора пациентов — от нескольких дней до нескольких недель).
Кроме того, в американском законодательстве предусмотрены федеральные налоговые скидки (50% затрат на клинические исследования), а также льготы по оплате принятия решения по представленному препарату.
В ЕС для компаний, разрабатывающих орфанные препараты, предусмотрена компенсация затрат на процесс маркетингового одобрения.
По данным американских исследователей, за период с 2006 по 2008 год Управление по контролю за продуктами и лекарствами США (FDA) присвоило статус орфанных препаратов 425 лекарствам, тогда как в течение 2000-2002 годов орфанными были признаны лишь 208 препаратов.
31 марта 2010 года Совет Федерации РФ одобрил законопроект «Об обращении лекарственных средств», предусматривающий государственное регулирование цен на лекарства, относящиеся к категории жизненно необходимых и важнейших. При этом из окончательного текста законопроекта исчезло упоминание об «орфанных (сиротских) препаратах» (поправка пропала из закона между первым и вторым чтением в Госдуме).
В связи с этим несколько десятков благотворительных фондов объединились и обратились к президенту России Дмитрию Медведеву. Они просят главу государства узаконить оборот «сиротских» лекарств и упростить режим регистрации и ввоза. По их мнению, нужно вернуть закон на доработку и включить туда статью об орфанных лекарствах.
На сайте Минздрава России 1 апреля 2010 года было опубликовано официальное заявление директора Департамента развития медицинской помощи детям и службы родовспоможения Валентины Широковой «Об орфанных препаратах».
Согласно тексту заявления, «все то, что возможно было уложить в закон «Об обращении лекарственных средств», чтобы облегчить процедуру ввоза незарегистрированных препаратов на территорию России – было сделано.
К примеру, упрощена процедура ввоза препаратов для личного применения — теперь она составляет максимум 5 дней, разрешение на ввоз выдается в форме электронного документа с цифровой подписью. То есть теперь больному из региона не нужно будет ехать в Москву, выстаивать в очереди, ходить по кабинетам, чтобы получить разрешение.
Что касается введения в закон отдельной главы об орфанных препаратах, то это выходит за рамки данного закона – без внесения изменений в основной закон об охране здоровья, без создания регистров больных редкими заболеваниями (на основе популяционных исследований российских граждан), – пункт об орфанных препаратах в любом законе не будет иметь силы, поскольку в нашей стране нет основы: списка редких заболеваний, соответственно, для лечения которых требуются орфанные препараты».
Материал подготовлен на основе информации открытых источников
Источник