Определение цитотоксичности лекарственных препаратов
Производные аминоиндола и пирролохинолины как биологически активные вещества представляют большой интерес для исследования. Среди физиологически активных соединений как природного, так и синтетического происхождения азотистые гетероциклические системы занимают ведущее место. Наиболее интересными и перспективными являются производные хинолина и индола, а следовательно, пирролохинолина, в молекуле которого сочетаются указанные фармакофорные фрагменты. Самый молодой витамин, классифицированный как витамин группы В, по химической структуре представляет собой трициклический о-хинон-2,7,9-трикарбокси-1Н-пирроло[2,3-f]хинолин-4,5-дион, он обнаружен в живых системах как кофермент окислительно-восстановительных ферментов – PQQ (метоксатин). Он широко распространен в продуктах растительного происхождения: в плодах цитрусовых, киви, папайе, петрушке, перце, зеленом чае, а также в небольших количествах содержится в мясе, яичных желтках, женском молоке. Пирролохинолиновые аналоги PQQ представляют собой соединения, которые могут служить заменой природного вещества и могут быть использованы как антиоксиданты или как окислительно-восстановительные коферменты в ферментных системах [10]. Установлено, что биологическая активность PQQ зависит от характера заместителя в пирролохинолиновом кольце. Так, трициклический о-хинон-2,7,9-трикарбокси-1Н-пирроло[2,3-f]хинолин-4,5-дион в живых организмах является коферментом в окислительно-восстановительных системах, в то время как изученные трифторметилпроизводные PQQ обладают противомикробной и противогрибковой активностью. Нами проведена большая работа по исследованию антимикробной и противогрибковой активности данных соединений [3, 4, 5, 6]. Целью дальнейшего исследования стало изучение биологической безопасности данных соединений, так как в перспективе мы предполагаем их использование в составе лекарственных средств.
Цель исследования: изучить цитотоксичность производных аминоиндолов и пирролохинолинов с лабораторными шифрами 4Д (1,2,3,9-тетраметил-6-трифторметил-1,9-дигидро-8H-пирроло[3,2-h]хинолин-8-он), НД (6-гидрокси-2,3-диметил-6-трифторметил-1,6,7,9-тетрагидро-8H-пирроло[3,2-h]хинолин-8-он), 39Д (1,5-диметил-2-фенил-8-трифторметил-1,5-дигидро-6H-пирроло[3,2-g]хинолин-6-он), 66’ (4,4,4трифтор-N-(6-метокси-2,3-диметил-1H-индол-5-ил)-3-оксобутанамид), 64Д (4,4,4трифтор-3-оксо-N-(2,3,6-триметил-1H-индол-5-ил)бутанамид), 66Д (4,4,4трифтор-N-(6-метокси-1,2,3-триметил-1H-индол-5-ил)-3-оксобутанамид), 43Д (4,4,4трифтор-N-(6-метил-2-фенил-1H-индол-5-ил)-3-оксобутанамид) in vitro на линии опухолевых клеток HeLa (ATCC ® CCL-2TM).
Материалы и методы исследования
В работе была использована линия опухолевых клеток HeLa (ATCC ® CCL-2TM), полученная из коллекции банка глубокозамороженных клеточных культур ГУ НИИ вирусологии им. Д.И. Ивановского РАМН.
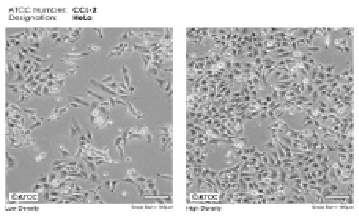
HeLa представляет собой эпителиальные клетки аденокарциномы шейки матки человека, прилипающие к подложке (рис. 1).
Эпителиальные клетки аденокарциномы шейки матки человека (HeLa ATCC ® CCL-2TM)
Опухолевые клетки культивировали в среде RPMI-1640 (Roswell Park Memorial Institute) (ПанЭко, Россия), содержащей 10 % эмбриональной телячьей сыворотки, 10 мМ буфера Hepes (4-(2-оксиэтил)1-пиперазинэтансульфоновой кислоты), 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина в пластиковых флаконах для культур клеток (Corning Costar, США) при 37 °С, 100 % влажности и 5 % содержании углекислого газа в окружающем воздухе. Пассирование клеточной культуры производили каждые 3 дня.
Во время пересева клетки снимали с поверхности пластикового флакона смесью раствора Версена (ПанЭко, Россия) и 0,25 % раствора трипсина (ПанЭко, Россия) (в соотношении 1:1) в течение 3–5 мин при 37 °С. После «ошпаривания» клеток и открепления их от дна флакона трипсин инактивировали добавлением питательной культуральной среды с 10 % эмбриональной телячьей сывороткой (ПанЭко, Россия).
В экспериментальных исследованиях широкое распространение для оценки лекарственной цитотоксичности получил МТТ-тест, (скрининговый метод измерения выживаемости клеток). Данный тест основан на способности митохондриальных дегидрогеназ живой метаболически активной клетки конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-етразолиум бромид (МТТ) в формазан, который выпадает в виде кристаллов внутри клетки. Растворение формазана с помощью диметилсульфоксида (ДМСО) и последующая фотометрия цветного (фиолетового) раствора позволяют сопоставить изменение оптической плотности раствора в опытных лунках по отношению к контрольным и, таким образом, косвенно оценить долю погибших клеток под влиянием изучаемого агента [7, 8].
В настоящей работе МТТ-тест проводили с использованием культуры клеток HeLa, по методике, описанной Mosmann Т. [9]. Клетки рассевали в лунки 96-луночного плоскодонного планшета для культур клеток в концентрации 104 – 2*104 кл/лунка и инкубировали при 37 °С, 100 % влажности и 5 % содержании углекислого газа в окружающем воздухе. После формирования монослоя производили замену полной культуральной среды, содержащей 10 % эмбриональную телячью сыворотку, на среду с низким содержанием сыворотки (1 % эмбриональной телячьей сыворотки) для стационирования культуры и вносили исследуемые соединения. Длительность инкубации с опытными веществами в концентрациях 2 мкг/мл, 20 мкг/мл, 200 мкг/мл составляла 48 ч. За 4 часа до окончания инкубации в каждую лунку вносили 20 мкл раствора МТТ (матричный раствор 5 мг/мл) (ПанЭко, Россия) и инкубировали на протяжении еще 4 ч. По окончании инкубации среду осторожно удаляли, а в каждую лунку добавляли по 200 мкл ДМСО (ПанЭко, Россия). Осадок ресуспензировали и растворяли в течение 15 мин, инкубируя в темноте при комнатной температуре. Показания оптической плотности считывали на планшетном ИФА-фотометре (Immunochem 2100, США) при 492 нм. Долю жизнеспособных клеток рассчитывали в процентах по отношению к контролю [1]. Цитотоксичность исследуемое вещество проявляет, если его процентный показатель оптической плотности меньше 70 %. Если показатель оптической плотности превышает 70 %, то данное вещество не проявляет выраженной цитотоксичности на культуру клеток [2].
Результаты исследования и их обсуждение
Для изучения прямой цитотоксичности исследуемых соединений использовался МТТ-тест, который получил широкое распространение в экспериментальных исследованиях. Исследуемые соединения 4Д, НД, 39Д, 66’, 64Д, 66Д, 43Д тестировали в диапазоне концентраций 2-200 мкг/мл в четырех параллельных сравнениях (для каждой концентрации) в 4 сериях экспериментов. Среднее значение для четырех измерений уровня оптической плотности (эквивалент доли метаболически активных/жизнеспособных клеток) выражали в процентах к контролю (таблица).
Определение цитотоксичности исследуемых соединений в МТТ-тесте
Источник
Определение цитотоксичности лекарственных препаратов
Под воздействием физиологически активных веществ клетки могут претерпевать изменения в морфологии, скорости клеточного роста, времени гибели и степени дезинтеграции, поэтому для каждого вещества, являющегося потенциальным фармакологическим агентом, необходимо выполнять оценку влияния на выживаемость клеток. Существуют различные методы определения цитотоксичности продуктов органического синтеза, природных соединений и экстрактов. Эти методы можно разделить на три группы:
1) измерение митохондриальной активности;
2) оценка выделения лактатдегидрогеназы или аденилаткиназы вследствие нарушения целостности цитоплазматической мембраны;
3) определение количества АТФ в клетках и активности киназы 3/7 как индикаторов клеточного некроза и апоптоза [14].
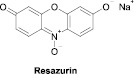
Первая группа методов особенно популярна в экспериментальных фармакологических исследованиях. Определение изменений в митохондриальной активности может быть определено с использованием МТТ (бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) и ресазурина (натриевой соли 7-гидрокси-3Н-феноксазин-3-он-10-оксида) (рис. 1).
Метод МТТ, который был впервые описан Mosmann более 30 лет назад [15], широко используется как скрининговый метод измерения выживаемости клеток и включен в большинство протоколов методов молекулярной биологии и медицины [10; 7]. В его основе лежит реакция восстановления желтой соли тетразолия (МТТ) митохондриальными дегидрогеназами живых клеток до пурпурных кристаллов формазана, которые нерастворимы в водной среде обитания клеток. Кристаллы формазана (МТТ-ф) растворяют в ДМСО или в смеси HCl-изопропанол и определяют колориметрически. Эта процедура убивает живые клетки, то есть МТТ-тест является конечной точкой исследования. Кроме того, метод определения цитотоксичности с помощью МТТ плохо реализуется при использовании суспензионных культур, так как подразумевает полное удаление среды культивирования на стадии растворения кристаллов формазана. Однако преимуществами данного метода является экономичность и отличная воспроизводимость результатов.
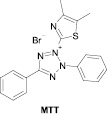
Рис. 1. Химические формулы использованных красителей
Ресазурин представляет собой водорастворимый прижизненный краситель, который используется с 1950-х годов для оценки бактериального и дрожжевого загрязнения биологических жидкостей и молока [9; 11]. Метод определения с его участием основан на способности живых клеток восстанавливать голубой нефлуоресцирующий ресазурин до розового флуоресцентного ресоруфина, который можно определить колориметрически или флуориметрически (последний способ более чувствителен) [4]. Ресазурин, в отличие от МТТ, восстанавливается более широким спектром ферментов: кроме митохондриальных дегидрогеназ его восстанавливают также цитохромы и дегидрогеназы, находящиеся в цитоплазме клетки [17]. Методологические особенности эксперимента с ресазурином позволяют использовать в исследовании суспензионные культуры и дают возможность в дальнейшем использовании культуры; то есть измерение выживаемости клеток при использовании ресазурина может быть первой, но не конечной, точкой эксперимента.
Целью данной работы является сравнение двух методов определения цитотоксичности – МТТ-теста и теста с участием ресазурина. Для решения задачи мы исследовали антипролиферативную активность 10 модифицированных производных природного эпоксиалантолактона по отношению к опухолевым линиям клеток человека RD (рабдомиосаркома) и НСТ116 (карцинома кишечника).
Материалы и методы исследования
В работе использовано оборудование Центра коллективного пользования научным оборудованием для создания генно-модифицированных линий животных и изучения эффективности соединений на оригинальных клеточных и трансгенных моделях нейродегенеративных заболеваний человека.
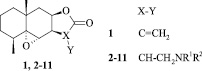
В качестве исследуемых соединений нами были выбраны аминопроизводные природного сесквитерпенового лактона – эпоксиалантолактона (1), который является минорным вторичным метаболитом растения Inula helenium L. Сведения о препаративной наработке исходного соединения и последующем модифицировании были опубликовано нами ранее [2; 1]. Мы также показали, что производные 2–11, сконструированные на основе эвдесманового сесквитерпенового лактона путем модифицирования рядом фармакофорных аминов, проявляют ингибирующую активность в отношении линии аденокарциномы молочной железы человека MCF7 [3]. Общая химическая структура исследуемых соединений приведена на рис. 2.
Рис. 2. Общая формула исследуемых соединений
Культуры клеток человека RD (АТСС® CCL-136™) и НСТ116 (АТСС® CCL-247™) выращивали в среде DMEM (НПП ПанЭко) с добавлением 10 % эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2мM L-глутамина (НПП ПанЭко), 1 % гентамицина (ОАО Биохимик) в качестве антибиотика и инкубировали при 37 °C в атмосфере CO2 (5 %).
Клетки сеяли в 96-луночный планшет (CELLTREAT™) в количестве 1·104 клеток/200 мкл и культивировали при 37 °C в атмосфере CO2 (5 %). После 24 часов инкубации к культурам клеток были добавлены тестируемые соединения в различных концентрациях (100; 50; 25; 12,5; 6,25; 3,12 и 1,56 мкМ), и далее клетки культивировали в тех же условиях 48 часов. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все вещества растворяли в ДМСО (PANREAC QUÍMICA S.L.U), конечная концентрация ДМСО в лунке не превышала 1 % и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 1 %.
Определение цитотоксичности МТТ-тестом
Цитотоксичность синтезированных соединений была определена с помощью МТТ-теста [12]. После инкубации с соединениями в каждую лунку было добавлено 20 мкл MTT (бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) (5 мг/мл) (Sigma-Aldrich) и планшеты дополнительно инкубировали в течение 2 часов. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм за вычетом измеренного фонового поглощения при 620 нм.
Определение цитотоксичности с помощью ресазурина
Цитотоксичность синтезированных соединений была определена по тесту Alamar Blue [16]. После инкубации с соединениями в каждую лунку было добавлено 22 мкл ресазурина (7-гидрокси-3Н-феноксазин-3-он-10-оксида натриевой соли) (Sigma-Aldrich) с конечной концентрацией 50 мкМ. Планшеты инкубировали в течение 2 часов. Флуоресценцию восстановленного красителя определяли с помощью планшетного ридера (Victor3, PerkinElmer) (возбуждение при 530 нм, эмиссия при 590 нм).
Значение концентрации, вызывающее 50 %-е ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0.
Результаты исследования и их обсуждение
Цитотоксический эффект сесквитерпеновых лактонов, определенный МТТ-тестом и с помощью ресазурина, по отношению к двум опухолевым линиям клеток человека имеет выраженный дозозависимый характер, индивидуальный для каждого соединения (рис. 3 и 4).
Источник
Определение цитотоксичности лекарственных препаратов
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064
Исследование общей цитотоксичности антибиотиков аминогликозидного и фторхинолонового ряда на клеточных культурах
Журнал: Вестник офтальмологии. 2015;131(5): 43-53
Александрова О. И., Хорольская Ю. И., Майчук Д. Ю., Блинова М. И. Исследование общей цитотоксичности антибиотиков аминогликозидного и фторхинолонового ряда на клеточных культурах. Вестник офтальмологии. 2015;131(5):43-53. https://doi.org/10.17116/oftalma2015131543-53
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064


Цель — определить общую цитотоксичность аминогликозидов (нетилмицина и тобрамицина) и фторхинолона (ципрофлоксацина). Материал и методы. Были использованы 3 типа клеток: клетки постоянной трансформированной клеточной линии СНО-К1, нормальные фибробласты кожи человека и клетки нормальной конъюнктивы человека Clone 1-5С-4. Действие антибиотиков выявляли по их влиянию на жизнеспособность клеток. Для определения жизнеспособности использовали количественные и качественные методы оценки. Количественная оценка — метод клонирования клеток и колориметрический метод оценки их пролиферации; качественная оценка — прижизненное визуальное наблюдение под инвертированным микроскопом за морфологическим состоянием клеток в процессе культивирования с фотофиксацией. Результаты. Наибольший токсический эффект для всех типов клеток, исследованных в данной работе, проявил тобрамицин. Наименее токсичным и наиболее близким к контролю по степени токсичности для всех типов клеток оказался нетилмицин. Заключение. Протестированные антибиотики оказывают цитостатический эффект в условиях in vitro и отличаются по своему цитотоксическому потенциалу.
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России
ФГБУН «Институт цитологии» РАН, Тихорецкий просп., 4, Санкт-Петербург, Российская Федерация, 194064
Сохранение тонкой структуры и физиологической функции роговицы является одной из важнейших задач современной клинической офтальмологии. Роговица обеспечивает ¾ преломляющей мощности рефракционного аппарата глаза [1], а совершенная цитоархитектоника клеточных слоев, выстилающих роговицу, и кератоцитов, населяющих ее строму, позволяет обеспечить ее структуре более чем 99% прозрачности [2, 3]. Дифференцированные клетки внешнего слоя эпителия роговицы ежедневно слущиваются (в ходе естественного процесса десквамации), уступая место новым, образующимся из пролиферирующих клеток базального слоя, которые, в свою очередь, являются производными клеток-предшественников (прогениторов) и их более дифференцированного производного — транзиторных амплифицирующих клеток (ТАК). Основным источником репопуляции пула клеток-предшественников эпителия роговицы являются лимбальные эпителиальные стволовые клетки (ЛЭСК), тесно ассоциированные с палисадами Фогта и населяющими их стромальными клетками [4, 5]. Именно микроокружение палисада лимба поддерживает стволовые клетки в недифференцированном, «спящем» состоянии до их активации внешними молекулярными сигналами [6]. После активации скорость центрипетальной миграции (в направлении от лимба к центру роговицы) клеток — производных ЛЭСК у человека составляет около 28 мкм в день [7], что позволяет восстанавливать эпителий роговицы, поврежденный внешним воздействием, в сроки от 1 до 4 сут. В процессе миграции ЛЭСК претерпевают ряд изменений, пролиферируя сначала в клетки-прогениторы, а затем в ТАК. В случае массивной травмы лимба (повреждение более чем 70—75% его окружности) источник ЛЭСК резко оскудевает и основной вклад в регенерацию эпителиального слоя роговицы, по-видимому, вносит пул персистирующих в базальном слое роговичного эпителия ТАК [4, 8, 9]. Потенциал этого остаточного резерва невысок, что приводит к нарушению процесса эпителизации роговицы, изменению ее прозрачности и результирующей инвалидизации.
Таким образом, сохранение и поддержание регенераторного потенциала клеток роговицы глаза как при ее ятрогенной травме (фоторефракционной кератэктомии, лазерной коррекции зрения, шунтирующих операциях), так и при оперативных вмешательствах, выполняемых вследствие осложненных кератитов или повреждений роговицы иной этиологии (пенетрирующей, ламеллярной или эндотелиальной кератопластике), является первостепенной задачей офтальмолога и офтальмохирурга [10].
Любое хирургическое вмешательство сопровождается реактивным воспалением [11]. Если воспаление приобретает инфекционный характер, оно может привести к серьезным последствиям, вплоть до гибели глаза. В современной офтальмохирургии одной из основных причин, оказывающих серьезное неблагоприятное влияние на исход операции и течение послеоперационного периода, является именно внутриглазная инфекция. Поэтому использование топикальных антибактериальных препаратов (АБП) в современной клинической офтальмологии является неотъемлемым компонентом лекарственной терапии, как патогенетической, так и профилактической. Назначение АБП в профилактических целях в неосложненном послеоперационном периоде в рефракционной офтальмохирургии стало рутинной практикой. При этом существующие данные в отношении эффективности этой практики противоречивы, что делает подход к выбору средства профилактики четко дифференцированным: с учетом факторов риска развития инфекционных осложнений у пациента и свойств используемого агента [12—13].
Наиболее широкое распространение в клинической офтальмологии получили антибиотики аминогликозидной и фторхинолоновой групп, так как они обладают высокой безопасностью и эффективностью в отношении широкого спектра грамположительных и грамотрицательных бактериальных возбудителей офтальмоинфекций.
Спектр показаний к профилактическому и терапевтическому назначению топикальных АБП в офтальмологии не ограничивается перечисленными выше, что значительно расширяет круг пациентов, получающих эти препараты, и актуализирует проблему выбора, который должен основываться не только на спектре активности антибиотика, но и на профиле безопасности его применения.
В офтальмологии вопрос безопасности лекарственного средства требует особого внимания, так как локальное применение препаратов в конъюнктивальную полость, безусловно, будет воздействовать на эпителий конъюнктивы и роговицы, оказывая влияние на скорость репарации тканей [15].
Цитотоксичность АБП — широко известный факт, основанный как на доклинических, так и на клинических данных [16—18]. Клинически данное свойство может проявляться в замедлении скорости эпителизации дефекта роговицы [19], отеке роговицы [20], а также в образовании преципитатов в ее строме, что неоднократно наблюдалось при лечении кератитов и инфицированных язв роговицы [21—26]. Следует отметить, что цитотоксичность, безусловно, носит дозозависимый характер [27] и зачастую является продукт-специфичной, а большинство публикаций, описывающих негативный опыт применения АБП, относится к представителям фторхинолоновой группы антибиотиков I и II поколений — офлоксацину и ципрофлоксацину [28, 29]. По мере накопления клинического опыта применения АБП и появления новых технологий, используемых как для поиска новых молекул-кандидатов, так и для их тестирования, появляются антибиотики следующих поколений, обладающие улучшенной безопасностью и повышенной эффективностью. С момента появления фторхинолонов IV поколения систематизированных данных о клинических проявлениях их цитотоксичности не публиковалось, что косвенно свидетельствует об улучшенном профиле их безопасности [30, 31], тем не менее все еще встречаются единичные клинические случаи, описывающие такие серьезные побочные эффекты, как отек роговицы [32]. При этом акцент озабоченности перенесен на безопасность средств доставки новых молекул, которые также могут вызывать серьезные побочные эффекты, как это было продемонстрировано в случае с биоадгезивной платформой пролонгированной доставки DuraSite, импрегнированной безифлоксацином или азитромицином, в исследовании бесшовного закрытия постоперационных дефектов роговицы [33]. В отношении аминогликозидных антибиотиков, в частности препаратов III поколения, на сегодняшний день не имеется клинических данных по цитотоксичности.
Оценка цитотоксичности антибиотиков является немаловажным аспектом. В последние годы в научной литературе появились публикации, в которых представлены данные об оценке цитотоксичности, полученные в экспериментальных исследованиях in vitro с использованием клеточных культур. Анализ научных публикаций, в которых приводятся сравнительные данные по оценке токсического воздействия офтальмологических антибиотиков на различные клеточные структуры глаза, показал, что в настоящее время единого мнения по данному вопросу нет [34].
Исследования на клеточных культурах позволяют проводить количественную оценку цитотоксичности АБП и имеют практическое значение при выборе и обосновании применения лекарственных препаратов.
Цель данного исследования — сравнить общее цитотоксическое действие на клеточные культуры аминогликозидного антибиотика III поколения — нетилмицина, II поколения — тобрамицина и фторхинолонового антибиотика II поколения — ципрофлоксацина.
Источник