Контрактное производство
Косметических средств, БАД к пище, фасовка пищевой продукции.
- Вы здесь:
- Возможности
- Качество
- Методики и тесты
- Методы определения подлинности
Методы определения подлинности
Огромное количество лекарственных средств, наводнивших российский фармакологический рынок и рынок БАД, заставляет покупателей с большим подозрением относиться к предмету своего приобретения. Одна из главных задач фармакопейных испытаний на подлинность, является подтверждение с помощью химических реакций, физико-химических испытаний идентичности исследуемого вещества предполагаемому соединению, которое входит в состав заявленного лекарственного средства или биологически активных добавок (БАД) и обозначенного на его этикетке.
В состав всевозможных форм БАД, выпускаемых предприятием ООО «КоролевФарм», входят различные виды сырья: экстракты, витамины, неорганические соединения, растительное сырье. При входном контроле главным показателем качества является определение подлинности сырья.
Для этого в Аналитической лаборатории на участке физико-химических испытаний применяют анализ, представляющий собой совокупность различных методов исследований сырья, изложенных в Государственной фармакопее или другой НД.
Для испытаний на подлинность различных веществ используются общегрупповые реакции совместно со специфичными реакциями, избирательными для определенного вида соединений. Они основаны на установлении физических свойств или измерении физических констант анализируемого вещества.
Подлинность подтверждают, исследуя агрегатное состояние: твердое вещество, газообразное или жидкое.
Определяют окраску, запах, форму кристаллов, гигроскопичность или степень испаряемости на воздухе, устойчивость к воздействию кислорода воздуха и света, степень летучести, подвижности или воспламеняемости.
В основе определения подлинности веществ заложены определенные виды химических реакций: окислительно-восстановительные, осаждения, комплексообразования, этерификации, гидролиза, конденсации, пирохимические и другие.
Подлинность устанавливают химическими методами: идентификацией неорганических веществ (различные реакции на катионы и анионы), идентификацией органических веществ, посредством воздействия на функциональные группы.
Установление подлинности физическими методами: описание физических свойства веществ, определение констант, таких как температура плавления или затвердевания, температура кипения, растворимость, плотность, вязкость.
К физико-химическими методами определения подлинность относят такие методы, как рефрактометрия (определение показателя рефракции), поляриметрия (определение удельного вращения), УФ-спектрофотометрия (анализ спектра вещества, определение удельного и молярного показателя поглощения), ИК-спектроскопия (получение ИК-спектра вещества), потенциометрия (измерение величины рH), тонкослойная хроматография и на бумаге (определение величины Rf).
Для растительного сырья определение подлинности представляет собой комплекс методов исследований растительных форм, представленных в Государственной фармакопее ХI издания или другой НТД (ФС, ФСП, ГОСТ)
Для цельного ЛРС подлинность устанавливают на основании макроскопического анализа, а для резаного, измельченного и порошкового проводят микроскопический анализ.
Макроскопический анализ сырья проводят по статьям ГФ и другим НД.По этим методикам определяют:
внешние признаки: определение типа и формы сырья, строение поверхности исследуют визуально или с помощью лупы с десятикратным увеличением;
цвет: определение проводят используя дневное освещение с поверхности, а для сухого сырья на изломе;
запах: определяют органолептическим методом, растирая сырье руками или в ступке, делая соскоб ножом, некоторое сырье заливают кипятком для усиления запаха;
вкус: распознают очень осторожно, не проглатывая (сырье может быть ядовитое и пробовать его запрещено). Вкус трав, цветов, листьев лучше всего определяется в приготовленном отваре;
размеры (диаметр, длина, ширина): определяют миллиметровой линейкой, проводя несколько измерений, среднее арифметическое этих замеров составляет величину объекта. Размеры мелкие семян, плодов вычисляют путем наложения на миллиметровую бумагу, а округлых семян — просеиванием через сита с определенными размерами отверстий.
При исследовании сырье раскладывают на поверхности, осматривают и сравнивают с подлинным образцом.
Для разнообразных групп сырья используют разные методы исследования.
Листья (Folia). Представляют собой сухие цельные листья или части. Тонкие сморщенные листья в сырье предварительно размачивают путем погружения на несколько минут в кипяток. При помощи иглы и пинцета расправляют их так, чтобы определялись форма листа, край, жилки и черешок. Кожистые листья и мелкие размачивать не надо. Поверхность листа рассматривают с обеих сторон.
 |
| Рис.1 Строение цветка |
Цветки (Flores). Это отдельные сухие цветки, соцветия или части их. Для определения подлинности такого сырья достаточно рассмотреть внешние признаки визуально, а если необходимо, под микроскопом. Запах, цвет и размеры устанавливают на сухом сырье. Строение цветка изучают, размочив его в горячей воде и, работая двумя иглами, разделяют под лупой, внимательно рассматривая части цветка (рис.1)
Трава (Негbа). Представляет собой высушенные части растений, включающие листья и стебли, на которых могут быть цветки и плоды разной зрелости.
В сухих травах определяют запах и цвет, размер стебля, диаметр цветка или целого соцветия. В размоченных травах смотрят форму листа, как он прикрепляется к стеблю, делают описание формы стебля, рассматривают строение цветка, определяют тип соцветия и плода.
Плоды (Fructus). Бывают истинные и ложные плоды, сборные или сложные, соплодия и их части, собранные после полного вызревания. Форму плодов, поверхность кожуры устанавливают на сухом сырье визуально или под лупой с десятикратным увеличением. Размер мелких плодов определяют, раскладывая их на миллиметровой бумаге.
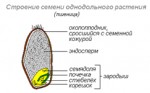 |
| Рис. 2 Строение семени однодольного растения |
Семена (Semina). Семена бывают цельные или отдельные семядоли. Собирают их в период созревания. Семена цельные легко определяют по внешнему виду визуально или под лупой. Нераспознаваемые семена исследуют под микроскопом. Для установления подлинности исследуют форму и поверхность семян. Она может быть гладкой, бугристой или с ячейками, голой или слегка опушенной. Внутри семян располагается зародыш, кожура и содержащийся запас питательных веществ (рис.2) .
Цвет и запах семян устанавливают при растирании или делая соскоб. Размеры семян определяют на миллиметровой бумаге, раскладывая их в ряд, а шарообразные просеивают через сито с ячейками требуемого размера.
Кора (Cortex). Представляет собой наружную часть ветвей, стволов и корней деревьев или кустарников. Подлинность коры по одному только внешнему виду бывает определить очень сложно, поэтому для идентификации применяют микроскопическое исследование. Кора может представлять собой вид трубчатых или плоских кусков, неровных обрезков. Снаружи она может быть гладкой или с поперечными или продолговатыми трещинами. Внутренняя сторона всегда более светлая и ровная. При поперечном надломе край может быть неровный, щетинистый или зернистый и может быть занозистым. На это влияет толщина волокон и наличие каменистых клеток. При определении измеряют максимальный размер толщины коры и ее длину с помощью миллиметровой линейки. С каждой стороны определяют цвет. Вкус устанавливают на сухом сырье, а запах легче уловить, увлажнив его или сделав соскоб.
 |
| Рис 3. Проведение микроскопического анализа |
Корни, корневища (Radices, Rhizomata). Это высушенные, очищенные, отмытые подземные части многолетних травянистых растений, Их подлинность устанавливают по внешним признакам в натуральном виде или применяя лупу с десятикратным увеличением. Рассматривают форму и характер поверхности корней, определяют цвет, сделав надлом. С помощью микроскопического анализа определяют подлинность измельченного, резаного, порошкообразного, дробленого, прессованного в брикеты и гранулы растительного сырья. Метод основывается на знании анатомии структуры определенных видов растений. Изучая строение различных органов и тканей и, зная их характерные диагностические признаки, можно легко определить подлинность того или иного вида сырья.
Изучаемую часть помещают в каплю жидкости на предметном стекле. Накрывают покровным стеклом и рассматривают под микроскопом сначала при малом увеличении, а для более детального анализа — при большом увеличении.
Чаще всего для установления подлинности ЛРС проводят качественные реакции или хроматографические пробы на основное вещество, содержащееся в образце или ему сопутствующие. Эти методики представлены в НД на определенные виды сырья в разделе «Качественные реакции».
Для проведения таких реакций из исследуемого сырья готовят водно-спиртовые или водные экстракты, а затем к полученному извлечению добавляют требуемый реактив. По полученной реакции делают вывод о содержании того или иного вещества в анализируемой пробе. Наличие или отсутствие в пробе вещества подтверждает подлинность сырья.
Таким образом, определив подлинность сырья, поступившего в лабораторию для анализа, инженер – химик выдает протокол о соответствии его требованиям НД и передает его в отдел контроля качества. Не прошедшее испытание на подлинность сырье бракуется и в производство не допускается.
Источник
Общие методы анализа качества лекарственных средств
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Глава 1. Общие методы и приемы анализа качества лекарственных средств
Все химические вещества, применяемые как лекарственные средства (ЛС), должны отвечать требованиям Государственной фармакопеи (ГФ) по внешнему виду (раздел «Описание»), растворимости (раздел «Растворимость»), химическому составу (раздел «Испытания на подлинность»), чистоте (раздел «Испытания на чистоту»), а также по таким показателям качества, как величина pH, удельный показатель поглощения, удельное вращение, температура плавления и др. Количественное содержание действующего вещества (нескольких веществ) должно находиться в пределах, указанных в разделе «Количественное определение».
I. Определение подлинности лекарственных средств
Для установления подлинности ЛС в ГФ используется комплекс испытаний: характеристика внешнего вида, растворимость, температура плавления, температурные пределы перегонки, удельное вращение или угол вращения, значение величины pH, удельный показатель поглощения и другие показатели в ультрафиолетовой (УФ) или видимой области спектра, химические реакции на катионы, анионы или функциональные группы и др.
В настоящее время с целью совершенствования способов идентификации вводятся современные физические и физико-химические методы— такие, как инфракрасная (ИК)-спектроскопия, спектроскопия ядерно-магнитного (ЯМР) и протонного магнитного резонанса. Применение этих методов требует использования стандартных образцов лекарственных веществ.
Характеристика внешнего вида
В частной статье на каждое лекарственное вещество в разделе «Описание» в ГФ дается характеристика главным образом физических свойств (агрегатное состояние, цвет, запах). Указывается, является данное лекарственное вещество аморфным или кристаллическим порошком, характеризуются размеры кристаллов и их форма (игольчатые, кубические и др.). Иногда приводятся дополнительные сведения (тяжелый, рыхлый, легкий порошок и др.).
Агрегатное состояние лекарства имеет большое значение для характеристики его качества; известна взаимосвязь степени дисперсности кристаллов с химической и фармакологической активностью лекарственных веществ.
В зависимости от условий технологического процесса форма кристаллов одного и того же лекарственного вещества может быть различной.
Важным показателем подлинности и чистоты лекарственных веществ является их цвет. Цвет порошков определяется визуально; для объективной оценки цвета в настоящее время применяется метод отражательной спектрофотометрии, позволяющий использовать оптические свойства порошкообразных веществ.
В ГФ включена общая фармакопейная статья (ФС) «Определение степени белизны порошкообразных лекарственных средств». Степень белизны оценивается инструментальным методом на основе спектральной характеристики света, отраженного от образца лекарственного вещества. На специальных приборах измеряют коэффициент отражения (отношение величины отраженного к величине падающего на вещество светового потока).
Характеризуя цвет лекарственного вещества, ГФ иногда указывает на возможность его изменения. Так, резорцин описывается как белый или белый со слегка желтоватым оттенком порошок, который под влиянием света и воздуха постепенно приобретает розовый цвет. Таким образом, обращается внимание на нестабильность и возможность изменения химической структуры вещества под влиянием факторов окружающей среды, влекущих за собой изменение его внешнего вида. В данном случае изменение цвета является следствием легкого окисления двухатомного фенола.
Внешний вид лекарственных веществ может изменяться под влиянием различных факторов окружающей среды (света, влаги, пониженной и повышенной температуры, кислорода, воздействие диоксида углерода и других газов, сухого воздуха, пыли), что выражается в увлажнении, изменении цвета, выпадении осадков из растворов и др. При этом могут проходить химические реакции различных типов (окисление, восстановление, осаждение, гидролиз).
В связи с этим в разделе «Описание» указывается на возможность изменения лекарственных веществ при хранении. Так, отмечается, что натрия йодид на воздухе сыреет и разлагается с выделением йода. Некоторые кристаллогидраты (меди сульфат, натрия тетраборат-, магния сульфат и др.) выветриваются на воздухе (теряют часть кристаллизационной воды), что обусловливает появление белых вкраплений наряду с бесцветными (натрия тетраборат, магния сульфат) и синими (меди сульфат) кристаллами.
Выветривание кристаллизационной воды может привести к нарушению дозировки (увеличению количества основного вещества в навеске) ЛС, в том числе сильнодействующих и ядовитых.
Для правильного вывода о соответствии внешнего вида лекарственного вещества требованиям Г’Ф важно уметь связать изменения внешнего вида с химическими, которые могут произойти под влиянием факторов окружающей среды. Провизор должен обеспечить правильное хранение ЛС, для каждого из которых установлены режим (в прохладном или темном месте и др.) и сроки хранения.
Растворимость
Для обозначения растворимости лекарственных веществ в ГФ приняты условные термины («очень легко растворим», «растворим», практически нерастворим» и др.), которые определяют соотношение объема растворителя к одной весовой части лекарственного вещества. Так, для сульфацил-натрия растворимость обозначается термином «легко растворим в воде», что означает растворимость 1 г лекарственного вещества в воде объемом от 1 до 10 мл.
Для характеристики растворимости некоторых лекарственных веществ ГФ приводит соотношения веществ и растворителя (например, для натрия хлорида: растворим в 3 частях воды).
ГФ характеризует растворимость ЛС, как правило, в воде, а также в ряде растворителей (чаще – в 95% спирте, хлороформе, эфире, реже – в кислотах и щелочах). Растворимость и в кислотах, и в щелочах характерна для таких амфотерных соединений, как цинка оксид, большинство сульфаниламидов, кислота глутаминовая, таким образом, этот показатель является одним из характерных для них.
Изменение растворимости лекарственного вещества указывает на присутствие или появление в процессе хранения менее растворимых примесей и, таким образом, характеризует изменение его качества. Так, в теофиллине, хорошо растворимом в растворе аммиака, примесь сопутствующих пуриновых алкалоидов можно обнаружить по неполному растворению ЛС в растворе аммиака, поскольку остальные пуриновые алкалоиды не растворяются в этом реактиве.
У некоторых лекарственных веществ растворимость изменяется под влиянием факторов окружающей среды. Например, растворы натриевых солей барбитуратов под действием углекислого газа выделяют осадок нерастворимой в воде кислотной формы.
Определение подлинности химическими реакциями
В нормативных документах (НД) приводится сочетание групповых и специфических химических реакций для идентификации лекарственных веществ. Так, реакция диазотирования и образования азокрасителя является групповой на первичные ароматические амины и доказывает принадлежность лекарственного вещества к этом группе. Хроматическую аминогруппу содержат сульфаниламиды, производные п-аминобензойной, п-аминосалициловой кислот и др. Групповой является мурексидная реакция на пуриновые алкалоиды, идентификацию же отдельных алкалоидов этой группы проводят с помощью специфических реакций. Сочетание групповых и специфических реакций, характерных для каждого ЛС, наряду с учетом всех физических и химических свойств позволяет надежно идентифицировать ЛС.
Большое количество лекарственных веществ содержат один и тот же ион или одну и ту же функциональную группу. Эго позволило создать унифицированные методики для их идентификации с помощью химических реакций на ионы или функциональные группы и объединить в ФС «Общие реакции на подлинность».
Амины ароматические первичные. Для лекарственных веществ, содержащих первичную ароматическую аминогруппу, характерна реакция диазотирования и азосочетания, в результате которой образуется азокраситель (химизм и методики – см. тему II).
Аммонии. При нагревании растворов солей аммония с растворами щелочей выделяется аммиак, который может быть обнаружен по характерному запаху и посинению влажной красной лакмусовой бумаги:
Ацетаты. Ацетаты определяют по реакции образования сложного эфира – этилацетата, имеющего характерный запах свежих яблок:
В условиях проведения реакции обнаруживаются ацетат-ион и ацетильный радикал в органических соединениях.
Другое испытание на ацетат-ион, включенное в ГФ, — взаимодействие с железа (III) хлоридом. При добавлении к нейтральному раствору, содержащему ацетат-ион, раствора железа (III) хлорида появляется красно-бурое окрашивание из-за образования железа (III) ацетата или гидроксиацетата (последний образуется на 1-й ступени гидролиза средней соли):
При кипячении полученного раствора выпадает хлопьевидный осадок из-за углубления гидролиза, на 2-й ступени становящегося необратимым:
Бензоаты. Нейтральные растворы бензоатов с железа (III) хлоридом образуют осадок розовато-желтого цвета, растворимый в эфире:
Полученное окрашенное соединение разрушается при действии растворов кислот и щелочей.
Бромиды. Бромиды идентифицируют по реакции выделения брома в результате окислительно-восстановительной реакции между бромидом и хлорамином в кислой среде. Выделяющийся в результате реакции молекулярный бром извлекают хлороформом. Хлороформный слой окрашивается при этом в желто-бурый цвет:
Растворы бромидов с раствором серебра нитрата образуют желтоватый творожистый осадок серебра нитрата, нерастворимый в кислоте азотной и трудно растворимый в растворе аммиака (химизм
Висмут. Растворы солей висмута, подкисленные кислотой хлороводородном, образуют коричневато-черный осадок с сульфидами (химизм – см. тему 4).
Железо (11). Растворы солей железа (II) с гексацианоферрат(Ш)- ионом образуют синий осадок гекеацианоферрата (III) железа (II), возможно также образование
Осадок нерастворим в минеральных кислотах; разрушается при действии щелочей с образованием железа (II) гидроксида (химизм — см. тему 4).
Железо (1Н). Растворы солей железа (Ш)образуют с раствором гекеацианоферрата (II) калия синий осадок берлинской лазури:
При реакции с тиоцианатами растворы солей железа (III) образуются продукты красного цвета:
С растворимыми сульфидами в нейтральной или слабощелочной среде соли железа (III) дают черный осадок:
Осадок железа (III) сульфида растворяется в минеральных кислотах.
Йодиды. Йодиды являются выраженными восстановителями, поэтому слабые окислители выделяют молекулярный йод из йодидов. Йод окрашивает крахмал в синий цвет; раствор йода в хлороформе окрашен в фиолетовый цвет.
Сильные окислители переводят йодиды в бесцветные гипойоди- ты (IO) или йодаты (IO3-), поэтому выбор окислителя и его концентрация имеют большое значение, ГФ рекомендует использовать для окисления йодидов растворы железа (III) хлорида или натрия нитрита:
В качестве окислителя ГФ предлагает также применять кислоту серную концентрированную, при действии которой на йодиды яри нагревании выделяются фиолетовые пары йода.
С раствором серебра нитрата в присутствии кислоты азотной йодиды образуют желтый творожистый осадок, нерастворимый в избытке аммиака:
Калий. Соли калия с раствором кислоты виннокаменной образуют белый кристаллический осадок кислой соли:
Осадок нерастворим в кислоте уксусной. К реакционной смеси добавляют натрия ацетат:
Образованию осадка способствуют добавление 95% спирта и встряхивание пробирки.
Осадок растворим в минеральных кислотах и растворах едких щелочей.
С раствором гексанитрокобальтата (III) натрия соли калия образуют желтый кристаллический осадок гексанитрокобальтата (III) калия, натрия, нерастворимый в кислоте уксусной, растворимый в минеральных кислотах:
В сильнокислой среде образуется нестойкая кислота гексанитрокобальтовая разлагающаяся в момент выделения. В щелочной среде образуется бурый осадок
Поскольку с данным реактивом образуют осадок и ионы аммония, соль калия предварительно (перед проведением реакции) прокаливают для удаления солей аммония.
Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет, а при рассматривании через синее стекло пламя приобретает пурпурно-красный цвет.
Кальций. Растворы солей кальция с оксалат-ионом образуют белый осадок, нерастворимый в кислоте уксусной, растворимый в разведенных минеральных кислотах:
Соль кальция, смоченная кислотой хлороводородной, окрашивает бесцветное пламя горелки в кирпично-красный цвет.
Карбонаты и гидрокарбонаты. При действии на карбонаты и гидрокарбонаты разведенных кислот появляются пузырьки диоксида углерода вследствие разложения выделяющейся нестойкой кислоты угольной:
При пропускании выделяющегося диоксида углерода через известковую воду образуется осадок кальция карбоната:
Отличить карбонаты от гидрокарбонатов можно по реакции среды с использованием индикатора — фенолфталеина. Карбонаты и гидрокарбонаты в растворе подвергаются гидролизу:
Карбонаты имеют сильно щелочную реакцию среды, в отличие от гидрокарбонатов, в которых происходит, помимо гидролиза, и диссоциация НСО3-иона:
В связи с этим реакция среды растворов гидрокарбонатов становится слабощелочной.
Таким образом, растворы карбонатов окрашивают фенолфталеин в розовый цвет, а растворы гидрокарбонатов не окрашивают его.
С насыщенным раствором магния сульфата растворы карбонатов образуют белый осадок:
Растворы гидрокарбонатов образуют такой же осадок, но при кипячении смеси (из-за перехода гидрокарбоната в карбонат):
Магний. Соли магния образуют е раствором натрия фосфата в присутствии аммония хлорида белый кристаллический осадок магний-аммоний фосфата, растворимый в кислоте уксусной:
Для предупреждения образования осадка магния гидроксида к реакционной смеси добавляют аммония хлорид, избытка которого, однако, следует избегать вследствие образования растворимых комплексных ионов [МgCl3] – , [МgCl4] 2-
Мышьяк. Мышьяк в ЛС присутствует в виде соединений, в которых его степень окисления равна +3 и +5, поэтому в ГФ приводятся реакции на арсениты (AsO3 3- ) и арсенаты (AsO4 3- ).
В среде кислоты хлороводородной арсениты и арсенаты образуют желтые осадки с сульфид-ионом, нерастворимые в концентрированной кислоте хлороводородной, но образующие растворимые комплексы с раствором аммиака:
С раствором серебра нитрата арсениты образуют желтый осадок серебра арсенита, растворимый как в кислоте азотной, так и в растворе аммиака;
Арсенаты с раствором серебра нитрата образуют коричневый осадок серебра арсената Аg3АgО4, также растворимый в кислоте азотной и растворе аммиака с образованием в последнем случае комплекса | Ag(NH3)2 |AsО4.
С ионами магния и аммония в присутствии аммония хлорида арсенаты образуют белый кристаллический осадок, растворимый в разведенной кислоте хлороводородной. Эта реакция позволяет отличить арсенаты от арсенитов:
Натрий. Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет. Соли натрия образуют желтый кристаллический осадок с цинка уранилацетатом. Осадок нерастворим в кислоте уксусной:
Нитраты. Обшей реакцией на нитраты и нитриты является реакция с дифениламином, основанная на окислении этого реактива (в присутствии нитратов или нитритов) в среде концентрированной кислоты серной до дифенилдифенохинондиимина гидросульфата, окрашенного в синий цвет. Раствор дифениламина готовится на концентрированной Н2SО4:
Нитраты можно открыть, используя реакцию с концентрированной H2SO4 и металлической медью по выделению бурых паров азота диоксида:
В отличие от нитритов, обладающих еще и восстановительными свойствами, нитраты не обесцвечивают раствор калия перманганата.
Нитриты. Нитриты, как и нитраты, можно идентифицировать с помощью дифениламина в присутствии кислоты серной концентрированной (см. Нитраты).
Нитриты являются солями неустойчивой кислоты азотистой. При выделении последней из ее солей она разлагается с выделением характерных газообразных продуктов:
Нитриты при реакции с антипирином в кислой среде образуют продукт замещения – нитрозоантипирин зеленого цвета (химизм – см. тему 12).
В отличие от нитратов, нитриты обесцвечивают раствор калия перманганата:
Ртуть (II). При действии щелочей на водные растворы солей ртути (II) образуется желтый осадок ртути оксида (II):
Ион Hg 2+ способен образовывать комплексные соли. При действии калия йодида на раствор ртути (II) хлорида образуется красный осадок ртути (II) йодида, растворимый в избытке реактива с образованием бесцветного раствора калия тетрайодидмеркурата:
Соли ртути (II) осаждаются сульфид-ионом из водных растворов в виде осадка черного цвета, нерастворимого в кислоте азотной:
Салицилаты. Салицилаты, обладающие кислотными свойствами, обусловленными наличием карбоксильной группы и фенольного гидроксила, образуют с железа (III) хлоридом в нейтральной среде соли, окрашенные в красно-фиолетовый или сине-фиолетовый цвет. Состав и соответственно цвет соли зависят от соотношения количества реактива и салицилат-иона (различная степень кислотности карбоксила и фенольного гидроксила). Минеральные кислоты вытесняют кислоту’ салициловую из солей с ионом железа (III), окраска исчезает, выпадает белый осадок кислоты салициловой (химизм — см. тему 6).
Сульфаты, Сульфаты с растворимыми солями бария дают белый осадок, нерастворимый в кислотах и щелочах:
Сульфиты. Кислота сернистая, являясь неустойчивой, при разложении выделяет сернистый газ, имеющий резкий характерный запах. Это свойство кислоты сернистой используется для обнаружения ее солей – сульфитов, из которых кислоту вытесняют разведенной кислотой хлороводородной:
С ионами бария сульфиты образуют белый осадок, который, в отличие от сульфата бария, растворим в разведенной кислоте хлороводородной:
Сульфиты, являясь восстановителями, обесцвечивают растворы брома и йода:
Тартраты. Тартраты с солями калия образуют белый кристаллический осадок (см. Калий).
При нагревании тартратов с концентрированной Н2SО4 и резорцином появляется вишнево-красное окрашивание вследствие образования легко окисляющегося продукта конденсации резорцина с карбонильным производным, получающимся в результате взаимодействия тартрата с концентрированной Н2SО4.
Фосфаты. Фосфат-ион осаждается из растворов серебра нитратом с образованием желтого осадка, растворимого в кислоте азотной и растворе аммиака:
Магнезиальная смесь осаждает из растворов фосфат-ион в виде осадка магний-аммоний фосфата (см. Магний).
Растворы фосфатов в разведенной кислоте азотной при взаимодействии с аммония молибдатом при нагревании окрашиваются в желтый цвет, затем образуется желтый кристаллический осадок аммония фосфомолибдата:
Хлориды. Растворы хлоридов с серебра нитратом образуют белый творожистый осадок, растворимый в аммиаке, аммония карбонате и нерастворимый в кислоте азотной:
Для солей органических оснований испытание растворимости образовавшегося осадка серебра хлорида проводят после отделения осадка и промывания его водой.
Цинк. Растворы солей цинка образуют с сульфид-ионом осадок цинка сульфида белого цвета, легко растворимый в разведенной кислоте хлороводородной и нерастворимый в кислоте уксусной:
С гексацианоферрат (П)-ионом соли цинка образуют белый студенистый осадок гексацианоферрат (II) цинка, калия, нерастворимый в разведенной кислоте хлороводородной:
Цитраты. Цитрат-ион образует с ионом кальция соль, растворимую в воде при комнатной температуре и выпадающую в осадок при кипячении:
Осадок растворим в кислоте хлороводородной.
При нагревании цитратов с ангидридом уксусным появляется красное окрашивание.
Источник



















































