Опыт определения остатков лекарственных средств в молоке
1. 28-е решение коллегии ЕЭК (http://docs.cntd.ru/document/556522984) существенно расширяет перечень и определяет методики исследования на остатки лекарственных средств. Как вы оцениваете данное решение и есть ли сложности с его исполнением на молочном рынке ТС и РБ?
Принимая во внимание тот факт, что на сегодняшний день, за исключением 4-х нормируемых групп, остаточное количество вет.препаратов и антибиотиков в молоке не допускается вовсе, позиция установления МДУ (максимально допустимые уровни), безусловно, несёт положительные перемены для углубления и понимания механизма контроля молочной продукции. Посудите сами: ни один метод детекции, будь это качественный или количественный, не может обеспечить уровень определения «0». Установив допустимые нормы, система однозначно дисциплинирует переработчиков молочной отрасли и даёт чёткое понимание грамотного производственного контроля каждой партии поступающего сырья. Вопрос всегда стоял остро исключительно касательно технического обеспечения проверки такого количества вет. препаратов и антибиотиков, а необходимость такого ответственного подхода к безопасности выпускаемой продукции, не вызывала сомнений.
Возвращаясь к Решению Коллегии Евразийской экономической комиссии от 13.02.2018 № 28, содержащее Перечень ветеринарных лекарственных средств (фармакологически активных веществ), максимально допустимых уровней остатков которых могут содержаться в непереработанной пищевой продукции животного происхождения, в том числе в сырье и методики их определения (далее – Перечень), следует отметить, что Перечень содержит методики измерений антибиотиков высокотехнологичными физико-химическими методами (иммуноферментным методом и высокоэффективной жидкостной хроматографией). Подобные методики можно применить только в испытательных лабораториях высочайшего уровня из-за дороговизны оборудования, необходимых комплектующих и расходных материалов и сложности постановки методики, требующей высококвалифицированного оператора.
Однако технический прогресс не стоит на месте, активно развивается фармацевтический рынок ветеринарных препаратов, но и методы контроля стали мультикомплексными. Если рынок диагностических систем, уже на сегодняшний день предлагает решения для осуществления проверки сырья, согласно решению 28, то вопрос об осуществлении такого контроля и вовсе не должен подниматься. Здесь важно только, чтобы метод был быстрый, многокомпонентный, простой в исполнении и доступный – это позволит в кратчайший срок принять решение по поводу дальнейшей переработки сырья.
2. Расскажите, пожалуйста, как на Ваш взгляд, должны быть стандартизированы методики определения лекарственных средств в молоке и молочных продуктах?
Объективно стоит придерживаться сформировавшегося механизма стандартизации в рамках законодательства ЕАЭК. «Правила игры» в данном случае определяет Договор о Евразийском экономическом союзе, подписанный в Астане 29.05.2014г (далее –Договор).
Согласно Статье 53 п.1 настоящего Договора «Продукция, выпускаемая в обращение на территории Союза, должна быть безопасной». При проведении испытаний для оценки безопасности продукции и соответствия требованиям технических регламентов Таможенного союза необходимо руководствоваться Приложением 9 к настоящему Договору. Данное приложение определяет прежде всего само понятие терминов «безопасность» – отсутствие недопустимого риска, связанного с возможностью причинения вреда и (или) нанесения ущерба, и «риск» – сочетание вероятности причинения вреда и последствий этого вреда для жизни или здоровья человека, имущества, окружающей среды, жизни или здоровья животных и растений. Предлагаю при рассмотрении данного вопроса отталкиваться именно от этих понятий.
Задачи . – выпуск безопасной продукции и исключение неоправданных рисков, не так ли? Возможно ли реализация данных задач без четкого механизма стандартизации? Нет!
Вернемся к Приложению 9 Договора и рассмотрим п.4, который гласит следующее: « В целях выполнения требований технического регламента Союза Комиссия утверждает перечень международных и региональных (межгосударственных) стандартов, а в случае их отсутствия – национальных (государственных) стандартов, в результате применения которых на добровольной основе обеспечивается соблюдение требований технического регламента Союза.
Применение на добровольной основе соответствующих стандартов, включенных в указанный перечень, является достаточным условием соблюдения требований соответствующего технического регламента Союза».
По нашему мнению, данные требования являются ключевыми в обеспечении выпуска безопасной продукции, исключающие всевозможные риски, связанные с причинением вреда и последствий этого вреда для жизни или здоровья человека прежде всего.
Разработка и принятие указанных перечней стандартов осуществляются в порядке, утверждаемом Комиссией.
Если же говорить о разработке новых стандартов, то основополагающим требованием является предоставление методик исследований (испытаний) и измерений, аттестованных (валидированных) и утвержденных в соответствии с законодательством государства-члена, в Комиссию ЕЭК. Прерогатива предоставления данных методик в комиссию принадлежит уполномоченными органами государств-членов. И никакой самодеятельности, Господа – «правила игры» определены!
3. Недавно компания Данон предложила создать единый ГОСТ определения антибиотиков: https://www.dairynews.ru/news/danone-predlozhila-sozdat-edinyy-gost-kontrolya-an.html?sphrase_id=5602029 Считаем , что невозможно и нецелесообразно объединять разные методы, с разным оборудованием и критериями определения в один стандарт. Это невозможно сделать и в силу существующих требований стандартизации.
По своей сути, это предложение подразумевает под собой определённые рамки, в которые загоняются переработчики. И вместо того, чтобы давать дорогу и заняться технической стороной и разработкой законодательной документации для инновационных комплексных диагностических методов, необходимость применения которых как никогда актуальна, эта инициатива влечёт за собой возврат к прошлым, уже широко применяемым и апробированным методам, которые вплоть до сегодняшнего дня не вызывали вопросов в сфере применения.
Как вы оцениваете данную инициативу? Инициатива должна быть разумной.
4. Какими качествами на ваш взгляд, должны обладать экспресс-тесты для молока?
Какие особенности данного сектора вы можете отметить?
Метод с использованием Экспресс-тестов должен обеспечивать надежность и достоверность получаемых результатов и, что немаловажно – постоянство, несмотря на далеко не количественные характеристики данного метода. Я бы даже сказала, что как раз-таки в силу того, что метод является «качественным», к нему и должны предъявляться жесткие требования в отношении выше указанных характеристик. Разберемся, объективно ли данное суждение и на чем оно основано.
В основе термина «постоянство» прежде всего лежат такие важные технические характеристики экспресс-метода, как повторяемость и воспроизводимость полученных результатов. Представьте, Переработчик молочной отрасли изо дня в день проводит рутинную процедуру исследования различного сырья одним и тем же экспресс-методом и вряд ли задумывается о том, что было бы, если провести контроль одного и того же сырья этим методом, скажем, хотя бы раз 10?! Будут ли полученные результаты всё так же стабильны и не будут ли они подвергнуты сомнению? Ответ однозначный: всё зависит от качества выбранного метода, от репутации предпочитаемого производителя метода, от используемых материалов и реагентов, а также от наличия подтверждающей доказательной базы. Или давайте рассмотрим следующую ситуацию: 10 поставщиков привезли на молокоперабатывающее предприятие своё молоко-сырьё. В одной пробе антибиотик есть наверняка, а вот 9 остальных – чистые. При входном контроле неГостированными тестами, у которых отсутствует стабильность в работе, партия заражённого молока будет пропущена к дальнейшей переработке. Последствия за дальнейшее развитие событий ложатся полностью на плечи Переработчика и, очевидно, наносят пятно на репутацию предприятия и отнимают доверие потребителей.
Предоставить экспресс-тест, который просто определяет отсутствие или наличие антибиотиков в молоке – задача простая; обеспечить стабильность и повторяемость результатов на протяжении длительного времени работы с тест-системами, как показывает положение на рынке и отзывы потребителей – задача трудоёмкая, достичь которую не удалось пока ни одному производителю неГостированных тест-систем. Как бы они не кичились и амбициозно не заявляли о своём превосходстве и «качестве», о своей современности и адаптированности, практика работы доказывает обратное. С этим же связано и отсутствие крепкой документальной базы у таких поставщиков, и полное игнорирование таких тестов со стороны разработчиков межгосударственных стандартов. Также для таких экспресс-тестов закрыты двери серьёзных амбициозных именитых институтов и лабораторий исследования молока стран ЕС, валидирующих исключительно качественные и надёжные методы контроля.
Сегодня на рынке экспресс-тестов бытует мнение, что, чем ниже чувствительность у тест-системы, тем лучше для Переработчика. Но это заблуждение! Произвести высокочувствительный тест не составляет труда, это делается исключительно потому, что таким образом производитель неГостированного метода пытается оправдать нестабильность работы теста и обезопасить себя. Так, например, если заявлять, чувствительность значительно ниже требований ТР ТС, то, во-первых, ни один количественный метод не сможет подтвердить или опровергнуть эти сведения, т.к. пределы детекции ВЭЖХ значительно выше, чем пределы обнаружения неГостированных тест-систем. Парадокс, не правда ли?! Заявлять чувствительность, которую никто не в состоянии проверить?! А, во-вторых, зачем тратить средства на закупку дорогостоящих антител и пытаться подбирать и проводить исследование необходимой чувствительности набора, если гораздо проще всё минимизировать. И никто не задумывается, насколько сложным и технически трудоёмким процессом является разработать тест с пределами обнаружения, исключительно отвечающими требованиям ТРТС (например, сделать пределы обнаружения по тетрациклину 8-10, а не 7 или 11), при этом учитывая факт того, что молоко-сырьё будет подвергнуто дальнейшей переработке и обеспечить стабильность, и доказать работоспособность метода не на словах, а на документах, выданных лучшими европейскими институтами, аккредитованными на валидацию скрининговых методов по контролю антибиотиков в молоке.
Хочется особенно отметить работу европейских лабораторий и их основательный подход к валидации экспресс-тестов для контроля антибиотиков в молоке. Это целый увлекательный квест, пройти который удостаиваются только избранные. Более 100 слепых проб контаминированного молока отправляется в десятки независимых акрредитованых, где проводятся испытания на работоспособность метода. И только в случае абсолютного совпадения результатов, выдаётся валидационный отчёт. Т.е. испытания проводятся в любом случае и сам протокол пишется, вне зависимости от полученных результатов, но итоговый отчёт получают лишь методы, подтвердившие свою работоспособность, включая такие показатели, как повторяемость, сходимость, заявляемые пределы обнаружения, перечень определяемых веществ с точностью 99,9%.
5. С какими проблемами сталкиваются предприятия-участники рынка на современном рынке продукции для выявления остатков лекарственных средств в молоке?
Наиболее остро проблема стоит именно для переработчиков, ведь на сегодняшний день именно переработчик отвечает за качество и безопасность конечного продукта. Сегодня поставщик сырья не несёт финансовую ответственность за бесконтрольное применение антибиотиков и ветеринарных препаратов и не предоставляют корректную информацию о применяемых ими лекарственных средствах для лечения продуктивных животных на молокоперерабатывающие предприятия. Эти действия вынуждают молочные заводы проверять Поставщика на весь имеющийся перечень, что, несомненно требует длительного времени и является финансово затратно.
В тоже время, если посмотреть на сложившуюся ситуацию со стороны законодательной базы, то переработчики сталкиваются со своего рода коллизией. Однозначная позиция наблюдается только по наличию допустимых МДУ (максимально допустимые уровни) у 4-х основных групп антибиотиков: бета-лактамы, тетрациклиновая группа, хлорамфеникол и стрептомицин. По остальным антибиотикам и вет.препаратам принято Решение Коллегии Евразийской экономической комиссии от 13.02.2018 № 28, которое тоже в свою очередь устанавливает МДУ, но оно идёт вразрез требований ТР ТС, где чётко прописано, что 4 вышеперечисленные группы допускаются и указано в каких пределах, а остальные все «0».
Источник
Терапевтический лекарственный мониторинг
Опубликовано в журнале:
Качественная клиническая практика »» 1 / 2002 А.В. Соколов
Кафедра клинической фармакологии с лабораторией фармакокинетики РГМУ, Москва
Одной из основных задач, стоящих перед клинической фармакокинетикой, является поддержание оптимальной концентрации лекарства в месте действия — оптимизации фармакотерапии. Особенно это касается препаратов, имеющих узкий терапевтический коридор (некоторых антибиотиков, антиаритмиков, циклоспоринов, антиконвульсантов и др.). Эта задача решается с помощью терапевтического лекарственного мониторинга (Therapeutic Drug Monitoring). Для целого ряда лекарственных препаратов назначение так называемых средних доз без учета знания концентрации препарата в крови может приводить к непредсказуемым последствиям. На чем основываются основные принципы проведения терапевтического лекарственного мониторинга (ТЛМ)? После введения препарата в организм его молекулы в месте действия должны находиться в равновесии с молекулами этого препарата в крови. Это означает, что оптимальному терапевтическому эффекту должна соответствовать некая средняя концентрация (или средний диапазон концентраций) препарата в крови пациента. На стадии разработки новых лекарственных препаратов проводятся обязательные фармакокинетические исследования, позволяющие выяснить оптимальный «терапевтический коридор» для многих лекарств, который можно сформулировать как диапаюн концентраций препарата в крови, в пределах которого существует достаточно высокая вероятность получения положительного эффекта и достаточно низкая вероятность появления нежелательных побочных и токсических эффектов.
Врач при назначении лекарства должен решить две основные задачи безопасной фармакотерапии:
- при значительной межиндивидуальный вариации фармакокинетических параметров препарата, приводящей к существенным различиям в конкретных значениях стационарных концен граций в крови пациента (особенно важно внимательно относиться к фармакотерапии у детей, у которых имеются существенные различия в массе тела и скорости метаболизма: нельзя не учитывать и половые различия);
- при нелинейной кинетике препарата нет прямой зависимости междудозой препарата и концентрацией препарата в крови в пределах терапевтического уровня (например, в случае применения фенитоина);
- при очень узком терапевтическом коридоре (опасность получения нежелательных побочных и токсических проявлений);
- при специфическом контингенте пациентов (беременные и кормящие женщины, лица пожилого возраста, грудные дети и т.д.), у которых фармакокинетические параметры, а значит, и границы безопасного терапевтического коридора, значительно отличаются от обычных известных средних значений;
- при нарушениях функции почек, печени или ЖКТ, влияющих на фармакокинетические параметры;
- при политерапии, когда нельзя исключить взаимовлияния нескольких препаратов и трудно смоделировать процессы, приводящие к нормализации фармакокинетических параметров;
- при сомнении в регулярности приема препарата пациентом.
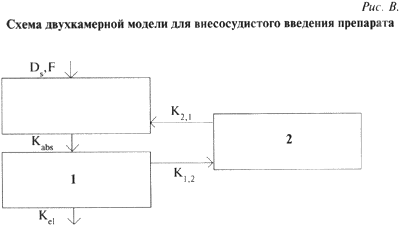
Существует довольно мною различных способов оптимизации фармакотерапии с помощью различного рода номограмм, различных графических методов и применением более современных методов, основанных на использовании современных фармакокинетических компьютерных программ, которым и следует, на наш взгляд, отдавать предпочтение в особо сложных случаях. Важно применение таких программ в случаях нелинейной кинетики препаратапри наличии минимального количества значений концентраций, когда еще не достигнуто стационарное распределение препарата в организме человека.Анализ лекарственных препаратов в биологических пробахОсновой для получения различных фармакокинетических параметров является определение концентраций лекарственного вещества в различных биологических жидкостях (кровь, моча, спинномозговая жидкость, амниотическая жидкость и др.) в определенные моменты времени после приема препарата. Выбор объекта исследования зависит от многих факторов. В первую очередь, он определяется доступностью исследуемого материала. Как правило, наиболее удобными объектами исследования являются кровь и моча. Исследования уровня концентраций лекарств в крови — наиболее распространенный фармакокинетическии подход для оптимизации фармакотерапии еще и потому, что фармакокинетические параметры, полученные в этом случае, можно коррелировать с данными биохимического анализа крови пациента. Существует большое число самых различных методов определения концентраций лекарств в биологических жидкостях: xроматографические, микробиологические, спектрофотометрические, полярографические, иммунологические (радиоиммунные, иммуноэнзимные), радиоизотопные и другге методы, основанные на различных физико-химических свойствах исследуемых материалов. Все вышеназванные методы достаточно хорошо описаны в мировой литературе и довольно широко применяются при проведении ТЛМ. Безусловно, каждый метод определения концентрации обладает определенными достоинствами и недостатками. Требования, предъявляемыми к методу в нескольких словах, следующие: чувствительность определения, экспрессность анализа, точность анализа, возможность работы с малым объемом биоматериала, стоимость анализа. Иммунологические методы, к безусловным достоинствам которых можно отнести относительную простоту и экспрессность проведения непосредственных измерений, занимают по праву одно из ведущих мест. Однако необходимо знать, что применение подобных методов сопряжено с определенными трудностями: необходимы специальная аппаратура и наборы, существующие далеко не для всех лекарственных средств, для которых ТЛМ остро необходим. Кроме этого, стоимость наборов достаточно высока и определение, даже разовое, обходится достаточно дорого. Далее, как правило, все наборы выпускаются различными зарубежными фирмами и, раз познав всю простоту и легкость решения проблемы, вы становитесь «заложником» фирмы-производителя. Применение микробиологических методов в нашей стране, как правило, ограничивается исследованием достаточно широкого диапазона антибиотических средств. Но, следует учитывать, что ни о какой экспрессности, чувствительности и точности при использовании данного метода речь идти не может. Применение таких методов, как полярографические, различные фотометрические методы при проведении ТЛМ нецелесообразно из-за высокой специфичности данных методов, недостаточно высокой чувствительности определения, связанной с целым рядом факторов и достаточно малой универсальностью применения. Гораздо более перспективно в существующих условиях использовать различные хроматографические методы анализа лекарств. Преимущества данных методов налицо — высокая чувствительность и точность определения, огромная универсальность применения (с помощью хроматографических методов возможно исследование более 95% всехлекарственных средств, используемых в современной фармакотерапии), достаточно большая экспрессность, возможность быстрого переключения с определения одного препарата на другой (при условии наличия метода определения), относительно невысокая стоимость анализа (заключающаяся в малых количествах используемых реактивов и прочих затратах). Конечно, при применении хроматографических методов необходимо иметь аппаратуру, которая имеет достаточно высокую стоимость и высококвалифицированных специалистов анализа. Однако при проведении массовых анализов эти затраты, как правило, довольно быстро окупаются. Когда-то выдающийся французский ученый XIX века Клод Бернар сказал: «Создание хорошего метода приносит иногда науке больше пользы, чем высокие теоретические соображения». Яркой иллюстрацией этой мысли является появление хроматографии. Рассмотрим основные принципы проведения хроматографического анализа. В 1903 г. русский ученый М.С. Цвет, изучая хлорофилл, должен был найти доказательства выдвинутого им предположения о сложности состава хлорофилла, который до этого считался индивидуальным веществом. В 1906 г. на собрании Московского общества естествоиспытателей М.С. Цвет сделал доклад о своей работе, в результате которой были выделены составляющие хлорофилл-компоненты. Одновременно М.С. Цвет изложил разработанный им новый метод разделения сложных веществ. Со времени открытия метода хроматографического анализа принципы, заложенные в основу этого метода разделения сложных смесей химических веществ, по сути не изменился. В основе его лежит принцип различия в сорбционной способности каждого химического вещества на том или ином сорбенте (веществе с большой адсорбционной емкостью). Продвигаемая носителем (элюентом) вдоль сорбента смесь веществ из-за разной величины адсорбционных свойств в одних и тех же условиях подвергается разделению (подобно разделению по температурам кипения, которое происходя при перегонке). При этом слой сорбента может находиться в виде тонкого слоя на пластинке, а продвигать смесь веществ может растворитель (или смесь растворителей) за счет капиллярных сил. В этом случае данный метод разделения будет называться тонкослойной хроматографией (ТСХ), сорбент может быть упакован в достаточно тонкую стеклянную или металлическую трубку, а анализируемая смесь продвигается вдоль колонки либо газом (газноситель) и тогда метод называется «газовая хроматография» (ГХ), либо потоком ра створителя (смесью растворителей), подаваемого в колонку под давлением (иногда довольно значительным) с помощью насоса — в этом случае мы имеем дело с жидкостной хроматографией (ВЭЖХ). Проведя хроматографическое разделение, необходимо обработать полученные данные, определить, что мы получили в результате анализа и в каком количестве, т.е. провести качественный и количественный анализы. Такие анализы проводятся обычно с помощью приборов, называемых детекторами, а запись полученного сигна ла осуществляется с помощью электронных интеграторов, самописцев или современных компьютерных программ в виде аналоговой формы электронного сигнала детектора. В результате мы получаем хроматограмму — картину разделения, где каждому разделенному веществу соответствует индивидуальный пик. Для проведения количественного определения полученные пики обсчитываются, калибруются и с помощью различных электронных устройств оператор получает полную количественную картину состава исследованного образца. Таким примерно образом проводится обычный хроматографический анализ многокомпонентных смесей. Для успешного решения задач количественного анализа хроматографическими методами необходимо проводить достаточно сложные процедуры подготовки проб для анализа. Вопросы подготовки проб, выбора метода анализа, разработки метода, количественной обработки полученных данных требуют серьезного отношения и использования профессионально подготовленных специалистов. Собственно весь процесс проведения любых фармакокинетических исследований предполагает использование специалистов самого различного уровня -врачей, биохимиков, химиков-аналитиков, математиков. От тщательности проведения каждого отдельного этапа зависит результат всей работы. Большинство фармакокинетических методов исследования базируется на изучении уровня концентрации того или иного препарата в крови пациента. При возникновении той или иной фармакокинетической задачи перед исследователем возникает вопрос: каким методом предстоит воспользоваться — ГЖХ, ТСХ, ВЭЖХ, ГХ-МС, иммунным, радиологическим, полярографическим или каким-либо другим. Большое внимание следует уделять вопросам подготовки и обработки биологических проб для анализа. От того, какой биологический объект будет изучаться, зависит как выбор метода анализа, так и способ его проведения. Оттого, каким методом предстоит воспользоваться, зависит многое, например способ подготовки проб для анализа. В основном процесс подготовки проб для анализа сводится к следующим процедурам: 1. Получение сыворотки крови. 2. Извлечение препарата в удобной для анализа форме (одно- или многократная экстракция препарата химическими растворителями или процесс осаждения белков тем или иным реагентом. В последнем случае необходимо помнить, что при осаждении белков сыворотки крови происходит разбавление образца, что влияет на чувствительность метода анализа). 3. Сохранение образца в виде сывороточных экстрактов, сыворотки крови, упаренных образцов в сухом виде и т.д. для последующего хроматографического анализа. Следует помнить, что при проведении фармакокинетических исследований некоторые препараты довольно быстро подвергаются биотрансформации (окислению, гидролизу и т.п.). Исходя из этого, каждый исследователь определяет минимальные и максимальные сроки проведения анализа. В процессе разработки метода следует также рассмотреть и исключить (или по возможности стандартизироиать> все возможные варианты потерь вещества при проведении основных и вспомогательных операций, чтобы избежать ошибок в анализе. Как же осуществляется выбор метода анализа лекарственного препарата? Очень часто этот выбор зависит от наличия той или иной аппаратуры в распоряжении исследователя. Требования, предъявляемые к выбранному методу анализа, можно сформулировать следующим образом. Методанализадолжен бытьдостаточно чувствительным для получения надежных результатов, воспроизводимым, дешевым и достаточно экспрессным. Процесс подготовки проб для анализа недолжен занимать много времени и должен быть достаточно простым и воспроизводимым. Выбранный методдолжен обладать большой производительностью. Примерно такие же процедуры необходимы при проведении газохроматографического анализа, с той лишь разницей, что при данном анализе практически исключена возможность анализа водосодержащих проб. Кроме того, при проведении подобного анализа возникает необходимость применения высокочистых сжатых газов (азот, гелий, водород и воздух), что соответственно удорожает весь анализ. Итак, мы знаем пути получения точных данных по уровню концентрации лекарственного препарата в той или иной биологической среде. Эти данные необходимо использовать при проведении фармакокинетических исследований в клинических условиях. Крайне важной областью применения этих данных и является терапевтический лекарственный мониторинг.Основные понятия фармакокинетикиИнтенсивность эффекта применяемого препарата находится в прямой зависимости с его концентрацией в месте действия. К сожалению, далеко не всегда возможно определение концентрации препарата в месте действия. Однако если принять предположение, что концентрация препарата в месте действия находится в зависимости от его уровня в каком-либо другом объекте, задача расчета достижения оптимальной концентрации препарата в месте действия представляется вполне достижимой. Описать все детали процесса распределения препарата в организме, во всех органах и тканях практически невозможно, или, по кранней мере, очень сложно. Однако это не всегда является необходимым. Во многих случаях бывает достаточно чисто формально представить организм в виде одной или более камер (компартментов), определить связи между этими камерами и составить материальный баланс. При этом появляется возможность составить достаточно упрощенные математические модели кинетики изучаемого препарата, в состав которых входит лишь ограниченное число измеряемых параметров. Такой упрощенный подход к математическому моделированию позволяет составлять довольно точные математические прогнозы получения желаемого уровня концентрации препарата в месте действия, основываясь на использовании хорошо разработанного математического аппарата и теории оптимизации. Такое моделирование называется камерным, или компартментным. При этом камера — это та часть организма, в которой препарат распределен равномерно. Для целей фармакокинетического анализа выбирается такое минимальное число камер, которое в данном случае необходимо для составления модели по имеющимся ограниченным опытным данным. Минимальным количеством камер, как это можно предположить, является единица. Математическая модель при этом будет однокамерной. При однокамерной модели предполагается некая фармакокинетическая однородность всех тканей, в которые проник препарат. Иными словами, предполагается, что сразу после введения препарата его концентрация в этой единственной камере становится равновесной и убывает по моноэкспоненциальному закону без видимой фазы распределения. В соответствии с законамилинейной кинетики скорость изменения количества препарата в этой единственной камере пропорциональна его количеству в камере. Для того чтобы перейти от количества препарата в камере к его концентрации, вводят коэффициент пропорциональности, который называют кажущийся объем распределения препарата (не эквивалентен физиологическому объему тканей камеры). Объем распределения препарата (Vd) является одним из наиболее важных фармакокинетических параметров и обычно рассчитывается на массу тела (л/кг). Величина объема распределения в рамках однокамерной модели при внутривенном введении равна такому условному объему жидкости, в котором нужно растворить всю попавшую в организм дозу препарата, чтобы получилась концентрация, равная начальной концентрации в крови (Сo). При различных способах введения препарата структура однокамерной модели может быть представлена двумя различными вариантами. Внутривенное введение или постоянная инфузия (рис. А) или постепенное введение препарата в камеру (рис. Б) из некоторого депо (при этом учитывается процесс абсорбции при внесосудистом введении). 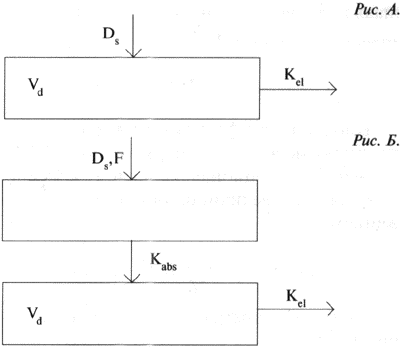
Источник



