- Химико-токсикологический анализ лекарственных веществ в крови (плазме, сыворотке) методом высокоэффективной жидкостной хроматографии
- Экспериментальная часть
- Концентрация калибровочных растворов и линейность.
- Результаты
- Определение лекарственных веществ методом жидкостной хроматографии
- Применение метода жидкостной хроматографии для диагностики гипо- и гипервитаминозов
- Диагностика оксидативного стресса
- Диагностика остеопороза
- Диагностика феохромоцитомы/нейробластомы
- Диагностика нарушений биосинтеза гема
- Диагностика гемоглобинопатий
- Заключение
Химико-токсикологический анализ лекарственных веществ в крови (плазме, сыворотке) методом высокоэффективной жидкостной хроматографии
библиографическое описание:
Химико-токсикологический анализ лекарственных веществ в крови (плазме, сыворотке) методом высокоэффективной жидкостной хроматографии / Крупина Н.А., Краснова Р.Р., Пашовкина Р.Н. // Мат. VI Всеросс. съезда судебных медиков. — М.-Тюмень, 2005.
код для вставки на форум:
Показана возможность применения метода высокоэффективной жидкостной хроматографии для скрининга и количественного определения лекарственных веществ в крови. Предложены условия изолирования лекарственных веществ из 0,5 мл крови.
Ключевые слова: высокоэффективная жидкостная хроматография, внутренний стандарт, жидкость жидкостная экстракция.
В настоящее время получило распространение злоупотребление медицинскими препаратами и использование лекарственных коктейлей в состав которых входит несколько лекарственных веществ из различных фармакологических групп. Доза каждого из принятых веществ может не достигать токсических концентраций, однако возрастает вероятность случайных и умышленных интоксикаций, нередко приводящих к смертельным исходам в результате фармакологического взаимодействия [1]. В связи с этим резко возрастает значение выбора метода изолирования и методики обнаружения при судебно – химическом исследовании на «неизвестное» вещество. Кроме того, необходимо правильно подобрать объект для исследования, его размерность, идентифицировать экстрагированное вещество с большой чувствительностью, специфичностью и провести количественное определение его. Количественное определение позволяет правильно интерпретировать полученные аналитические результаты и установить, имело ли место в данном случае отравление.
Современная высокоэффективная жидкостная хроматография — один из эффективных методов разделения сложных смесей на отдельные компоненты и проведения качественного и количественного анализа – компонентов разделяемой смеси. В конце 2003 года в лабораторию был приобретен высокоэффективный жидкостной хроматограф Agilent 1100 с диодно – матричным детектором (ДМД). При использовании ДМД проба сканируется каждые несколько миллисекунд, т.е. спектральная информация выдается практически постоянно. Диодная матрица постоянно регистрирует сигналы в ультрафиолетовой и видимой части спектра, обеспечивая таким образом, запись УФ – В — спектров в режиме сканирования. Это позволяет непрерывно снимать при высокой чувствительности неискаженные спектры быстро проходящих через спектральную ячейку компонентов. Данные, полученные от УФ – детектора одновременно на различных длинах волн, обрабатываются и оцениваются с помощью программного обеспечения, которое производит поиск в спектральной библиотеке, выделяет сигнал на определенной длине волны для повышения селективности, вычитает фон и осуществляет другие операции. Программное обеспечение может быть использовано для автоматической сверки УФ – спектров с известными, идентифицировать компоненты и проверять «чистоту» пиков путем сравнения спектров, записанных при начале и окончания выхода каждого пика. Такая автоматизированная система слежения идеальна для скрининга, поскольку позволяет отобрать для дальнейших исследований только «подозрительные» пики.
Целью нашего исследования был подбор оптимальных условий для изолирования лекарственных веществ из крови (плазмы, сыворотки), хроматографического скрининга лекарственных веществ и одновременного количественного определения их с использованием внутреннего стандарта.
Изучив зарубежную литературу по методам изолирования лекарственных веществ из биопроб с дальнейшим исследованием их методом ВЭЖХ [7], мы остановились на методе (несколько модифицировав его), который используется LNS Toxicologie (химико-токсикологическая лаборатория Люксембурга).
Нами также была создана база данных на лекарственные вещества, включающая в себя библиотеку УФ – спектров веществ, их абсолютные и относительные (относительно стандарта) [2 ]времена удерживания.
Экспериментальная часть
- Основа метода. Вещества из крови, сыворотки, плазмы экстрагируются с применением жидкость — жидкостной экстракции смесью н – гексана – дихлорметана – изо – пропанола при рН 9,5. Экстракты анализируются диодно – матричным детектором (ДМД) в градиентном режиме. Обнаружение веществ осуществляется по временам удерживания и УФ спектрам веществ. Количественное определение проводится с внутренним стандартом 5 – (4 – Метилфенил) – 5 – фенилгидантоином (MPPH).
- Объекты исследования. Объектами исследования являются кровь, сыворотка, плазма. Модельные исследования проводились на плазме, не содержащей лекарственных веществ, полученной из отделения переливания крови МОНИКИ им. М.Ф.Владимирского. В качестве реальных объектов использовали кровь, сыворотку живых лиц и кровь трупов, поступающих в отдел на исследование.
- Реактивы. Аммиачный буфер рН 9,5, насыщенный раствор сульфата аммония, н – гексан, дихлорметан, изо – пропанол, ацетонитрил для ВЭЖХ, МРРН, о-фосфорная кислота 85%, однозамещенный фосфат калия (Merck), стандартные растворы веществ (смесь): кофеин, фенобарбитал, димедрол, MPPH, феназепам в концентрации по 10мкг/мл.
- Приборы и принадлежности. Жидкостной хроматограф с диодно матричным детектором Agilent 1100, аппарат для встряхивания (горизонтальный тип встряхивания) 300 колеб./мин, центрифуга «Joan» 4000 об/мин, концентратор экстрактов с термоблоком, РН – тестер Checker, рН – метр (модификации рН 211), водоструйный насос, пипетки переменного объема 100 – 1000 мкл и 10 – 100 мкл с одноразовыми наконечниками, приспособление для фильтрования подвижной фазы.
- Условия обнаружения и определения. Исследование проводили на жидкостном хроматографе Agilent 1100 с диодно матричным детектором в градиентном режиме.
- Колонка:ZORBAX Eclipse XDB-C8 4,6 х 150 мм, 5 мкм;
- Предколонка ZORBAX SB – C18 4,6 х 12,5 мм, 5 мкм
- Температура термостата колонки 30 0 С
- Элюент А: вода деионизированная
- Элюент В: Ацетонитрил ВЭЖХ Градиент
- Элюент Д: Фосфатный буфер рН 3,8
- Градиент:
| Время (мин) | %В | %Д |
| 0 | 15 | 85 |
| 8 | 35 | 65 |
| 17 | 65 | 35 |
| 21 | 65 | 20 |
| 26 | 15 | 20 |
| 7 — 0 | 15 | 85 |
- Скорость потока: 1 мл / мин; от 7 – 0 минут кондиционирование.
- Длина волны: 220 нм. Объем вводимой пробы: 40 мкл.
Стандартные растворы. Стандартные растворы веществ и внутренний стандарт в концентрации 1мг/мл в метаноле, приготовленные весовым методом из стандартов веществ, чистота которых подтверждена методом хромато-масс спектрометрии.
Калибровочные растворы. Калибровочные образцы готовили из стандартных растворов (1мг/мл), с учетом терапевтических, токсических и летальных концентраций веществ в крови (С мг/л) [4]. Концентрации калибровочных растворов и линейность представлены в табл. 1.
Концентрация внутреннего стандарта (MPPH) 10 мкг/мл.
Концентрация калибровочных растворов и линейность.
| Вещество | С1 | С2 | С3 | С4 | С5 | Линейность (мг/л) |
| Амитриптилин | 0,2 | 0,5 | 1,0 | 2,0 | 5,0 | 0,2 — 5,0 |
| Диазепам | 0,1 | 0,5 | 1,0 | 5,0 | 0,1 — 5,0 | |
| Пропранолол | 0,05 | 0,5 | 2,0 | 5,0 | 0,05 — 5,0 | |
| Феназепам | 0,05 | 0,1 | 0,5 | 1,0 | 2,0 | 0,05 – 2,0 |
| Фенобарбитал | 5,0 | 10,0 | 20,0 | 50,0 | 100,0 | 5,0 – 100,0 |
Калибровка. Прибор с помощью программного обеспечения ChemStation автоматически проводит интегрирование пиков, при этом строится калибровочный график по данным калибровочной таблицы.
0,5 мл бланковой плазмы помещали в стеклянную пробирку на 12 мл, добавляли по 50 мкл (по 2 пробы) каждой концентрации калибровочных растворов веществ, тщательно перемешивали и затем настаивали в течение 5 минут для распределения в плазме. Добавляли 50 мкл МРРН (внутренний стандарт) в концентрации 10мкг/мл, тщательно перемешивали, 0,5 мл насыщенного раствора сульфата аммония, 0,5 мл аммиачного буфера (рН 9,5), Экстрагировали в течение 5 минут на аппарате для встряхивания (300кол/мин) с 5 мл смеси н – гексан – дихлорметан – изопропанол (60:40:2), центрифугировали 3 минуты при 4000 об/мин. Органическую фазу помещали в виалу на 4 мл и испаряли при температуре 40 0 С. Сухой остаток растворяли в 100 мкл подвижной фазы (15% ацетонитрила и 85% фосфатного буфера рН 3,8) и встряхивали в течение нескольких секунд на минишейкере IKA (2000/мин), 40мкл вводили в ВЭЖХ. Параллельно в вышеописанных условиях производили экстракцию и исследование бланковой плазмы.
Анализ исследуемого объекта. 0,5 мл исследуемой крови (сыворотки) помещали в стеклянную пробирку на 12 мл, добавляли 50 мкл внутреннего стандарта МРРН с концентрацией 10 мкг/мл, перемешивали. Далее анализировали аналогично описанному выше. Предварительно вводится стандартная смесь веществ: кофеин, фенобарбитал, димедрол, MPPH, феназепам в концентрации 10мкг/мл.
Рис.1. Стандартная смесь веществ (по 80 нг веществ во введённой пробе)
Идентификация лекарственных веществ осуществлялось по временам удерживания и библиотеке УФ – спектров.
Созданная база данных включает в себя следующие лекарственные вещества.
Амидопирин, амитриптилин, аминазин, анальгин, атенолол, атропин, верапамил, галоперидол, грандаксин, диазепам, дибазол, диклофенак, димедрол, карбамазепин, клозапин, кломипрамин, клофелин, кордиамин, кофеин, левомепромазин, левомицетин, миансерин, нитразепам, новокаин, нордазепам, но – шпа, оксазепам, папаверин, парацетамол, пропранолол, тиопентал, тиоридазин, трифтазин, феназепам, фенацетин, фенитоин, фенобарбитал, фтивазид, хлоразепат, хлордиазепоксид, циклобарбитал, циклодол, этаминал. Для некоторых из этих веществ были определены пределы обнаружения, определения,% выхода [6], и проведена статистическая обработка [3, 5].
Результаты
Предложенным методом выход лекарственных веществ основного характера в крови составил от 52,2 до 77%. (амитриптилин при С = 0,01 и 0,05мг/л выход 58 и 54,2% соответственно; димедрол при С = 0,025; 0,2; 10,0мг/л выход 77; 58,3; 70% соответственно; диазепам при С =0,1 и 1,0мг/л выход 54,1 и 53,2% соответственно; пропранолол при С = 0,05; 1,0; 5,0мг/л выход 57,1; 53,4; 70% соответственно; феназепам при С = 0,1; 0,5; 1,0мг/л выход 61,3; 57; 52,2% соответственно. Выход для фенобарбитала при С = 20,0 и 100,0 мг/л составил 16,5 и 15% соответственно. Пределы обнаружения и определения составили соответственно: 10нг/мл; и 50нг/мл (амитриптилин); 20нг/мл и 100 нг/мл (диазепам). 25нг/мл и 100нг/мл (димедрол); 10нг/мл и 50нг/мл (пропранолол); 30нг/мл и 80нг/мл (феназепам); 0,5мкг/мл и 2,0 мкг/мл (фенобарбитал)).
Статистическая обработка результатов (хi — индивидуальный результат, `Х – средняя арифметическая величина; S – стандартное отклонение; RSD (%) – относительное стандартное отклонение; Р – вероятность; Δ`Х – доверительный интервал) представлена в табл. 2.
Таблица 2 Статистическая обработка результатов.
| Наименование веществ | хi | Метрологические характеристики метода |
| Амитриптилин `Х =0,04 `Х =0,0473 Источник Определение лекарственных веществ методом жидкостной хроматографииПервый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, 125412 Москва, ул. Талдомская, 2 ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, 117997 Москва, ул. Островитянова, 1 Жидкостная хроматография в клинической лабораторной диагностике Журнал: Лабораторная служба. 2016;5(1): 8-18 Мамедов И. С., Золкина И. В., Глаговский П. Б. Жидкостная хроматография в клинической лабораторной диагностике. Лабораторная служба. 2016;5(1):8-18. https://doi.org/10.17116/labs2016518-18 Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
В настоящее время существует множество возможностей для применения хроматографических методов в области клинической лабораторной диагностики: диагностика нарушения обмена веществ (наследственная и приобретенная), токсикология, терапевтический лекарственный мониторинг и т.д. В данной статье описывается применение жидкостной хроматографии (ЖХ) для диагностики различных патологических состояний и примеры использования данного метода для превентивной медицины. В статье описаны варианты применения метода высокоэффективной ЖХ с различными вариантами детекции для диагностики таких заболеваний, как гипо- и гипервитаминозы, оксидативный стресс, остеопороз, феохромоцитома, нейробластома, нарушения синтеза гема и гемоглобинопатии. Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, 125412 Москва, ул. Талдомская, 2 ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, 117997 Москва, ул. Островитянова, 1 Хроматография используется уже более ста лет в различных областях науки и производства, таких как химическая, нефтехимическая, газовая, пищевая, целлюлозно-бумажная и многих других отраслях промышленности. С 70-х годов ХХ столетия хроматографические методы стали широко применяться в области биологии и медицины. В настоящее время разработаны и внедряются в практику здравоохранения методы высокоэффективной жидкостной хроматографии (ВЭЖХ), позволяющие определить качественно и количественно практически все встречающиеся в живом организме соединения: от низкомолекулярных (витамины, сахара, аминокислоты, нуклеотиды, пептиды и т. д.) до биологически активных полимеров (белки, нуклеиновые кислоты, полисахариды, липопротеиды и др.). Многообразие целей биомедицинского применения хроматографии обусловило наличие множества конкретных хроматографических систем, различающихся аппаратным обеспечением, основными механизмами разделения и принципами детектирования [1]. Анализ биологических жидкостей необходим также для исследования кинетики и селективности распределения лекарственных препаратов между различными тканями и органами, установления терапевтического уровня лекарств и скорости их выведения из организма, изучения процессов метаболизма. Поиск и создание новых лекарств, особенно с привлечением методов комбинаторной химии, теперь невозможны без хроматографии [2]. Возможностей для применения хроматографических методов очень много в области клинической лабораторной диагностики: диагностика нарушения обмена веществ (наследственная и приобретенная), токсикология, терапевтический лекарственный мониторинг и т. д. Хроматографический контроль биохимических маркеров и метаболитов применяется для скрининга и выявления опасных заболеваний, подтверждения специфических заболеваний, мониторинга эффективности терапии или появления противопоказаний, предсказания прогноза лечения, определения рецидивов заболевания. В одних случаях для надежной диагностики заболевания достаточно оценить уровень нескольких биохимических маркеров, в других определяется метаболический профиль многих компонентов. Биологическими маркерами являются сравнительно небольшие молекулы: катехоламины, аминокислоты (например, гомоцистеин), индолы, нуклеозиды, порфирины, сахара, стероиды, гормоны, витамины, птерины и липиды. В роли маркеров могут выступать и большие молекулы: отдельные ферменты, белки и нуклеиновые кислоты. В данной статье мы хотели бы подробнее остановиться на применении жидкостной хроматографии для диагностики различных патологических состояний и возможности использования данного метода для превентивной медицины. Применение метода жидкостной хроматографии для диагностики гипо- и гипервитаминозовВ настоящее время в лабораторной диагностике повсеместно применяется рутинное определение некоторых витаминов иммуноферментными методами, таких как витамин В9, В12 и 25-ОН-витамин Д. И это всего лишь малая часть всех витаминов. Большая же часть из этой группы жизненно важных веществ не может быть количественно определена рутинными иммуноферментными методами. В то же время некоторые группы витаминов успешно могут определяться современными селективными хроматографическими методами с различными типами детекции. Например, витамин В1 (тиамин), который является коферментом, участвующим в регуляции жизненно важных процессов нервной и сердечно-сосудистой систем. Он играет важную физиологическую роль в энергетическом метаболизме углеводов и жирных кислот, необходимых для нормального роста и развития. Тиамин принимает участие в физиологии слизистых оболочек (легких и кишечника). Тиамин дифосфат, также известный как тиамин пирофосфат, является физиологически активной формой витамина В1. Таким образом, именно мониторинг тиамина дифосфата более предпочтителен, чем анализ общего тиамина. В настоящее время существует ряд методик по количественному определению тиамина пирофосфата методом ВЭЖХ с флюоресцентным детектированием. Данные методики позволяют быстро и точно определить содержание данного аналита в цельной крови [3, 4]. Причем процедура пробоподготовки включает в себя несколько простых этапов: экстракция вещества из цельной крови, осаждение белков, центрифугирование, стабилизация и собственно хроматографирование. При этом время, потраченное на анализ одного образца с учетом пробоподготовки и хроматографирования, не будет превышать 40 мин, а при условии наличия в системе хроматографа автосамплера в потоковом режиме основное время затрачивается на процедуру пробоподготовки, а на каждый хроматографический анализ тратится не более 7 мин. Также существует ряд методик ВЭЖХ по определению витамина В2 (рибофлавин) [5, 6]. Рибофлавин является предшественником двух коэнзимов: флавин-аденин-динуклеотид (ФАД) и флавин-мононуклеотид (ФМН), которые необходимы для тканевого дыхания и получения энергии в процессе метаболизма углеводов, аминокислот и жиров. Рибофлавин жизненно необходим для нормального функционирования репродуктивной и иммунной систем, а также для роста, развития и восстановления тканей организма, таких как кожа, волосы, ногти, соединительная ткань. Превращение рибофлавина в ФАД и ФМН происходит, главным образом, в тонкой кишке, печени, сердце и почках. Основным удобством хроматографического определения рибофлавина является возможность одновременного детектирования двух коэнзимов ФАД и ФМН и самого рибофлавина в одном хроматографическом вколе, время которого не превышает 10 мин. Детектирование данных аналитов происходит с помощью флуоресцентного детектора при длине волны возбуждения 465 нм и длине волны эмиссии 525 нм. Пиридоксин, пиридоксаль и пиридоксамин и их фосфаты более известны как витамин В6. Пиридоксаль-5-фосфат как активная форма коэнзима принимает участие более чем в 100 ферментных реакциях, таких как синтез и превращение аминокислот в углеводы или жиры и превращение одних типов жиров в другие. Таким образом, пиридоксаль-5-фосфат является участником основных процессов продукции белков в организме. Он также участвует в таких физиологических процессах, как выработка нейротрансмиттеров и гормонов. Разработана методика по количественному определению пиридоксаль-5-фосфата методом ВЭЖХ с флюоресцентной детекцией [7, 8]. Особенностью данной методики является возможность определения пиридоксаля как из плазмы крови, так и из сыворотки или цельной крови пациентов, причем на анализ требуется всего 200 мкл любого из перечисленных биоматериалов. Разработана методика для одновременного детектирования витаминов В1 и В6 в одном хроматографическом вколе, данная возможность может упростить и ускорить диагностику недостаточности данных витаминов у пациентов [9]. Образец хроматограммы представлен на рис. 1. Существует еще один пример комплексной оценки витаминного статуса хроматографическими методами — одновременное количественное определение витаминов, А и Е в сыворотке или плазме крови. Витамин, А (ретинол) необходим для синтеза родопсина, формирования костей и синтеза гормонов. Нехватка витамина, А приводит к «куриной слепоте», сухости кожных покровов и выпадению волос. Витамин Е (альфа-токоферол) как сильный антиоксидант защищает LDL-холестерин и клеточные мембраны от перекисного окисления липидов, которое в основном возникает как результат повышенного оксидативного стресса в организме. Количественное определение витаминов происходит в изократической хроматографической системе со спектрофотометрическим детектированием при длине волны 325 нм [10]. Данную методику отличает быстрая пробоподготовка с двукратным осаждением белков (рис. 2). Диагностика оксидативного стрессаХроматографические методики по количественному определению различных веществ дают возможность комплексно подходить к диагностике оксидативного стресса, позволяя подобрать методики для мониторинга ряда маркеров этого патологического состояния организма. Оксидативный стресс приводит к значительному клеточному разрушению (окисление липидов, белков и ДНК). Малоновый диальдегид образуется при перекисном окислении ненасыщенных жирных кислот, таким образом являясь маркером оксидативного разрушения клеточных мембран [11]. Существует методика по хроматографическому определению малонового альдегида в плазме крови или сыворотке с помощью простой изократической жидкостной системы с флюоресцентной детекцией [12]. Флуорофор, получаемый в результате пробоподготовки (осаждение белков и дериватизация), специфичен и детектируется в очень малых количествах, при длине волны возбуждения 515 нм и длине волны эмиссии 553 нм. Витамин С выполняет в организме множество функций, одной из которых является защита организма от агрессивных окислителей. Также он играет роль кофактора в гидроксилировании коллагена. Описана методика, позволяющая быстро хроматографически разделить и детектировать витамин С в УФ-спектре при длине волны 245 нм [13]. Мешающие компоненты в составе биопроб удаляются в процессе пробоподготовки на этапе осаждения белков, одновременно с этим стабилизируя содержание витамина С в пробах. Для более точного количественного определения используется стабильный внутренний стандарт. Глутатион — это трипептид, который главным образом локализуется в клетках всех органов, а также в красных клетках крови. Он выполняет несколько физиологических функций, таких как внедрение свободных радикалов и формирование конъюгатов для их выведения из организма, в том числе токсических ксенобиотиков. Глутатион присутствует в организме в двух формах: восстановленной и окисленной, и по значению отношения этих двух форм можно определить редокс-статус клеток организма. Разработана методика, с помощью которой возможно количественно измерить содержание двух форм глутатиона (восстановленной и окисленной), используя для анализа всего 10 мкл цельной крови. Процедура пробоподготовки основана на осаждении белков и дериватизации, после чего обработанная проба подвергается жидкостному хроматографированию с флюоресцентной детекцией [14]. Еще один важный маркер оксидативного стресса — коэнзим Q10, или убихинон, который является одним из участников митохондриальной дыхательной цепи, выполняет важную роль в выработке клеточной энергии. Также он является эффективным утилизатором свободных радикалов, действуя как антиоксидант. Среди многих последствий недостаточности коэнзима Q10 обсуждается вариант возможной причины заболеваний сердца. Была разработана хроматографическая методика, позволяющая быстро и точно определить количественное содержание убихинона в крови, причем как в плазме или сыворотке крови, так и в цельной крови [15]. Пробоподготовка биообразцов заключается в осаждении белков и последующей концентрации пробы с помощью твердофазной экстракции. Так как в методике используется экстрагирование с гексаном, то упаривания пробы для концентрирования образца необходимо избегать. Использование в данной методике внутреннего стандарта позволяет минимизировать аналитическую вариацию. Для детектирования используется изократическое хроматографирование с последующим детектированием в УФ-спектре. Бета-каротин играет важную физиологическую роль в обменных процессах в организме, и особенно в свободнорадикальном окислении. Поэтому его количественное определение точными хроматографическими методами является важным в новом направлении клинической лабораторной диагностики. Была разработана и внедрена удобная и быстрая методика для количественно определения бета-каротина в сыворотке/плазме крови. Пробоподготовка включала в себя этап осаждения белков и экстракции, причем полученный в результате этого экстракт готов для ввода в хроматографическую изократическую систему со спектрофотометрическим детектором [16]. Хроматографирование происходит на обращенно-фазной колонке, что позволяет разделить в одной пробе несколько форм каротиноидов: альфа-, цис-бета- и транс-бета-каротин; при этом время анализа не превышает 10 мин. Причем перечисленные формы каротиноидов детектируются на одной длине волны — 453 нм. Диагностика остеопорозаОдной из важных областей клинической лабораторной диагностики различных патологических состояний является диагностика остеопороза, одного из серьезнейших заболеваний. Можно выделить две основных группы маркеров остеопороза: маркеры стабильности коллагенового матрикса (пиридинолин и дезоксипиридинолин — ПИД и ДПИД) и витамины Д2/Д3. Разработана простая и удобная методика по количественному определению общего содержания ПИД и ДПИД в моче. В методике применяется изократическая жидкостная хроматографическая система с флюоресцентным детектированием при длинах волн: возбуждения — 290 нм и эмиссии — 395 нм [17]. В процедуре подготовки мочи к анализу используется кислотный гидролиз, при этом использование устойчивого внутреннего стандарта позволяет компенсировать потери и вариацию в процессе этапа подготовки пробы, что улучшает точность и воспроизводимость данной методики. Пример хроматограммы представлен на рис. 3. Вторая группа маркеров диагностики остеопороза — витамины Д3/Д2. Для диагностики недостаточности минерализации костной ткани используется детектирование содержания витамина 25-ОН-витамин Д3 в крови. 25-ОН-витамин Д2 определяется при недостаточности витамина Д для мониторинга лекарственной терапии препаратами витамина Д2. С помощью разработанной методики возможно одновременное и точное количественное определение 25-ОН-витамин Д3 и 25-ОН-витамин Д2 с хроматографированием на обратнофазной колонке с последующим детектированием с УФ-спектре при длине волны 265 нм (рис. 4). В процессе пробоподготовки осаждением белков плазмы крови и последующей твердофазной экстракцией удаляются все мешающие соединения [18]. Диагностика феохромоцитомы/нейробластомыКатехоламины — группа биогенных аминов, производные аминокислоты тирозина: адреналин, норадреналин и дофамин, которые продуцируются хромаффинными тканями. Они являются диагностическими маркерами опухолевого процесса — феохромоцитомы, которая продуцирует их в большом количестве. Значительное превышение уровней адреналина, норадреналина и дофамина говорит о наличии опухоли в организме. Существуют несколько подходов к диагностике феохромоцитомы посредством измерения концентраций маркеров заболевания: измерение катехоламинов в крови, моче, а также измерение концентраций промежуточных и конечных метаболитов катехоламинов — метанефринов и ванилилминдальной, гомованилиновой и 5-гидроксииндолуксусной кислот. Особенностью количественного определения катехоламинов и их метаболитов в биожидкостях (кровь, моча) является то, что для этого применяется жидкостная хроматография с электрохимической детекцией. Диагностически важным является определение катехоламинов и серотонина в крови. Хроматографическая методика по определению катехоламинов в крови отличается некоторыми преимуществами: простота пробоподготовки и анализа, высокая чувствительность [19]. В организме человека серотонин участвует в огромном количестве физиологических процессов, которые являются результатом его функции в качестве нейротрансмиттера в центральной нервной системе и сердечно-сосудистой системе. Ряд заболеваний сопровождается патологическими изменениями в метаболизме серотонина. Существует методика по определению серотонина в крови. Она позволяет надежно определять серотонин в сыворотке, плазме и цельной крови [20, 21]. Легкая и быстрая пробоподготовка гарантирует точные и воспроизводимые результаты (рис. 5). Для хроматографического определения серотонина подходит любая изократическая система ВЭЖХ с электрохимическим детектором. Эта методика может помочь в подтверждении таких заболеваний, как депрессия, шизофрения или карциноидный синдром. Для диагностики карциноидного синдрома рекомендуется определение 5-гидроксииндолуксусной кислоты (5-ГИУК) в моче. Однако, если карциноиды генерируют только небольшое количество серотонина, определение серотонина в сыворотке крови может быть более чувствительным индикатором, чем серотонина или секреции 5-ГИУК в моче. Разработанная хроматографическая методика позволяет проводить рутинный ВЭЖХ-анализ серотонина в моче [22]. Определение серотонина или его метаболита 5-ГИУК является сегодня стандартным диагностическим тестом при подозрении на карциноидный синдром. Разработана удобная методика по определению катехоламинов в моче, особенностью которой является процедура пробоподготовки, основанная на твердофазной экстракции с предварительным доведением рН мочи до определенного значения [19]. Методика проста в постановке и отличается хорошей воспроизводимостью результатов (рис. 6). Для количественного определения промежуточных метаболитов катехоламинов в моче (метанефрина, норметанефрина и 3-метокситирамина) была разработана следующая методика. Пробоподготовка в данной методике включает следующие стадии: кислая стадия гидролиза, разбавление с нейтрализацией, которое автоматически регулирует уровень рН, необходимый для последующей твердофазной экстракции [23]. Хроматографическое определение выполняется на изократической системе ВЭЖХ с электрохимическим детектором. Оптимизация хроматографической колонки и мобильная фаза обеспечивают надежное разделение детектируемых пиков (рис. 7). Нейробластома является опухолевым заболеванием детей и третьей наиболее распространенной онкологической патологией у них. Из-за близкого гистологического расположения этой опухоли к вегетативной нервной системе эти пациенты выделяют повышенное количество метаболитов катехоламинов (ванилилминдальная кислота — ВМК, и гомованилиновая кислота — ГВК) в мочу. Измерение ВМК и ГВК является скрининговым тестом при диагностике нейробластомы. Концентрация 5-ГИУК в моче является диагностическим маркером при карциноидном синдроме. Эта злокачественная пролиферация энтерохромаффинных клеток желудочно-кишечного тракта приводит к избыточной продукции серотонина, основным метаболитом которого является 5-ГИУК. Разработанная методика позволяет легко и безопасно проводить рутинной анализ ВМК, ГВК и 5-ГИУК в моче с помощью изократической системы ВЭЖХ и электрохимического детектора [24]. Пример хроматограммы представлен на рис. 8. Диагностика нарушений биосинтеза гемаПорфирины являются предшественниками гемоглобина и могут появляться в моче в незначительных количествах. Таким образом, нарушения в биосинтезе гема вызывают синдром порфирии с увеличением образования и выделения порфиринов. Эти болезни могут быть врожденными или приобретенными вследствие отравления алкоголем или свинцом. Различные ферменты в биосинтезе гема могут быть в дефиците и вызывать разные виды порфирий со схожими симптомами. Поэтому только измерение концентрации порфиринов в моче может помочь определить точный диагноз. Разработана удобная методика по количественному определению порфиринов в моче, особенностью которой является очень простая пробоподготовка, требующая только стадии смешивания, добавления внутреннего стандарта и центрифугирования. Детектирование проводится флюориметрическим детектором при длинах волн: возбуждения и эмиссии 405 и 620 нм соответственно [25]. Типичная хроматограмма представлена на рис. 9. Диагностика гемоглобинопатийГемоглобин состоит из четырех полипептидных цепей, называемыми глобинами, и одной молекулы гема, связанной с каждым глобином. Различные генетические дефекты могут вызвать нарушения гемоглобина: структурные дефекты, талассемические синдромы и врожденная персистенция фетального гемоглобина. Наличие анормальных форм гемоглобина говорит о том, что в зависимости от типа гемоглобинопатии имеется тенденция к развитию закупорки сосудов эритроцитами. Среди всего прочего существуют различные клинические проявления синдрома, такие как серповидно-клеточная анемия, гипохромная анемия и цианоз. Эти синдромы могут быть вызваны различными мутациями, поэтому требуется адекватная терапия и постановка точного диагноза вида гемоглобинопатии. Разработана и успешно применяется методика по хроматографическому определению со спектрофотометрической детекцией разных видов гемоглобина [26, 27]. Для измерения требуется цельная кровь, и после быстрой пробоподготовки можно точно и достоверно определить в биообразце все главные анормальные гемоглобины — HbS, HbC, HbE, HbD, а также маркеры талассемии — HbA2 и HbF. Данная методика разработана таким образом, что в процессе хроматографирования отсутствуют интерференции между определяемыми веществами (рис. 10). И одним из главных преимуществ является достаточно короткое время анализа — примерно 9 мин. Также существует и отдельная хроматографическая методика для скрининга бета-талассемии [28]. Талассемия — врожденное нарушение синтеза гемоглобина, которое вызывает различные анемии. Гемоглобин взрослого человека обычно состоит из четырех полипептидных цепей: две из них альфа-глобины, а две другие — либо бета-глобины (HbA0) либо дельта-глобины (HbA2). Причем первый вариант встречается в более чем 90% случаев. Данная методика позволяет хорошо разделить и детектировать HbA2, HbA0, HbF, HbA1, причем длительность анализа в хроматографической системе не превышает 6 мин (рис. 11). ЗаключениеТаким образом, хроматографические методики позволяют безопасно и надежно определить широкий спектр клинически значимых параметров, используя ВЭЖХ. Спектр хроматографических методик достаточно велик, чтобы охватить наиболее значимые области для диагностики заболеваний человека. Современные хроматографические методики позволяют комплексно определять маркеры заболеваний для диагностики in vitro в таких областях, как диагностика остеопороза, скрининг биогенных аминов и витаминного статуса, мони-торинг окислительного стресса, порфиринов, а также профилирования и тестирования гемоглобина. Конфликт интересов отсутствует. Источники финансирования отсутствуют. Источник |

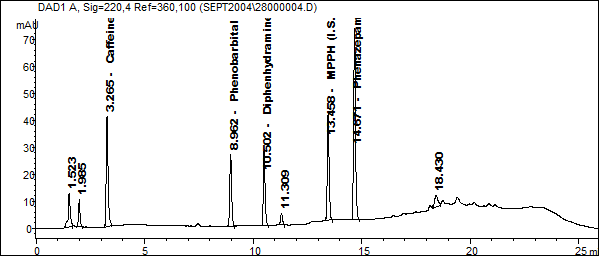



 Рис. 1. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с флюориметрическим детектированием. Int. standard — внутренний стандарт, vit. B1 — тиамин дифосфат, vit. B6 — пиридоксаль-5-фосфат.
Рис. 1. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с флюориметрическим детектированием. Int. standard — внутренний стандарт, vit. B1 — тиамин дифосфат, vit. B6 — пиридоксаль-5-фосфат. Рис. 2. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с спектрофотометрическим детектированием. Int. standard — внутренний стандарт, vit. А — ретинол, vit. Е — альфа-токоферол.
Рис. 2. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с спектрофотометрическим детектированием. Int. standard — внутренний стандарт, vit. А — ретинол, vit. Е — альфа-токоферол. Рис. 3. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с флюориметрическим детектированием. Int. standard — внутренний стандарт, Deoxypyridinoline — дезоксипиридинолин (ДПИД), Pyrididnoline — пиридинолин (ПИД).
Рис. 3. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с флюориметрическим детектированием. Int. standard — внутренний стандарт, Deoxypyridinoline — дезоксипиридинолин (ДПИД), Pyrididnoline — пиридинолин (ПИД). Рис. 4. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с спектрофотометрическим детектированием. Int. standard — внутренний стандарт, 25-OH-vitamin D2 — эргокальциферол, 25-OH-vitamin D3 — холекальциферол.
Рис. 4. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с спектрофотометрическим детектированием. Int. standard — внутренний стандарт, 25-OH-vitamin D2 — эргокальциферол, 25-OH-vitamin D3 — холекальциферол. Рис. 5. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Int. standard — внутренний стандарт, Serotonine — серотонин.
Рис. 5. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Int. standard — внутренний стандарт, Serotonine — серотонин. Рис. 6. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Int. standard — внутренний стандарт, Adrenaline — адреналин, Noradrenaline — норадреналин, Dopamine — дофамин.
Рис. 6. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Int. standard — внутренний стандарт, Adrenaline — адреналин, Noradrenaline — норадреналин, Dopamine — дофамин. Рис. 7. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Int. standard — внутренний стандарт, Metanephrine — метанефрин, Normetanephrine — норметанефрин, 3-Methoxytyramine — 3-метокситирамин.
Рис. 7. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Int. standard — внутренний стандарт, Metanephrine — метанефрин, Normetanephrine — норметанефрин, 3-Methoxytyramine — 3-метокситирамин. Рис. 8. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Iso-VMA — изованилилминдальная кислота (внутренний стандарт), VMA — ванилилминдальная кислота, HVA — гомованилиновая кислота, 5-HIAA — 5-гидроксииндолуксусная кислота.
Рис. 8. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с электрохимическим детектированием. Iso-VMA — изованилилминдальная кислота (внутренний стандарт), VMA — ванилилминдальная кислота, HVA — гомованилиновая кислота, 5-HIAA — 5-гидроксииндолуксусная кислота. Рис. 9. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с флюориметрическим детектированием. Int. standard — внутренний стандарт, Uroporphyrin — уропорфирин, Heptacarboxyporphyrin — гептакарбоксипорфирин, Hexacarboxyporphyrine — гексакарбоксипорфирин, Pentacarboxyporphyrin — пентакарбоксипорфирин, Coproporphyrin I — копропорфирин I, Coproporphyrin III — копропорфирин III.
Рис. 9. Типичная хроматограмма мочи, полученная методом ВЭЖХ в сочетании с флюориметрическим детектированием. Int. standard — внутренний стандарт, Uroporphyrin — уропорфирин, Heptacarboxyporphyrin — гептакарбоксипорфирин, Hexacarboxyporphyrine — гексакарбоксипорфирин, Pentacarboxyporphyrin — пентакарбоксипорфирин, Coproporphyrin I — копропорфирин I, Coproporphyrin III — копропорфирин III. Рис. 10. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с спектрофотометрическим детектированием. HbS, HbC, HbE, HbD — анормальные формы гемоглобина, HbA2, HbF, HbA1c, HbA0 — нормальные формы гемоглобина.
Рис. 10. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании с спектрофотометрическим детектированием. HbS, HbC, HbE, HbD — анормальные формы гемоглобина, HbA2, HbF, HbA1c, HbA0 — нормальные формы гемоглобина. Рис. 11. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании со спектрофотометрическим детектированием. HbA2, HbF, HbA1c, HbA0 — нормальные формы гемоглобина, из которых HbA2 и HbF — маркеры β-талассемии, HbA1c — гликированный гемоглобин.
Рис. 11. Типичная хроматограмма крови, полученная методом ВЭЖХ в сочетании со спектрофотометрическим детектированием. HbA2, HbF, HbA1c, HbA0 — нормальные формы гемоглобина, из которых HbA2 и HbF — маркеры β-талассемии, HbA1c — гликированный гемоглобин.

