Опишите путь который проходит лекарственный препарат
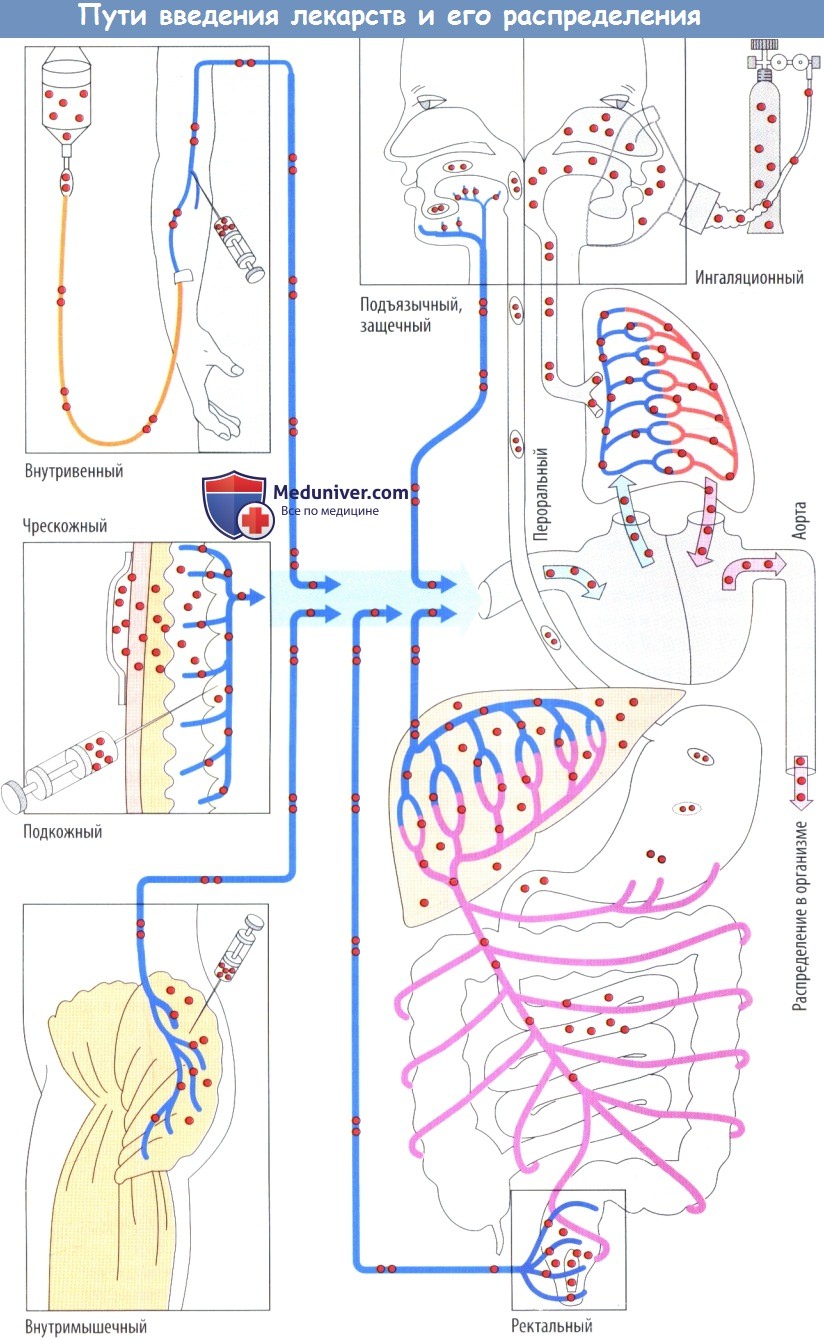
Как правило, лекарственные средства достигают органа-мишени через кровь. Поэтому в первую очередь они должны попасть в кровь, что обычно происходит через венозную сеть. Существует несколько возможных путей введения.
Лекарственный препарат можно ввести в виде инъекции или инфузии внутривенно, при этом он поступает непосредственно в кровоток. При подкожной или внутримышечной инъекции лекарственный препарат должен диффундировать из места введения в кровь. Поскольку при данных процедурах повреждается верхний слой кожи, необходимо придерживаться строгих правил их проведения.
По этой причине пероральный путь введения (т. е. прием внутрь), включающий последующий захват лекарственного средства из слизистой оболочки ЖКТ в кровь, выбирается гораздо чаще. Недостатком данного пути введения является то, что препарат должен пройти через печень на своем пути в общий кровоток. При всех перечисленных выше способах введения данный факт имеет большое практическое значение для любого лекарственного препарата, который быстро трансформируется или, возможно, инактивируется в печени (эффект первичного прохождения через печень, выделение до попадания в общий кровоток, биодоступность).
Более того, лекарственное средство проходит через легкие перед поступлением в общий кровоток. Легочная ткань может захватывать гидрофобные вещества. Поэтому легкие могут действовать как буфер и таким образом предупреждать быстрое повышение уровня лекарственного вещества в периферической крови после в/в инъекции (это важно, например, для в/в анестетиков). Даже при введении в прямую кишку как минимум часть лекарственного препарата попадает в общий кровоток через воротную вену, поскольку непосредственно в нижнюю полую вену течет кровь лишь из короткого терминального сегмента прямой кишки.
Эффект прохождения через печень удается миновать при всасывании препарата из щечной или подъязычной области, т. к. кровь из полости рта попадает в верхнюю полую вену. Аналогичный процесс происходит при введении в виде ингаляции. Тем не менее при данном пути введения обычно преследуется местный эффект, а системное действие требуется лишь в исключительных случаях. В определенных условиях лекарственный препарат можно также применять накожно с помощью чрескожной системы доставки. В данном случае лекарственное средство высвобождается из резервуара с постоянной скоростью в течение нескольких часов и затем проникает в эпидермис и субэпидермальную соединительную ткань, где попадает в кровь капилляров. Лишь очень небольшое число лекарственных препаратов можно использовать чрескожно.
Возможность данного пути введения определяется как физико-химическими свойствами лекарственного средства, так и терапевтическими требованиями (быстрый эффект в сравнении с продолжительным действием).
Скорость всасывания определяется путем и способом введения. Она самая быстрая при в/в инъекции, менее быстрая при в/м инъекция и самая медленная при подкожной инъекции. При введении лекарственного препарата через слизистую оболочку рта (защечный, подъязычный пути) его уровень в плазме повышается быстрее, чем при традиционном введении внутрь, т. к. он сконцентрирован непосредственно в месте всасывания, а в слюне накапливается очень высокая концентрация при растворении одной дозы.
Это приводит к тому, что захват через эпителий полости рта ускоряется. Более того, при всасывании лекарственного средства через слизистую оболочку полости рта отсутствует эффект первичного прохождения через печень и, следовательно, возможность его выведения до попадания в общий кровоток. Защечный или подъязычный путь не подходят для плохо растворимых в воде или плохо всасывающихся лекарственных средств. Такие препараты следует назначать внутрь, поскольку как объем для растворения жидкости, так и всасывающая поверхность гораздо больше в тонкой кишке, чем в полости рта.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Лекарственный препарат
Скачать
презентацию
Пример: Опишите путь, который пройдет лекарственный препарат, введенный в вену на левой руке, если он должен воздействовать на желудок. 22.
Слайд 22 из презентации «Вопросы ЕГЭ по биологии 2013». Размер архива с презентацией 236 КБ.
Биология 11 класс
«Производство молочной продукции» — Идеи. Работы критиков и аналитиков. Отчет об экскурсии. Порядок. Развитие сыроварения. Подлинный учёный. Определение наличия казеина в молоке. Строительство. Свойства составных частей молока. Исследование качества молока. Определение углеводов в молоке. Ксантопротеиновая реакция. Произведенное молоко. Животноводческая отрасль. Старицкий маслосырзавод. Предложение. Вклад великого ученого. Определение жира.
«Красный волк» — Длина туловища. Численность в СНГ. Русское название. Волчья ягода. Ареал. Редкие и исчезающие животные. Типичный житель гор. Красный волк. Меры охраны. Абакан.
«Динамика численности популяций» — Рост популяции. Способы регуляции численности популяций. Динамика популяций. Биология и информатика. Примеры популяций. Типы роста популяции. Этапы разработки и исследования. Знания о динамике популяций. Динамика популяций, как биологическое явление. Информационные модели развития популяций. Колебания численности особей в популяции. Модель «хищник – жертва». Состояние окружающей среды. Колебания численности особей.
«Вопросы ЕГЭ по биологии 2013» — Синдром Дауна. Способность к хемо-автотрофному питанию. Поведение человека. Мейоз. Белки. Суждения о витаминах. Нуклеиновые кислоты. Окисление органических веществ. Сходство и различие мутационной и комбинативной изменчивости. Гаплоидные клетки. Молекула белка. Молекулы белков. Расщепление клетчатки. Генотипы родителей. Формулировки генетических законов. РНК. Признаки гипофиза. Триплет нуклеотидов.
«Главные факторы эволюции» — Мутации. Дрейф генов. Постоянная мутационная изменчивость. Что такое изоляция. Виды мутаций. Ненаправляющие факторы эволюции. Количество кроликов. Факторы эволюции. Животные. Результат действия мутаций. Ген. Генные мутации. Особенности поведения. Условия среды. Изученные факторы. Один из важнейших факторов эволюции. Волны жизни. Механизм эволюционных изменений. Закон Харди-Вайнберга. Периодические колебания численности.
«Направления эволюции органического мира» — Дегенерация. Примеры дегенерации. Дегенеративные изменения организмов. Крупные ароморфозы. Эволюция. Ароморфоз. Идиоадаптация. Трубчатые черви. Общая дегенерация. Карточка обучающегося. Разнообразие форм идиоадаптации у насекомоядных. Объясните термины. Пример дегенерации паразитов. Характеристика биологического прогресса. Соотношения понятий. Изучение основных направлений эволюции. Критерии вида.
Всего в теме «Биология 11 класс» 57 презентаций
Источник
Как создать препарат в лаборатории и перенести его в производство
Все мы ходим в аптеку и покупаем лекарства: таблетки, порошки, мази, растворы и многие другие формы лекарственных веществ. Но мало кто знает, как происходит создание лекарств и какой путь необходимо пройти от научной разработки в руках ученого до получения регистрационного досье на готовый препарат.
Разработка и создание лекарственных препаратов проходят при финансовой поддержке различных государственных и коммерческих структур (фондов) в соответствии с утвержденными приоритетными направлениями развития науки, технологий и техники в Российской Федерации, согласно перечню (указ президента России от 7 июля 2011 года №899). Одним из таких направлений являются «Технологии снижения потерь от социально значимых заболеваний».
Терапия и диагностика онкологических заболеваний — одно из приоритетных направлений. Многие ученые работают над созданием новых низкомолекулярных веществ для химиотерапии, получением новых аналогов уже существующих препаратов для преодоления возникающей резистентности опухолевых клеток, а также созданием новых лекарственных форм препаратов для улучшения биодоступности активного компонента и уменьшения побочных эффектов. В последние годы широко развивается направление адресной доставки препаратов — например, на основе антител.
Нашей научной группой под руководством члена-корреспондента РАН, профессора, доктора химических наук Евгения Северина разработан универсальный подход к созданию препарата для адресной доставки в злокачественные новообразования. Данный метод заключается в синтезе наночастиц, содержащих активное вещество, с последующей конъюгацией векторной молекулой — белка, способного связываться с рецепторами на поверхности опухолевых клеток. Предварительные исследования показали многообещающие результаты, проведенные доклинические испытания подтвердили, что разработанный прототип препарата обладает большей противоопухолевой активностью по сравнению с аналогом, представленным на рынке. Суммируя опыт проведения таких исследований, мы можем описать стандартный протокол проведения исследований при разработке нового препарата и оформления нормативной документации.
Каков же общий путь исследований, позволяющих провести доказательную базу эффективности и безопасности нового препарата, и какое количество времени для этого необходимо? После проведения этапов разработки подхода создания препарата и проведения предварительных экспериментов для доказательства его эффективности коллективом оформляется заявка для участия в конкурсе для предоставления финансирования на проведение доклинических испытаний. Стандартный грант предоставляется на три года, по результатам выполнения которого у группы исследователей, выполняющих данную работу, будет готовый прототип препарата, изучена его эффективность, безопасность и оформлены все необходимые нормативные документы, на основе которых формируется досье и подается на рассмотрение в Министерство здравоохранения России.
Первое, что необходимо сделать при разработке нового препарата,— проведение обширного литературного и патентного поиска в близких и смежных областях, чтобы избежать «изобретения велосипеда». Если патентная чистота подтверждена, можно приступать к экспериментальной работе.
В полученном гранте на проведение доклинических испытаний прописан календарный план и список этапов, которые необходимо выполнить, а затем подготовить отчетную документацию. Все этапы регламентированы соответствующими нормативными документами. Настольными книгами для специалистов являются «Государственная фармакопея Российской Федерации» и «Руководство по проведению доклинических исследований лекарственных средств» под редакцией А. Н. Миронова. В фармакопее прописаны все требования и нормы к разрабатываемым препаратам, какие виды исследования необходимо провести для подтверждения состава, структуры и свойств будущего лекарства или новой лекарственной формы (порошки, таблетки, растворы и пр.). В руководстве по проведению доклинических исследований подробно изложено, как необходимо проводить доклинические испытания, чтобы исследование было стандартизировано: выбор вида животных, их количества, кратность введения, дозы и пр.
Для проведения такого широкого спектра исследований необходимо соответствующее количество будущего препарата. В лабораторных условиях обычно отрабатывают технологические режимы и оптимальные параметры получения — от температурного режима до масштабирования процесса — и изучают влияние этих параметров на свойства получаемого продукта. По оптимизированным условиям пишут лабораторный регламент, где четко описано, как именно и при каких условиях необходимо проводить каждый этап получения препарата и что должно быть на выходе, вплоть до учета потерь производства. Лабораторный регламент является официальным нормативным документом, на его основе составляют опытно-промышленный и промышленный регламенты. Для последних двух необходима специальная производственная площадка, аттестованная под изготовление похожего продукта, как и разработанный препарат (рекомбинантные белки, вакцинные препараты, противоопухолевые препараты и т. д.). Необходимо перенести лабораторную технологию получения продукта в больший масштаб на промышленное оборудование, отработать регламентированный процесс получения и оптимизировать технологию с учетом новых объемов. Таким образом, на промышленных производственных площадках по опытно-промышленному и промышленному регламенту получают опытные партии препарата, которые затем необходимо проверять на соответствие всем показателям, которые были установлены разработчиками после получения оптимальной партии по лабораторному регламенту. Все требования к полученному препарату описаны в нормативном документе — фармацевтической статье предприятия (ФСП).
ФСП пишут по тем методам, с помощью которых анализируют полученный препарат в соответствии с государственной фармакопеей. Для включения метода в ФСП необходимо использовать либо стандартизированные методы, приведенные в фармакопее, либо валидированные методы, которые были использованы, но отсутствуют в фармакопее или отличаются по условиям проведения от описанных. Чем больше активных (целевых) и вспомогательных компонентов в препарате, тем больше методов содержит ФСП. Необходимо провести количественный анализ активного компонента и примесей, полный качественный анализ, а также подтвердить сохранение функциональной активности основного компонента.
Зачем нужна фармацевтическая статья предприятия? В технологическом процессе получения препарата могут возникнуть непредвиденные неполадки на какой-либо стадии производства. Для выявления несоответствия продукта (брака производства) необходимо проводить анализ каждой партии. Если была получена бракованная партия, ее можно будет легко выявить, проведя все анализы и сравнив с установленными нормами в ФСП.
После получения опытных партий необходимо изучить стабильность полученного препарата, чтобы доказать, что за указанный промежуток времени (срок годности) не происходит никаких существенных изменений и свойства будущего лекарства остаются неизменными. Стандартный срок хранения лекарственных средств — от полугода до трех лет. Для противоопухолевых препаратов — два года. Для конкурентоспособности и рентабельности будущего лекарства необходимо придерживаться таких же сроков годности, а также ориентироваться на аналоги. Однако ждать два года, чтобы узнать, стабилен ли препарат и проходит ли он по всем нормам и стандартам, нет необходимости. Существуют протоколы, описанные в фармакопее (ОФС.1.1.0009.15 «Сроки годности лекарственных средств»), позволяющие сократить период исследования до года и даже шести месяцев, используя более агрессивные условия исследования. Если препарат по всем показателям сохраняет количественные, качественные и функциональные характеристики, указанные в ФСП, следующий этап — проведение доклинических исследований на животных. На все перечисленные стадии оформляют нормативные документы: регламенты на производство, отчеты о валидации, акты наработки, ФСП, протоколы анализа партий, подтверждающие соответствие полученного продукта описанному в документах.
Для изучения безопасности и эффективности полученного препарата на лабораторных животных утверждается план доклинических исследований, в котором перечислены все этапы исследования и их последовательность. План и модели проведения исследований составляются в зависимости от типа разработанного препарата и описаны в «Руководстве по проведению доклинических исследований лекарственных средств». Для оформления регистрационного досье необходимо провести полные доклинические исследования: исследование нескольких видов токсичности (общетоксическое действие, аллергизирующие свойства, иммунотоксическое действие, репродуктивная токсичность и др.), эффективности действия (например, противоопухолевый эффект нового препарата в сравнении с аналогами), изучить фармакокинетику. Все полученные данные обрабатывают статистически и оформляют в нормативный документ — отчет о доклинических исследованиях с прикреплением первичных результатов. На основании полученных данных, в случае если препарат обладает эффективностью и при этом безопасен для применения, разработчики пишут план проведения первой стадии клинических испытаний, проект инструкции по применению и проект брошюры исследователя. Из составленных документов формируется регистрационное досье, которое и подается на рассмотрение в Министерство здравоохранения России с другими сопутствующими документами.
До последнего этапа, описанного в данной статье, доходят немногие разработки. Путь от научной идеи до регистрации может занимать от трех лет до десятилетий. При наличии оформившейся идеи, прошедшей предварительные фундаментальные исследования, все описанные этапы исследования можно провести за три-пять лет. А дальше препарат ждет еще более сложный, но не менее интересный путь: клинические испытания, регистрация, производство и выход на рынок — при условии наличия хороших результатов на этапе клинических испытаний.
Елена Никольская, кандидат химических наук, старший научный сотрудник ИБХФ РАН
Источник



