- Производные пурина. Фармацевтический анализ пурина
- Анализ препаратов группы нуклеозиды пурина
- Количественное определение лекарственных веществ физико-химическими методами. Применение в медицине, фармакологии препаратов группы нуклеозиды-пурина. Определение подлинности препарата Рибоксина. Применение уф-спектрофотометрии в фармацевтическом анализе.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Производные пурина. Фармацевтический анализ пурина
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Производные пурина. Фармацевтический анализ пурина
Глава 16. Анализ лекарственных средств группы пурина
В природе производные пурина имеют большое биологическое значение. Соединения группы пурина содержатся в растениях и тканях животных в свободном виде, а также входят в состав нуклеозидов, нуклеотидов и нуклеиновых кислот.
Кофеин содержится в листьях чая (до 5%) и зернах кофе (до 1,5%). Впервые кофеин выделен и описан Ф. Рунге (1819); строение этого алкалоида доказано Э. Фишером в 1882 г. В листьях чая содержится также теофиллин, а в бобах какао – теобромин.
Нуклеиновые кислоты присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению и передаче генетической информации.
К производным пурина относится большая труппа лекарственных веществ, обладающих рахтичной фармакологической активностью — бронхолитической, диуретической, кардиотонической, противоопухолевой, действием на ЦНС.
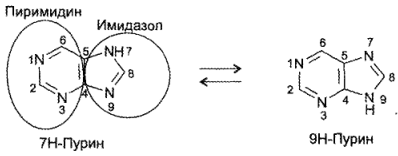
В основе химической структуры указанных лекарств лежит бициклическая система пурина, существующая в виде 2 изомеров:
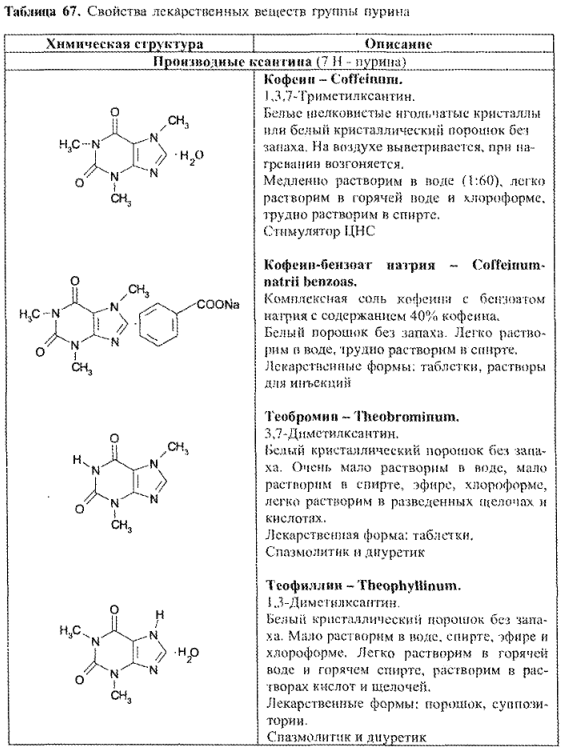
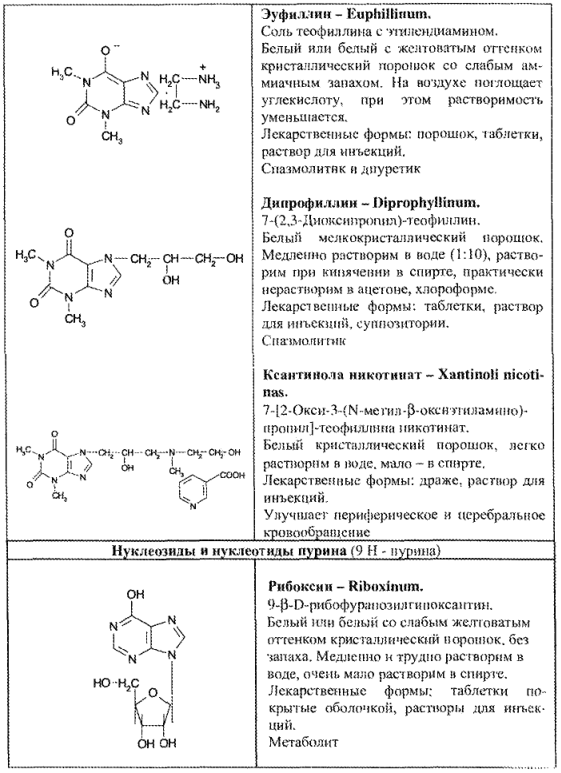
ЛС — производные пурина по химическому строению разделяются на следующие группы:
- производные ксантина;
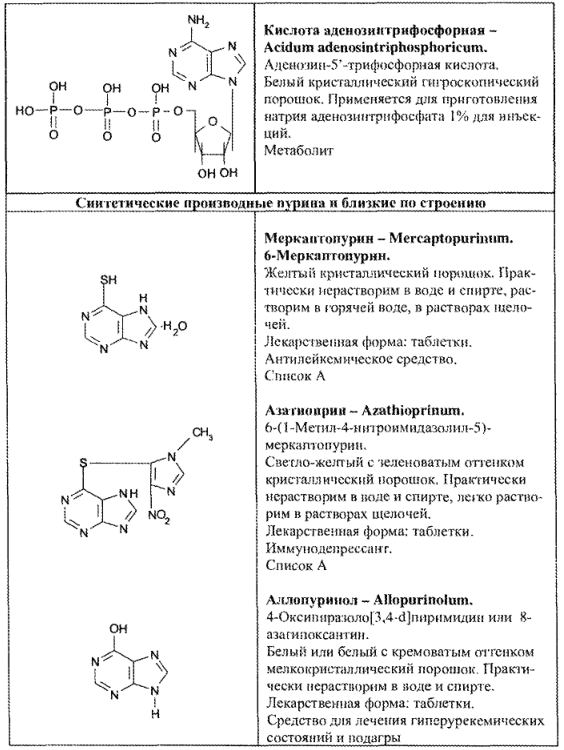
- нуклеозиды и нуклеотиды пурина (рибоксин, АТФ, динатриевая соль аденозинтрифосфорной кислоты);
- синтетические производные пурина и близкие по строению (табл. 67).
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И АНАЛИЗ КАЧЕСТВА
Физические свойства
Все соединения группы пурина – кристаллические порошки белого цвета с характерными Тпл и спектрами поглощения в УФ- и ИК-областях.
Способы получения
Вещества группы пурина можно получать из природных источников и синтетически. Пуриновые алкалоиды (кофеин, теофиллин, теобромин) — растительного происхождения.
С конца XIX в. успешно развиваются различные методы синтеза пурина и его производных. Впервые пурин был синтезирован Э. Фишером в 1899 г. при восстановлении 2,6,8-трихлорпурина. В настоящее время наибольшее практическое значение имеют 4 способа синтеза пуринов:
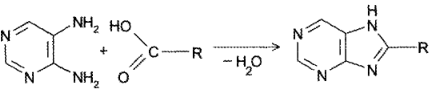
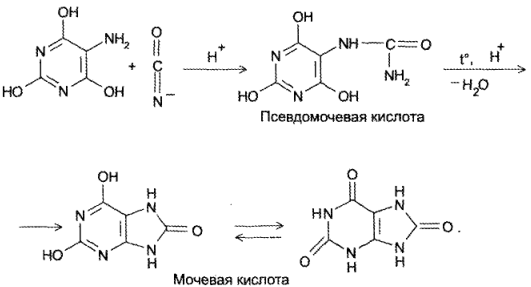
- Конденсация 4,5-диаминопиримидинов с карбоновыми кислотами (синтез Траубе, 1910). Этот способ в дальнейшем многократно модифицировался и до сих пор не утратил своего значения:
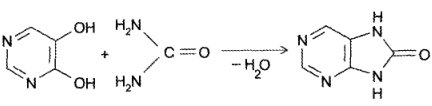
- Конденсация 4,5-диоксипиримидинов с. мочевиной (Беренд, Розен, 1888):
- Присоединение цианатов или изотиоцианатов к 5-амино-2,4,6- гриоксиоксипиримидину с последующей циклизацией образующегося карбамида пои нагревании в кислой среде (Э. Фишер, Аш, 1895):
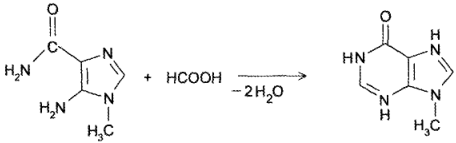
- Конденсация амида 5-амино-1-метилимидазол-4-карбоновой кислоты с муравьиной кислотой:
Кислотно-основные свойства
Пурин — ароматическая система с сильной делокализацией тг-электронов, которые играют большую роль в образовании различных молекулярных комплексов. Он обладает электронодонорными свойствами и представляет собой растворимое в воде слабое основание (рКа = 2,4), образующее с кислотами непрочные соли. В то же время благодаря наличию подвижного атома водорода в NН- группе пурин проявляет слабые кислотные свойства (рКа – 8,9) и образует соли с металлами.
Лекарственные вещества группы пурина — слабые основания, образующие с кислотами неустойчивые соли при протонировании гетероатома азота в 9-м положении.
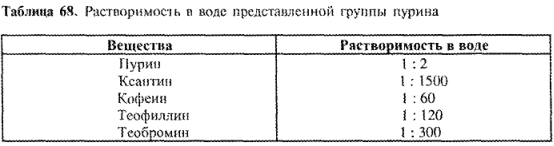
Как правило, производные ксантина с трудом растворяются в воде (лучше — в горячей). Для получения хорошо растворимых лекарственных препаратов используется их способность к комплексообразованию. Данные о растворимости различных веществ группы пурина представлены в табл. 68:
Хорошая растворимость пурина объясняется тем, что он образует водородные мостики с молекулами воды. Особенно мала растворимость ксантина. При метилировании атомов азота она значительно улучшается, как видно на примере кофеина, теофиллина, теобромина. Различия в растворимости объясняются разной межмолекулярной ассоциацией.
У кофеина 3 гетероатома азота метилированы. Вещество является мономером (не образует ассоциатов через водородные мостики), что объясняет его лучшую растворимость и низкую Тпл. Растворимость кофеина увеличивается в горячей воде, а также в присутствии солей органических кислот (за счет образования комплексов).
В теофиллине имеется одна свободная, но мало активная NН- группа, способная образовывать слабые межмолекулярные водородные мостики. Как в твердом состоянии, так и в растворе предполагается димеризация. Это подтверждается меньшей, чем у кофеина, растворимостью и более высокой Тпл.
Теобромин в твердом состоянии образует еще большие межмолекулярные агрегаты, основанные на активной NН-группе и выгодных в пространственном отношении карбонильных группах. Плохую растворимость и высокую Тпл можно также объяснить этой стабильной ассоциацией, что доказано ПК-спектроскопией.
Тенденция ксантинов к «самокомплексообразованию» противостоит их предрасположенности к образованию комплексов с солями органических кислот (бензойной, салициловой, 4
аминобензойной, ацетилсалициловой и др.).
Кофеин — слабое органическое основание (рКa. = 0,61). Растворим в минеральных кислотах, но устойчивых солей не образует. Взаимодействует с общеалкалоидными осадительными реактивами. Но с раствором йода реагирует только при подкислении (что характерно для такого слабого основания) с образованием осадка перйодида (Соff*Cl*14 ). С танином кофеин образует осадок, растворимый в избытке реактива. В отличие от многих других оснований кофеин не осаждается реактивом Майера, что используется при определении чистоты препарата.
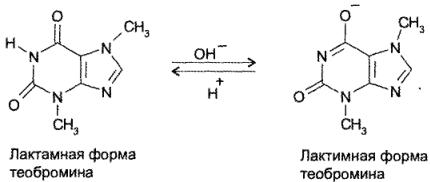
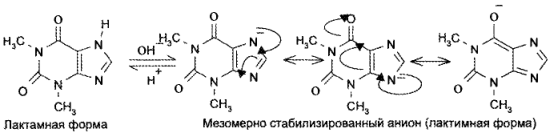
Теобромин и теофиллин являются амфотерными соединениями. Их основные свойства обусловлены наличием неподеленной пары электронов атома азота в 9-м положении. Кислотные свойства теобромина (рКа= 9,9) связаны с подвижностью атома водорода имидной группы, а теофиллина (рК,
8,8) — с подвижностью атома водорода при гетероатоме азота в 7-м положении. Кислотные свойства у теофиллина выражены сильнее, чем у теобромина. Это связано с тем, что теобромин в растворах щелочей образует только лактимную форму, а теофиллин — мезомерно стабилизированный анион:
Обладая более выраженными, чем у теобромина, кислотными свойствами, теофиллин растворяется не только в щелочах, но и в растворе аммиака:
За счет кислотных свойств теофиллин и теобромин образуют растворимые соли не только со щелочами, но и с органическими основаниями. С солями тяжелых металлов (Аg + , Со 2+ , Сu 2+ ) получаются нерастворимые соединения.
Мурексидная проба (общегрупповая реакция)
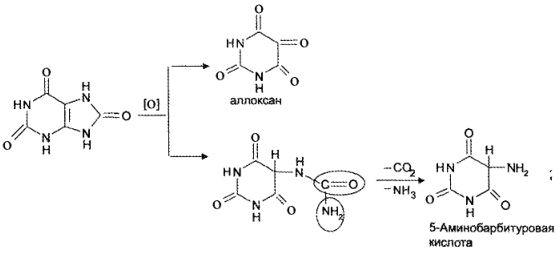
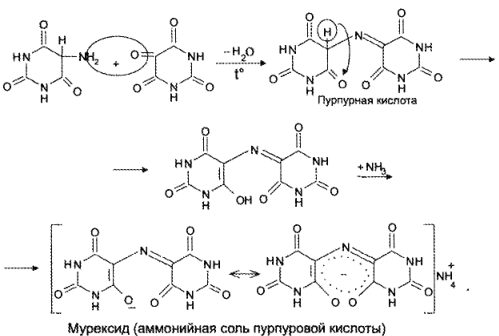
Реакция основана на окислительно-гидролитическом разложении веществ группы ксантина до производных пиримидина, в которых 1 или 2 аминогруппы конденсируются друг с другом до образования пурпурной кислоты, имеющей в виде аммонийной соли красно фиолетовое окрашивание. Для проведения реакции препарат нагревают на водяной бане до полного упаривания с окислителем (Н2О2, Вr2, НNО3) в кислой среде. Затем добавляют раствор аммиака; появляется пурпурно-красное окрашивание.
Химизм (на примере мочевой кислоты):
Для мочевой кислоты нагревание производят с кислотой азотной концентрированной, которая окислительно разлагает вещество до аллоксана и 5-аминобарбитуровой кислоты. Затем продукт окисления (как карбонильное соединение) конденсируется с продуктом гидролиза до пурпурной кислоты, которая в присутствии аммиака переходит в мезостабилизированный анион, назывемый мурексидом.
В случае метилированных производных ксантина вместо азотной кислоты применяют раствор пероксида водорода в солянокислой среде и затем добавляют аммиак (в случае, если он не образуется при гидролизе препарата).
Реакции электрофильного замещения после щелочного гидролиза
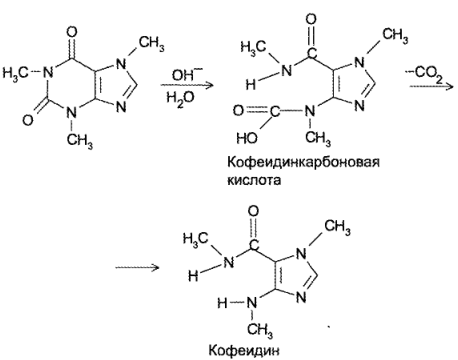
Кофеин, обладающий слабоосновными свойствами, неустойчив в щелочной среде. При pH > 9 происходит разложение кофеина до кофеидинкарбоновой кислоты, которая разлагается с образованием кофеидина и соответствующего карбоната. Причем кофеидия является антагонистом кофеина по фармакологическому действию, что может привести к нежелательным последствиям при применении разложившегося препарата.
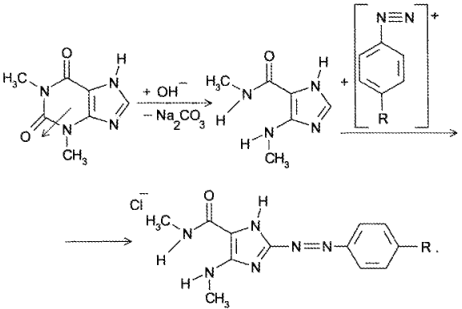
В сернокислой среде кофеин может разложиться до муравьиной кислоты. Аналогично разлагается теофиллин до теофиллидина, который далее может быть идентифицирован по реакции азосочетания с солью диазония с образованием азокрасителя:
Другие реакции
Теофиллин образует с 2,6-дихлорхинонхлоримидом в боратном буферном растворе (pH 8,5) мероцианиновый краситель интенсивно-голубого цвета:
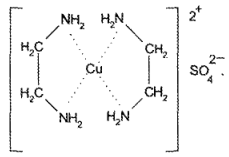
Эуфиллин реагирует с раствором сульфата меди с образованием комплексного соединения красно-фиолетового цвета (реакция на остаток этилендиамина):
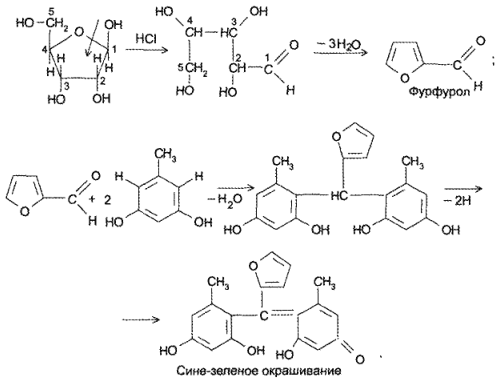
Аденозинтрифосфорная кислота (и натриевая соль) за счет остатка рибозы взаимодействует с орцином в присутствии небольшого количества хлорида железа (III) с образованием продукта конденсации сине-зеленого цвета:
В азатиоприне нитро-группу восстанавливают до первичной ароматической амино-группы и далее проводят диазотирование и азосочетание с фенолом (образование азокрасителя).
Остаток бензойной кислоты в кофеин-бензоате натрия открывают качественной реакцией с хлоридом железа (III) — образуется осадок телесного цвета.
Методы количественного определения
- Кислотно-основное титрование в неводной среде. Препараты-основания и соли оснований определяют в среде уксусного ангидрида (кофеин) или смеси ледяной уксусной кислоты и уксусного ангидрида (ксантинола никотинат). Титрант — 0,1М раствор хлорной кислоты.
Обладающие кислотными центрами теобромин, теофиллин растворяют в протофильных растворителях (диметилформамид, пиридин, бутил амин) и титруют растворами метилатов натрия или калия.
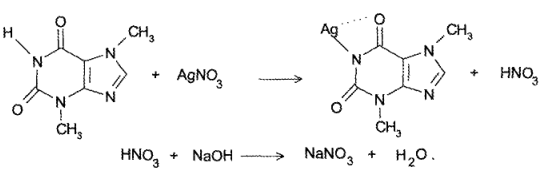
- Косвенный метод нейтрализации. При взаимодействии теобромина и теофиллина с раствором нитрата серебра образуется эквивалентное препаратам количество азотной кислоты, которую титруют стандартным раствором гидроксида натрия:
- Кислотно-основное титрование в водной среде. Кофеин-бензонат натрия определяют по остатку бензоата натрия титрованием стандартным раствором хлороводородной кислоты в присутствии эфира.
Эуфиллин за счет остатка этилендиамина количественно определяют титрованием стандартным раствором хлороводородной кислоты.
- Аргентометрия (обратный способ). К раствору теофиллина или теобромина добавляют аммиак и фиксированный избыток титрованного раствора нитрата серебра; образуется нерастворимая серебряная соль. Осадок отфильтровывают и в фильтрате определяют избыток нитрата серебра титрованием со стандартным раствором роданида аммония (индикатор – железоаммониевые квасцы).
- Йодометрия. Применяется для определения кофеина в кофе- ин-бензоате натрия. Метод основан на образовании осадка перйодида кофеина в кислой среде (соff • Нl • 14), который отфильтровывают и в фильтрате определяют избыток йода.
- Метод Кьельдаля (определение азота в органических веществах).
Данным методом определяют дипрофиллин.
- Весовой метод. Метод иногда используют для определения кофеина в лекарственных формах заводского производства (кофеин извлекают из смеси в щелочной среде хлороформом; далее хлороформ отгоняют, остаток высушивают и взвешивают).
- Физико-химические методы (УФ-спектрофотометрия, ГЖХ и ВЭЖХ) применяют для количественного определения препаратов группы пурина в лекарственных формах заводского производства. Метод рефрактометрии применяют для анализа растворов кофеинбензоата натрия в условиях аптеки.
Источник
Анализ препаратов группы нуклеозиды пурина
Количественное определение лекарственных веществ физико-химическими методами. Применение в медицине, фармакологии препаратов группы нуклеозиды-пурина. Определение подлинности препарата Рибоксина. Применение уф-спектрофотометрии в фармацевтическом анализе.
| Рубрика | Химия |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 21.03.2018 |
| Размер файла | 2,3 M |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство здравоохранения Республики Узбекистан
Ташкентский фармацевтический институт
Кафедра: Фармацевтическая химия
На тему: Анализ препаратов группы нуклеозиды пурина
Применение уф-спектрофотометрии в фармацевтическом анализе
Спектроскопические методы анализа основаны на избирательном поглощении (абсорбции) электромагнитного излучения анализируемым веществом. В фармацевтическом анализе они используются для установления структуры, идентификации, оценки чистоты, количественного определения светопоглощающих веществ.
Существующая в настоящее время аппаратура позволяет использовать для аналитических целей следующие диапазоны длин волн: ультрафиолетовый (190-380 нм), видимый (380-780 нм), инфракрасный (780-40000 нм или 0,78-400 мкм).
В зависимости от используемой аппаратуры, регистрируемого физико-химического эффекта (поглощение или испускание электромагнитного излучения) и области спектра различаются следующие спектроскопические методы:
¦ спектрофотометрия в ультрафиолетовой (УФ) и видимой области;
¦ спектрофотометрия в инфракрасной (ИК) области;
¦ атомно-эмиссионная и атомно-адсорбционная спектроскопия (АЭС и ААС);
¦ спектроскопия ядерного магнитного резонанса (ЯМР).
Каждый из указанных методов имеет свои варианты использования в фармацевтическом анализе.
Испытание на подлинность лекарственных веществ. В основе этой стадии фармацевтического анализа лежат следующие приемы:
а) нахождение в спектре лmax и лmin , характеризующих области максимального и минимального поглощения;
б) вычисление отношения значений оптических плотностей исследуемого раствора при разных длинах волн;
в) характеристика интенсивности поглощения по величине удельного показателя (Е);
г) сравнение спектра анализируемого вещества со спектром стандартного образца этого же вещества.
Во всех случаях необходимо получение спектра в условиях, приведенных в НД — растворитель, концентрация, интервал длин волн, размер (толщина) кюветы.
Для случая (а) в полученном спектре находят лmax и лmin, сравнивают с такими же характеристиками, приведенными в НД — при идентичности веществ оба значения должны совпадать.
Удобным приемом при испытании на подлинность является определение отношения величин поглощения при двух максимумах. Это уменьшает влияние переменных характеристик прибора на испытание и исключает необходимость использования стандартного образца. При испытании на подлинность часто рекомендуется рассчитать Ев максимуме поглощения (например, для левомицетина, адреналина, прогестерона) или сравнить найденное значение оптической плотности в определенном диапазоне длин волн со значениями, приведенными в НД.
Количественное определение. Принцип количественного определения методом УФ-спектрофотометрии заключается в следующем: навеску анализируемого образца (субстанция, лекарственная форма и др.) растворяют в подходящем растворителе, если необходимо, дополнительно готовят разведение полученного раствора и измеряют его оптическую плотность при длине волны, указанной в методике.
Для количественного определения фармацевтических субстанций индивидуально и в однокомпонентных лекарственных формах используют следующие способы расчета:
¦ по градуировочному (калибровочному) графику;
¦ по значению удельного или молярного показателя поглощения;
¦ по оптической плотности стандартного образца.
С помощью градуировочного (калибровочного) графика по значению оптической плотности анализируемого раствора (Ах) методом интерполяции находят концентрацию стандартного раствора (Сх) с равным значением оптической плотности. Найденное значение Сх пересчитывают на массу порошка по прописи (Р) по формуле:
где Cх — концентрация стандартного раствора со значением оптической плотности, равным оптической плотности анализируемого раствора (найдена по калибровочному графику), г/мл, %, г/10 мл; W1; W2 — соответственно вместимость мерных колб, использованных для приготовления анализируемого раствора, мл; V — аликвота для приготовления фотометрируемого раствора, мл; a1 — навеска (объем) лекарственной формы, взятая на анализ, г (мл); Р — масса (объем) лекарственной формы по прописи, г (мл).
Анализ лекарственных веществ группы пурина
В природе производные пурина имеют большое биологическое значение. Соединения группы пурина содержатся в растениях и в тканях животных в свободном виде, а также входят в состав нуклеозидов, нуклеотидов и нуклеиновых кислот.
Кофеин содержится в листьях чая (до 5%) и зернах кофе (до 1,5%). Впервые кофеин был выделен и описан Ф. Рунге (1819); строение этого алкалоида было доказано Э. Фишером в 1882 г. В листьях чая содержится также теофиллин, а в бобах какао — теобромин.
Нуклеиновые кислоты присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению и передаче генетической информации.
К производным пурина относится большая группа лекарственных веществ, обладающих различной фармакологической активностью, например, бронхолитической, диуретической, кардиотонической, противоопухолевой, действием на ЦНС.
В основе химической структуры указанных лекарств лежит бициклическая система пурина, существующая в виде двух изомеров:
Лекарственные средства производные пурина по химическому строению разделяются на следующие группы:
1.Производные ксантина (кофеин,кофеин-бензоатнатрия, теобромин, теофиллин, эуфиллин, дипрофиллин, ксантинола никотинат)
2.Нуклеозиды и нуклеотиды пурина (рибоксин, АТФ, динатриевая соль аденозинтрифосфорной кислоты)
3.Синтетические производные пурина и близкие по строению (меркаптопурин, азатиоприн, аллопуринол, этимизол).
Таблица 1. Свойства лекарственных веществ группы пурина Нуклеозиды и нуклеотиды пурина (9 Н — пурина)
Рибосин(Riboxinum)— белый или почти белый кристаллический порошок. Легко растворим в воде и мало растворим в спирте.
Лекарственные формы: драже, раствор для инъекций.
Улучшает периферическое и церебральное кровообращение.
Кислота аденозинтрифосфорная (Acidum adenosintriphosphoricum)-белый кристаллический гигроскопический порошок. Применяется для приготовления натрия аденозинтрифосфата 1% для инъекций. Метаболит.
Все соединения группы пурина ? кристаллические порошки белого цвета, имеющие характерные температуры плавления и спектры поглощения в УФ- иИК-областях.
Вещества группы пурина можно получать из природных источников и синтетически. Растительное происхождение имеют пуриновые алкалоиды?кофеин, теофиллин, теобромин.
С конца ХIХ в успешно развиваются различные методы синтеза пурина и его производных. Впервые пурин был синтезирован Э. Фишером в 1899 г. при восстановлении 2,6,8-трихлорпурина.В настоящее время наибольшее практическое значение имеют четыре способа синтеза пуринов:
2. Конденсация 4,5-диоксипиримидиновс мочевиной (Беренд, Розен, 1888 г.):
3. Конденсация амида5-амино-1-метилимидазол-4-карбоновойкислоты с муравьиной кислотой:
4. Присоединение цианатов или изотиоцианатов к5-амино-2,4,6-три-оксиоксипиримидину с последующей циклизацией образующегося карбамида при нагревании в кислой среде (Э. Фишер, Аш, 1895 г.):
Пурин ? ароматическая система с сильной делокализациейр-электро-нов, которые играют большую роль в образовании различных молекулярных комплексов. Обладает электронодонорными свойствами и представляет собой растворимое в воде слабое основание (pKa= 2,4), образующее с кислотами непрочные соли. В то же время, благодаря наличию подвижного атома водорода в NH-группе,проявляет слабые кислотные свойства (pKa = 8,9) и образует соли с металлами.
Лекарственные вещества группы пурина ? слабые основания, образующие с кислотами неустойчивые соли при протонировании гетероатома азота в 9 положении.
Как правило, производные ксантина с трудом растворяются в воде, лучше ? в горячей воде. Для получения хорошо растворимых лекарственных препаратов используется их способность к комплексообразованию.
Хорошая растворимость пурина объясняется тем, что он образует водородные мостики с молекулами воды. Особенно мала растворимость ксантина. При метилировании атомов азота она значительно улучшается, как видно на примере кофеина, теофиллина, теобромина. Отличие в растворимости объясняется их различной межмолекулярной ассоциацией.
Мурексидная проба (общегрупповая реакция)
Реакция основана на окислительно-гидролитическом разложении веществ группы ксантина до производных пиримидина, в которых одна или две аминогруппы конденсируются друг с другом до образования пурпурной кислоты, имеющей в виде аммонийной соликрасно-фиолетовоеокрашивание. Для проведения реакции препарат нагревают на водяной бане до полного упаривания с окислителем (H2O2, Br2, HNO3) в кислой среде. Затем добавляют раствор аммиака; появляетсяпурпурно-красноеокрашивание.
Химизм (на примере мочевой кислоты):
Для мочевой кислоты нагревание производят с концентрированной азотной кислотой, которая окислительно разлагает вещество до аллоксана и 5-аминобарбитуровойкислоты. Затем продукт окисления (как карбонильное соединение) конденсируется с продуктом гидролиза до пурпурной кислоты, которая в присутствии аммиака переходит в мезостабилизированный анион, назывемый мурексидом.
Аденозинтрифосфорная кислота (и натриевая соль) за счет остатка рибозы взаимодействует с орцином в присутствии небольшого количества хлорида железа (III) с образованием продукта конденсациисине-зеленого цвета:
Методы количественного определения
1). Метод Кьельдаля (определение азота в органических веществах). Данным методом по ГФХ .
Источник