- Роспотребнадзор (стенд)
- Роспотребнадзор (стенд)
- БАД не является лекарственным средством — Памятки
- БАД не является лекарственным средством
- Что такое БАДы и насколько они безопасны? Разбираемся, чем они отличаются от лекарств
- «БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ» — эта надпись на многих упаковках в аптеке звучит довольно угрожающе. Зачем тогда это в аптеке продают, если это не лекарство? И есть ли разница? И почему какие-то лекарства нельзя купить без рецепта врача? СПИД.ЦЕНТР выяснил, чем отличаются биологически активные добавки от лекарств.
- по теме
- Лечение
- Суперсила бактерий: антибиотики наносят ответный удар
- Референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств
- Введение
- Исследование по изучению информированности медицинских работников по вопросам референтности и взаимозаменяемости ЛП
- Алгоритмы работы с ГРЛС
- Заключение
Роспотребнадзор (стенд)
Роспотребнадзор (стенд)
БАД не является лекарственным средством — Памятки
БАД не является лекарственным средством
БАД не является лекарственным средством
БИОЛОГИЧЕСКИ АКТИВНЫЕ ДОБАВКИ (БАД)–это природные (или идентичные природным) биологически активные вещества,позволяющие обогатить рацион человека недостающими витаминами и элементами в связи с их недостаточным содержанием в пище.
В настоящее время широко распространена реклама, которая содержит неподтвержденные данные:
— о составе и свойствах биологически активной добавки,
— о рекомендациях по применению (включая перечень заболеваний),
— об отсутствии противопоказаний.
Такая реклама вводит в заблуждение потребителей и порождает многочисленные жалобы потребителей БАД.
Распространенный прием, связанный с рекламированием БАД,— это использование имен международных организаций, например, Всемирной организации здравоохранения (ВОЗ). При этом ничего не говорится о лицензировании, проверке качества, утверждении документации и т.д. Однако неосведомленный потребитель может предположить, что ВОЗ этот продукт одобрила.
ФЗ от 13.03.2006 г. № 38-ФЗ «О рекламе»в статье 25 установлены требования к рекламе БАДов.
Реклама биологически активных добавок и пищевых добавок не должна:
1) создавать впечатление о том, что они являются лекарственными средствами и (или) обладают лечебными свойствами;
2) содержать ссылки на конкретные случаи излечения людей, улучшения их состояния в результате применения таких добавок;
3) содержать выражение благодарности физическими лицами в связи с применением таких добавок;
4) побуждать к отказу от здорового питания;
5) создавать впечатление о преимуществах таких добавок путем ссылки на факт проведения исследований, обязательных для государственной регистрации таких добавок, а также использовать результаты иных исследований в форме прямой рекомендации к применению таких добавок.
ВАЖНО ЗНАТЬ! БАД НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И НЕ ПРИМЕНЯЕТСЯ ДЛЯ ЛЕЧЕНИЯ КАКИХ-ЛИБО ЗАБОЛЕВАНИЙ!
Продажа биологически активных добавок, не зарегистрированных в РФ, запрещена.
На сегодняшний день достаточно остро стоит проблема реализации некачественной продукции, в том числе БАД, не отвечающей требованиям нормативной документации. Учреждения и организации, реализующие БАД, должны иметь на каждый вид следующие документы:
-свидетельство о государственной регистрации;
-заводской паспорт качества с санитарно-эпидемиологическим заключением.
При обнаружении БАД без указанных документов они считаются в незаконном обороте, поэтому подлежат изъятию.
Не допускается реализация биологически активных добавок к пище:
— с истекшим сроком годности;
-при отсутствии надлежащих условий реализации;
-без этикетки, а также в случае, когда информация на этикетке не соответствует информации, согласованной при государственной регистрации;
— при отсутствии на этикетке информации, наносимой в соответствии с требованиями действующего законодательства.
ИНФОРМАЦИЯ О ПОТРЕБИТЕЛЬСКИХ СВОЙСТВАХ БАД ДОЛЖНА СОДЕРЖАТЬСЯ НА ЭТИКЕТКЕ И (ИЛИ) НА ЛИСТКЕ-ВКЛАДЫШЕ!
Согласно СанПиН 2.3.2.1290-03 розничная продажа БАД возможна:
1)аптечные учреждения (аптеки, аптечные магазины, киоски и другие);
2)специализированные магазины по продаже диетических продуктов;
3)продовольственные магазины (специальные отделы, секции, киоски).
Знайте, что дистанционная продажа БАДов (заказ по телефону, через интернет с доставкой на дом), а также продажа через дистрибьютеров запрещена.
ВНИМАНИЕ!Перед применением биологически активных добавок к пище следует обязательно проконсультироваться с врачом.
НЕЛЬЗЯ ПУТАТЬ «БИОЛОГИЧЕСКИ АКТИВНЫЕ» И «ПИЩЕВЫЕ ДОБАВКИ».
Пищевые добавки— это природные или синтезированные вещества или их соединения, преднамеренно вводимые в пищевые продукты или продовольственное сырье для достижения тех или иных технологических целей.
К ним относятся ароматизаторы, пищевые красители, консерванты, стабилизаторы, загустители и т.п.
ДЕЙСТВИЯ ПОТРЕБИТЕЛЯ В СЛУЧАЕ ПРИОБРЕТЕНИЯ НЕКАЧЕСТВЕННОЙ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ
Согласно ст. 1 ФЗ № 29 «О качестве и безопасности пищевых продуктов», БАДы относятся к пищевым продуктам, то есть если вы приобрели некачественную биодобавку, то можете предъявить продавцу или изготовителю такой добавки требования, предусмотренные статьей 18 Закона о защите прав потребителей.
Требования предъявляются в претензии, составлять которую нужно в двух экземплярах, срок рассмотрения по закону составляет 10 дней.
Факт причинения вреда жизни, здоровью или имуществу вследствие приобретения некачественной биологически активной добавки необходимо официально зафиксировать – например, обратиться к врачу и получить у него соответствующую медицинскую справку.
В случае неудовлетворения претензии в досудебном порядке, потребитель имеет право обратиться в суд за защитой своих прав (ст. 17 Закона о защите прав потребителей).
Источник
Что такое БАДы и насколько они безопасны? Разбираемся, чем они отличаются от лекарств
Андрей Смирнов СПИД.ЦЕНТР
«БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ» — эта надпись на многих упаковках в аптеке звучит довольно угрожающе. Зачем тогда это в аптеке продают, если это не лекарство? И есть ли разница? И почему какие-то лекарства нельзя купить без рецепта врача? СПИД.ЦЕНТР выяснил, чем отличаются биологически активные добавки от лекарств.
Разница действительно есть: она в регистрационном статусе и доказательной базе, но обо всем по порядку.
Быть или не быть препарату лекарством — в каждой стране решает свой государственный регулирующий орган. У нас это Минздрав, в США — FDA (Food and Drug Administration), в Европе — EMA (European Medicines Agency) и так далее. Чтобы стать лекарством, каждый кандидат должен пройти особую процедуру госрегистрации. Она долгая и сложная, основная ее задача — подтвердить две ключевые вещи:
- безопасность препарата;
- эффективность препарата.
Если сейчас вы подумали про клинические исследования — все верно, их результаты имеют важнейшее значение для регистрации препарата как лекарства. Исследования проводит производитель препарата в специальных лицензированных независимых клинических центрах. Каждое исследование до его начала должно получить одобрение Минздрава и затем тщательно контролируется на всех этапах, что исключает искажение результатов. Если в ходе исследований удалось доказать, что потенциальный препарат эффективен и безопасен, он становится лекарством.
А «слабые и некрасивые» становятся БАДами?
Не совсем. Если вещество обладает достаточно выраженным эффектом и потенциально может нанести вред человеку при неправильном применении, БАДом оно не станет. Такие вещества могут иметь статус только лекарственного средства или вообще не получат разрешения на применение, если у них плохие результаты клинических исследований.
Для БАДов (биологически активных добавок к пище) существует своя процедура государственной регистрации, но занимается этим уже Роспотребнадзор. Исследования тоже проводят, но доказывают только безопасность препарата.
по теме
Лечение
Суперсила бактерий: антибиотики наносят ответный удар
В этом принципиальное отличие БАДов от лекарств: если препарат зарегистрирован как лекарство, это значит, что его действие было подтверждено в ходе независимых испытаний и гарантировано регулирующим органом. Если речь идет о БАДе, то доказана и гарантирована только его безопасность. Это не значит, что никакого положительного эффекта не будет, его просто никто не проверял.
Конечно, производитель сам может организовать какие-то исследования, но их трудно будет назвать независимыми, а результат — гарантированным. Поэтому БАДы в этом смысле куда ближе к еде, чем к лекарствам, а с точки зрения законодательства едой и являются. В том числе поэтому их можно продавать не только в аптеках, но и в продуктовых супермаркетах. Контроль качества БАДов также значительно упрощен по сравнению с лекарствами, поэтому риск купить некачественную продукцию в случае БАДов выше.
Принимая любые БАДы, нужно четко понимать, что вреда от них с большой вероятностью не будет, но и лечебного эффекта никто не гарантирует: БАДами вообще не лечат болезни, это функциональные добавки к пище, которые могут улучшать состояние организма в некоторых случаях или применяться для профилактики. И, конечно, ни в коем случае нельзя пытаться лечить БАДами какие-либо серьезные заболевания. БАД, например, от рака может предлагать только мошенник, каким бы дорогим ни был рекламируемый препарат. Совместное применение лекарств и БАДов тоже не всегда оправдано: БАД может ухудшать всасывание лекарства или ускорять его выведение из организма, что будет снижать лечебный эффект. Поэтому при назначении любых лекарств обязательно сообщите врачу, если вы принимаете какие-то БАДы.
Отечественная регистрация
Однако есть еще один путь регистрации препаратов. Дело в том, что некоторые средства (например, витамины, пробиотики, сорбенты и тому подобные) можно регистрировать и как лекарство, и как БАД — они подходят под оба критерия, и выбор остается за производителем. Но регистрация БАДа — гораздо более простой и дешевый путь, чем регистрация лекарства. Поэтому нередко производитель сначала регистрирует и несколько лет продает такой препарат как БАД, а затем, накопив опыт применения и деньги на клинические исследования, перерегистрирует его уже как лекарство.
К сожалению, к некоторым лекарствам тоже есть вопросы по части доказательства эффективности, и речь сейчас даже не о гомеопатии. Дело в том, что российский Минздрав при оценке результатов клинических исследований использует критерии, далеко не всегда строго соответствующие принципам доказательной медицины. Поэтому у нас на рынке есть множество лекарств (Арбидол, Актовегин, Мексидол и другие), которые никогда бы не получили такого статуса в США или Европе. Это не значит, что такие лекарства «плохие» или неэффективные. Это значит, что их исследовали методами, не соответствующими критериям доказательной медицины. Применять ли такие препараты в лечении — личный выбор каждого. А проверить наличие у лекарства одобрения FDA или EMA можно на сайтах: https://www.drugs.com, или https://www.ema.europa.eu/en, или https://www.accessdata.fda.gov (поиск лучше проводить по международному непатентованному наименованию (МНН)).
В 2010 году российский Минздрав изменил правила регистрации лекарств, введя довольно неоднозначное требование об обязательном проведении клинических исследований препаратов на территории России. До этого изменения для регистрации лекарства достаточно было предоставить протоколы клинических исследований, проведенных в других странах. Мотивов введения таких изменений было несколько.
- Минздрав не мог контролировать качество исследований, проведенных в других странах.
- Некоторые лекарства по-разному действуют на представителей разных рас, что требует доказательства безопасности и эффективности препарата именно на нашей популяции.
Оба аргумента выглядят довольно слабо, потому что часть регуляторов (те же FDA и EMA) используют более жесткие критерии при оценке лекарств, поэтому сомневаться в качестве таких исследований — это дуть на воду. Что касается различий в действии лекарственных средств на людей разных рас, такие случаи встречаются нечасто и население нашей страны по этим параметрам вполне соответствует среднему европеоиду. Безусловно, огромным плюсом этой инициативы стало то, что зарубежные производители начали чаще включать Россию в мультицентровые клинические исследования, одновременно проводящиеся в нескольких странах. Что способствовало развитию всей отрасли клинических исследований в нашей стране.
Обратная сторона медали — снижение доступности некоторых новых лекарств в нашей стране. Проблема в том, что клинические исследования и вся процедура регистрации лекарств оплачиваются производителем и стоят довольно дорого. Поэтому если потенциальный рынок для нового препарата в России небольшой, производителю бессмысленно тратить деньги на исследования в России — это не окупится. А без регистрации продавать препарат нельзя. Поэтому нередко новейшие лекарства оказываются на нашем рынке с задержкой в несколько лет.
А рецепт у вас есть?
Лекарства также различаются по регистрационному статусу, образуя две большие группы:
- препараты безрецептурного отпуска (OTC от английского over-the-counter);
- препараты, отпускаемые по рецепту (Rx от латинского recipe).
Разница между этими группами понятна из названия. И здесь все дело снова в безопасности. Безрецептурный статус могут получить только давно присутствующие на рынке и хорошо изученные лекарства, не имеющие серьезных побочных эффектов при применении, не накапливающиеся в организме и с большим терапевтическим индексом.
Терапевтический индекс — это отношение средней дозы препарата, используемой для лечения заболевания, к средней дозе, в которой он проявляет токсическое действие. Чем больше значение терапевтического индекса, тем сильнее нужно превысить рекомендованную дозу, чтобы отравиться лекарством.
Источник
Референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Информация о лекарственных средствах (ЛС) и организация системы информационной обеспеченности сведениями о ЛС являются важными факторами, влияющими на компетентность и информированность медицинских кадров по вопросам рационального использования лекарственных препаратов (ЛП). Эта проблема включает несколько направлений, в т. ч. использование ЛС с доказанной эффективностью и безопасностью и возможность предупреждения нежелательных побочных реакций. По ряду причин специалисты системы здравоохранения в РФ зачастую не владеют объективной и оперативной профессиональной информацией о ЛС в связи с увеличением количества обращающихся на фармацевтическом рынке ЛП, преобладанием воспроизведенных препаратов отечественного и импортного производства и отсутствием доступных информационных баз данных об их взаимозаменяемости с референтными препаратами.
Ввиду значимости данных вопросов авторы провели изучение информированности медицинских работников Иркутской области по вопросам референтности и взаимозаменяемости ЛП, а также провели анализ возможностей работы в системе Государственного реестра ЛС. В результате был разработан и предложен алгоритм работы с данным информационным ресурсом (получение информации о референтности того или иного ЛП, поиск взаимозаменяемых ЛП).
Ключевые слова: рациональное использование лекарственных средств, референтный лекарственный препарат, взаимозаменяемость, Государственный реестр лекарственных средств.
Для цитирования: Ковальская Г.Н., Михалевич Е.Н. Референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств. РМЖ. 2019;8(I):65-69.
Reference and interchangeable medicinal products in the State Register of Medicines
G.N. Kovalskaya, E.N. Mikhalevich
Irkutsk State Medical Academy of Postgraduate Education — the branch of the Russian Medical Academy of Continuous Professional Education
Information on pharmaceutical products (PP) and organization of the information security system on PP data are important factors affecting the competence and awareness of medical personnel on the rational use of medicinal products (MP). This problem includes several areas, including the PP use with proven efficacy and safety, and the ability to prevent unwanted adverse events. For a number of reasons, health care specialists in the Russian Federation often do not possess objective and timely professional information on PP due to the increase in the number of tradeable MP in the pharmaceutical market (with the reproduced drugs predominance of domestic and foreign production and the lack of available information databases on their interchangeability with reference products). Due to these issues importance, the authors conducted a study on medical workers (Irkutsk region) awareness on the reference and interchangeability issues of MP, and also analyzed the possibilities of o perating in the State Register of Medicines system. As a work result, an algorithm for operating with this information resource was developed and proposed (obtaining information about the particular MP reference, searching for interchangeable MP).
Keywords: rational use of medicinal products, reference medicinal product, interchangeability, State Register of Medicines.
For citation: Kovalskaya G.N., Mikhalevich E.N. Reference and interchangeable medicinal products in the State Register of Medicines. RMJ. 2019;8(I):65–69.
В статье рассмотрены референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств. Предложен алгоритм работы с данным информационным ресурсом.
Введение
В соответствии с рекомендациями ВОЗ национальные регулирующие органы в сфере обращения лекарственных средств (ЛС) в РФ в последние годы уделяют особое внимание созданию системы рационального использования ЛС. Регламентирующим документом Министерства здравоохранения РФ определена Стратегия лекарственного обеспечения населения до 2025 г., которая утверждена приказом Минздрава от 13 февраля 2013 г. № 66 (ред. от 7 апреля 2016 г.) «Об утверждении Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года и плана ее реализации».
Одним из ключевых положений системы рационального использования служит независимая объективная профессиональная информация о ЛС, что является важным фактором, влияющим на компетентность и информированность медицинских кадров. Проблема рационального использования ЛС включает несколько направлений, в т. ч. использование ЛС с доказанной эффективностью и безопасностью и возможность предупреждения нежелательных побочных реакций ЛС [2].
По ряду причин специалисты системы здравоохранения в РФ зачастую не владеют объективной и оперативной профессиональной информацией о ЛС в связи с увеличением количества обращающихся лекарственных препаратов (ЛП) на фармацевтическом рынке, преобладанием воспроизведенных препаратов отечественного и импортного производства и с отсутствием доступных информационных баз данных об их взаимозаменяемости с референтными препаратами [3].
В соответствии с федеральными законами от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств» и от 22.12.2014 г. № 429-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» в РФ отменен термин «оригинальное лекарственное средство» и введены новые понятия: «референтный лекарственный препарат», «взаимозаменяемые лекарственные препараты». Изменена формулировка понятия «воспроизведенный лекарственный препарат» и впервые введена статья 27.1 «Порядок определения взаимозаменяемости лекарственных препаратов для медицинского применения».
Согласно ряду исследований наиболее эффективным и безопасным ЛП среди всех торговых наименований, соответствующих одному международному непатентованному наименованию (МНН), является референтный ЛП. Однако применение воспроизведенного ЛП вместо референтного ЛП даже по экономическим соображениям может быть оправдано лишь в том случае, если специалист убежден, что это не снизит эффективность и безопасность фармакотерапии.
В соответствии с действующим приказом Министерства здравоохранения Российской Федерации от 14.01.2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения» «назначение лекарственных препаратов осуществляется медицинским работником по международному непатентованному наименованию (МНН), а при его отсутствии — по группировочному или химическому наименованию. В случае отсутствия МНН и группировочного или химического наименования лекарственного препарата лекарственный препарат назначается медицинским работником по торговому наименованию» [4]. Если раньше в выборе конкретного ЛП определяющую роль могла играть лояльность лечащего врача к тому или иному ЛП, то сегодня этим фактором становятся личные предпочтения покупателя вкупе с рекомендациями специалиста аптеки, занимающегося отпуском ЛП.
Перспективы решения этих вопросов с целью повышения качества фармацевтической помощи обозначены в распоряжении Правительства РФ от 12.01.2018 г. № 9-р «Развитие конкуренции в здравоохранении», в котором был утвержден план мероприятий («дорожная карта»). Этим планом предусмотрено внесение целого ряда изменений в нормативно-правовое регулирование, касающееся взаимозаменяемости ЛП в частности. Среди прочего «дорожная карта» предусматривает обеспечение функционирования института взаимозаменяемости ЛП, включая формирование списка референтных ЛП, формирование реестра типовых инструкций по применению взаимозаменяемых ЛП.
В РФ среди официальных информационных источников о ЛС первую позицию занимает онлайн-ресурс «Государственный реестр лекарственных средств» (ГРЛС) как независимый, точный, структурированный, объективный и проверенный источник информации. ГРЛС — это издание Минздрава России, включающее перечень отечественных и зарубежных ЛС (ЛП и фармацевтических субстанций), разрешенных к медицинскому применению в нашей стране. Каждому зарегистрированному в РФ ЛП соответствует страница в системе ГРЛС.
ГРЛС содержит перечень ЛП, прошедших государственную регистрацию, при этом на все ЛП представлены регистрационные удостоверения из 12 разделов, позволяющие получить следующую информацию:
Номер регистрационного удостоверения, дата
регистрации, дата переоформления, срок введения в гражданский оборот.
Наименование держателя или владельца регистрационного удостоверения с указанием страны.
Торговое наименование ЛП.
Международное непатентованное, или группировочное, или химическое наименование.
Форма выпуска с указанием лекарственной формы, дозировки, срока годности, условий хранения.
Сведения о стадиях производства, включая стадии производства, адрес производителя, производителя, страну.
Инструкция по применению ЛП через активную клавишу «Показать инструкцию».
Нормативные документы с указанием номера нормативного документа, года, номера изменения.
Анатомо-терапевтическая химическая классификация с указанием кода ЛП.
Фармацевтическая субстанция с указанием международного непатентованного, или группировочного, или химического наименования, производителя, адреса производителя.
Особые отметки включают: наличие ЛП в перечне жизненно необходимых и важнейших ЛС; наличие в ЛП наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ в соответствии с законодательством РФ, международными договорами РФ, в т. ч. Единой конвенцией о наркотических средствах 1961 г. и Конвенцией о психотропных веществах 1971 г.; референтность и взаимозаменяемость ЛП.
Большим преимуществом использования ресурса ГРЛС для получения информации о ЛП является то, что на нем представлены сведения о регистрации и перерегистрации, о производителях на всех стадиях производства, сведения о фармацевтической субстанции и сканированный вариант инструкции по применению ЛП от разработчика. Кроме того, ресурс содержит ценную информацию о наличии данного ЛП в перечне жизненно необходимых и важнейших ЛС, о референтном ЛП, взаимозаменяемости ЛП, о дате перерегистрации ЛП, которая на сегодняшний день в систематизированном виде более нигде не представлена.
Ввиду большой значимости обозначенных вопросов авторами было проведено изучение информированности медицинских работников Иркутской области по вопросам референтности и взаимозаменяемости ЛП, а также проведен анализ вариантов поисковой работы в системе ГРЛС.
Исследование по изучению информированности медицинских работников по вопросам референтности и взаимозаменяемости ЛП
Цель исследования: изучить уровень информированности врачей по вопросам поиска объективной и оперативной информации о ЛП.
Материалы и методы: для проведения исследования был выбран метод анкетирования, разработана анкета из 18 вопросов, включающая в себя несколько разделов. В исследовании приняли участие 110 врачей различных специальностей, работающих в Иркутской области.
Результаты исследования: сотрудники кафедры фармации ИГМАПО провели анонимное анкетирование врачей различных специальностей: терапевтов (26,7%), педиатров (25,0%), неврологов (27,0%), психиатров (9,3%), дерматовенерологов (1,3%), гинекологов (1,0%) и др.
Несмотря на то, что 95,2% респондентов регулярно используют в своей работе справочную информацию о ЛС, всего 14,5% врачей знакомы с онлайн-ресурсом ГРЛС.
На вопрос «Оцените свой уровень знаний по работе в системе ГРЛС» респонденты ответили следующим образом: высокий — 0%, достаточный — 1%, недостаточный — 20%, низкий — 66%, затрудняюсь ответить — 13%.
Исследование показало, что подавляющее большинство опрошенных имеют потребность в систематизации знаний по работе с системой ГРЛС.
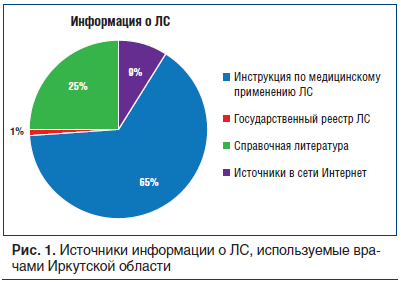
В своей работе специалисты используют следующие источники информации о ЛС (рис. 1):
инструкция по медицинскому применению ЛС — 65%;
справочная литература — 25%;
источники в сети Интернет — 9%;
Первые три источника информации нельзя абсолютно отнести к официальным источникам информации. Первый источник отличается тем, что производитель может исключить из инструкции часть информации по своему усмотрению, объективная информация содержится только в инструкции, предназначенной для специалистов. Второй и третий ресурсы относятся к общим источникам информации и не отвечают современным требованиям объективности и независимости, поэтому не могут использоваться специалистами для рационального применения ЛС.
Таким образом, изучение мнения врачей убедительно доказывает необходимость совершенствования знаний о ресурсе ГРЛС и навыков работы в нем.
Алгоритмы работы с ГРЛС
Авторы разработали несколько алгоритмов работы с ГРЛС.
В случае, если врачу нужно получить информацию о референтности того или иного ЛП, он может осуществить поиск по следующему алгоритму:
В разделе ГРЛС «Лекарственные препараты» в строку поиска ввести МНН ЛП. В виде таблицы отображаются все зарегистрированные ЛП, содержащие ЛС под данным МНН. Если известен производитель, а также торговое наименование данного ЛП, поиск можно сузить, введя известную информацию в соответствующие строки.
Выбрав в таблице строку с искомым ЛП, пользователь переходит на страницу регистрационного удостоверения. В разделе 12 «Особые отметки» отображается информация о референтности ЛП.
В качестве примера получим информацию о референтном ЛП для ЛС дутастерид, который является селективным ингибитором 5-альфа редуктазы. В строку поиска в разделе «Государственный реестр лекарственных средств» вводим МНН — «дутастерид», появляется таблица с результатом поиска, включающим три ЛП. Перейдя на страницу регистрационного удостоверения первого ЛП (Гардиум, производитель «Тева Фармацевтические Предприятия Лтд», Израиль), в разделе «Особые отметки» находим информацию о том, что данный ЛП не является референтным, по активной ссылке переходим на страницу регистрационного удостоверения референтного ЛП (рис. 2).

В случае, когда врачу необходимо подобрать соответствующий известному референтному взаимозаменяемый ЛП, он может осуществить поиск по предлагаемому алгоритму:
В разделе ГРЛС «Лекарственные препараты» в строку поиска ввести торговое наименование известного референтного ЛП. В виде таблицы отображаются все формы выпуска данного референтного ЛП. Выбрав нужную строку, пользователь переходит на страницу регистрационного удостоверения. В разделе 12 «Особые отметки» отображается информация о взаимозаменяемых ЛП в виде ссылок на регистрационные удостоверения соответствующих ЛП.
В качестве примера осуществим поиск взаимозаменяемых ЛП для препарата Аводарт ® (МНН дутастерид). В строку поиска в разделе «Государственный реестр лекарственных средств» вводим торговое наименование — «Аводарт». В таблице с результатом поиска выбираем ЛП в нужной нам лекарственной форме — «капсулы». Открыв регистрационное удостоверение данного ЛП, переходим в раздел 12, где отображается признак референтности и располагаются активные ссылки на соответствующие взаимозаменяемые ЛП с эквивалентной лекарственной формой и дозировкой (рис. 3).
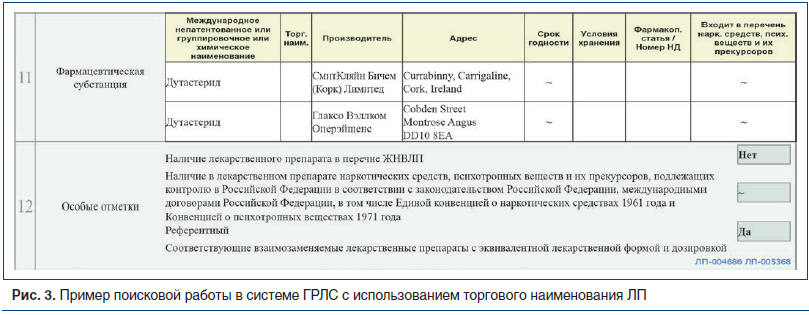
Перейдя по активным ссылкам, узнаем торговые наименования взаимозаменяемых ЛП — Гардиум, Дутастерид Бактер.
Сложнее осуществляется поиск референтного ЛП, если известно только МНН. Если ЛП не является взаимозаменяемым, информация о соответствующем референтном ЛП в разделе 12 не отображается. Поэтому пользователю необходимо поочередно открывать страницы с регистрационными удостоверениями до получения результата. В качестве примера осуществим поиск референтного ЛП для ЛС кандесартан, который применяется в терапии артериальной гипертензии. Вводим в строку поиска МНН «кандесартан», результат получаем в виде таблицы, включающей 15 зарегистрированных ЛП (в т. ч. комбинированных). Выбрав первый ЛП Кандесартан (производитель ЗАО «БФЗ»), переходим на страницу регистрационного удостоверения данного ЛП. В нижней части страницы отображается информация о взаимозаменяемости данного ЛП, а также активные ссылки на соответствующий референтный ЛП. Регистрационное удостоверение ЛСР-001353/08 соответствует ЛП Атаканд ® .
Заключение
Анализ полученных данных позволяет сделать вывод о том, что врачи на сегодняшний день недостаточно информированы и не владеют навыками поиска необходимой объективной и независимой информации о ЛП. В то же время такая информация крайне важна для назначения правильного лечения, получения хороших результатов терапии. При этом необходимо учитывать такой фактор, как повышение приверженности пациентов лечению, который складывается из результативности терапии и оптимального соотношения цены и качества ЛП. Используя в повседневной практике данные ГРЛС, пользователь может получить достоверную, полную и оперативную информацию о ЛП, их референтности и взаимозаменяемости. Повышение уровня знаний о ресурсе ГРЛС и навыков работы в нем позволит улучшить качество подбора, проведения и коррекции лекарственной терапии и, как следствие, будет способствовать развитию в РФ системы рационального использования ЛС.
Только для зарегистрированных пользователей
Источник