- Этапы разработки лекарственных препаратов
- Этапы разработки лекарственных средств [ править | править код ]
- Как с помощью ИТ появляются новые лекарства: мишени, ключи и миллиарды долларов
- Прицельное попадание в мишень
- ИТ и математика в фармацевтике
- Доклинические исследования
- Клинические испытания
- А сколько всё это стоит?
Этапы разработки лекарственных препаратов
Этапы разработки лекарственных средств [ править | править код ]
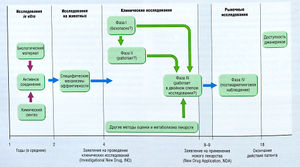
Между моментами создания нового лекарства и демонстрации его клинической эффективности и адекватной безопасности можно выделить несколько этапов (рис. 3.1). Этап первоначальной разработки обычно состоит в определении терапевтической дели (заболевание или состояние) или целевой молекулы, например рецептора, фермента и др., и последующем обнаружении основного химического соединения, т.е. вещества с характерным эффектом, необходимым для нового лекарства. В современных программах разработки лекарств чаще определяется целевая молекула, которая является ключевым звеном патологического процесса, и осуществляется поиск синтетических и природных соединений, действующих на эту молекулу. В дальнейшем пытаются разработать более подходящие соединения. Получение таких соединений — многократный процесс, включающий синтез похожих химических производных основного соединения. При разработке новых аналогов, чтобы получить требуемую эффективность, используют анализ взаимосвязи структура-активность (SAR или QSAR при количественной оценке).
Описание к рис. 3.1 Процесс разработки и оценки лекарства для вывода на рынок США. Некоторые требования для препаратов, используемых для лечения жизнеугрожающих заболеваний, могут отличаться [Katzung ВС. Basic and Clinical Pharmacology, 6th ed. New York: I Appleton & Lange]
Некоторые аналоги препаратов становятся объектами крупномасштабных фармакологических и токсикологических исследований для определения характеристик лекарств, которые могут получить одобрение для клинических исследований с участием пациентов. После серии клинических наблюдений полученные данные подаются в регулирующий орган для получения разрешения на реализацию нового лекарства. После этого с помощью различных методов собирают результаты клинического применения препарата. Этот процесс называют постмаркетинговыми наблюдениями (см. Принятие фармакотерапевтического решения), которые регулируют менее строго, чем процедуры, необходимые до получения регистрации.
Эксперименты на животных обеспечивают основу клинических наблюдений
Сведения о фармакологических эффектах лекарства in vitro и in vivo используют для предварительного заключения о его терапевтической ценности. Эти данные нужны для обоснования исследований на людях, поскольку без них не будет базы для оценки ожидаемой пользы и приемлемого риска нежелательных эффектов. Доклиническими исследованиями называют эксперименты in vitro и на животных, используемые для определения действия лекарства на уровне молекулы, клетки, определенной ткани или органа, оценки фармакологических свойств и изучения потенциальных терапевтических эффектов на животных моделях заболеваний человека. Исследования на животных также помогают изучить метаболизм и распределение лекарства в организме и разработать основные показания. Клинические исследования не могут быть продолжены, если не доказана безопасность лекарства. Для оценки возможной токсичности нового лекарства необходимы следующие исследования на животных:
- токсикологические исследования in vitro для оценки генетической и биохимической токсичности;
- оценка острой токсичности с изучением физиологических систем (сердечно-сосудистая, центральная нервная, желудочно-кишечный тракт), кожи и слизистых (острое раздражение и возбуждение);
- оценка подострой и хронической токсичности;
- оценка канцерогенности;
- оценка репродуктивной токсичности;
- оценка генетической токсичности.
При изучении острой токсичности оценивают эффекты, возникающие через несколько часов или дней после однократного введения. При изучении хронической токсичности рассматривают эффекты после введения повторных доз в течение нескольких недель или месяцев.
Однако надежность данных, полученных на животных, для прогнозирования клинических результатов зависит от уровня клинической релевантности модели. Например, модель пневмонии, вызванной золотистым стафилококком, хорошо прогнозируема. Инфицирование организма одинаково и у людей, и у животных. Иммунологический ответ против бактерий и легочная патология у животных и человека очень схожи. Напротив, животные модели других заболеваний только косвенно имитируют заболевания человека и менее предсказуемы. Обычно возможность разработки животной модели связана с пониманием патофизиологии конкретного заболевания. В указанном примере непосредственная причина пневмонии хорошо известна, в то время как точная этиология многих заболеваний не определена.
Изучение лекарства в клинике состоит из нескольких этапов
Клинические исследования начинаются после того, как собрано достаточное количество данных после исследований на животных в качестве обоснования для оценки нового лекарства в клинике и получения необходимого официального разрешения. Этапы разработки лекарства обозначают как фаза I, фаза II и фаза III. Фаза IV является этапом пост-маркетинговых наблюдений и других пострегистрационных клинических исследований (см. рис. 3.1).
Фаза I включает первые клинические исследования с участием людей. Эти исследования проводят под очень строгим наблюдением, обычно они являются открытыми или одинарными слепыми (табл.3.2) и определяют наименьшую допустимую дозу по токсичности. Дальнейшие исследования проводят с меньшими дозами. Обычно в таких исследованиях участвуют молодые здоровые мужчины. В дальнейшем их заменяют группой больных. Также в эту фазу получают первичные данные о фармакокинетике.
Фаза II начинается после определения диапазона допустимых доз и рассматривается как доказательство концепции. Этот этап проходит с участием больных, у которых новое лекарство должно проявить свой потенциальный эффект. Основная цель состоит в получении доказательств того, что новое лекарство эффективно, т.е. обладает эффектами, полученными в доклинических исследованиях. Иногда конечной точкой клинических наблюдений фазы II является собственно терапия, в других случаях используют заместительные конечные точки исследований. Заместительная конечная точка прогнозирует или предположительно прогнозирует истинную конечную точку. Например, изучение лекарства при сердечной недостаточности может иметь истинную конечную точку при увеличении толерантности к нагрузке или выживаемости. Заместительная конечная точка для того же лекарства может быть уменьшением периферического сопротивления сосудов и улучшением сердечного выброса. Для лекарства, которое может предотвращать тромбообразование при ангиопластике, заместительной конечной точкой может быть ингибирование агрегации тромбоцитов, а истинной конечной точкой — уменьшение рестеноза.
Заместительная конечная точка наиболее удобна, когда она тесно связана с истинной конечной точкой. Так, например, заместительной конечной точкой является снижение артериального давления. Целью лечения гипертензии является снижение неблагоприятных сердечно-сосудистых реакций организма и почечной недостаточности как последствий гипертензии. Таким образом, снижение артериального давления — это заместительная конечная точка для уменьшения последствий гипертензии.
Другие цели фазы II состоят в определении фармакокинетики лекарства и связи между эффектом и концентрацией вещества в плазме, если это возможно. Также изучается влияние заболеваний печени и почек на выведение лекарства из организма, фармакокинетические и фармакодинамические взаимодействия нового лекарства с другими средствами, с которыми их могут назначать совместно.
Исследования в фазу II могут быть одинарными или двойными слепыми, параллельными или перекрестными, с использованием случайных выборок пациентов. В этнически разнородных популяциях, например в США, в фармакокинетических исследованиях иногда изучают особенности метаболизма лекарств у разных этнических групп. Этническая однородность является грубым усреднением генетической классификации. Возможно, в будущем более корректный подход к оценке путей метаболизма и клинических результатов будет состоять в классификации пациентов по их генетической предрасположенности к метаболизму лекарств. Тогда будет возможно предсказать, для какого генотипа лекарство будет более полезно, а для какого — токсично. Этот раздел фармакологии называют фармакогенетикой.
В фазу III устанавливают эффективность и безопасность нового лекарства. Если возможно, проводят контролируемые рандомизированные двойные слепые исследования, которые всегда параллельны. Планируемая модель и размер всех клинических наблюдений, особенно фазы III, основывают на статистических действиях, например рандомизации процедур, чтобы после окончания исследования получить веское заключение. Кроме того, популяционные исследования фазы III должны усреднять целевую популяцию для данного лекарства. В исследовании должны участвовать пациенты с различными проявлениями изучаемого заболевания. Распределение по этническим группам и полу должно отражать таковое в популяции. Наибольшее внимание уделяют изучению детей, за исключением случаев, когда это нецелесообразно, например при изучении лекарств для лечения таких заболеваний у пожилых, как болезнь Альцгеймера.
Разработка лекарств является длительным процессом
- Время от подачи заявки на регистрацию до его получения составляет от 6 мес до нескольких лет, чаще 1-2 года
- Процесс разработки лекарства до регистрации обычно занимает 6-10 лет
Таблица 3.2 Клинические исследования, терминология
Стандартная терапия (или плацебо при отсутствии стандартов), с которой сравнивают эффективность нового препарата
Пациенты, участвующие в исследовании, имеют одинаковую возможность быть включенными в опытную или контрольную группу, а факторы, которые могут повлиять на результаты, одинаково распределены между двумя группами
Двойное слепое исследование
Ни врач, ни пациент не знают, получает ли данный пациент опытное или контрольное средство, что помогает избежать субъективизма
Одинарное слепое исследование
Врач знает, какой препарат назначен данному пациенту, но пациент не знает
Противоположно двойному слепому: и врач, и пациент знают, какое средство (опытное или контрольное)назначено и в какой дозе
Одновременно оценивают как минимум две схемы, но пациенту назначают только один вид терапии
Пациенты получают каждый вид лечения последовательно и таким образом выступают в качестве контрольной группы для самих себя. Например, если лечение А оценивают относительно лечения В, то некоторые пациенты получают сначала А, потом В, а другие наоборот — сначала В, потом А. Так оценивают эффекты лекарственной терапии, а не порядка назначений
Измеряют для оценки эффекта лекарства (например, нормализация артериального давления — конечная точка для оценки антигипертензивных средств, уменьшение боли — конечная точка для оценки анальгетиков)
Заместительная конечная точка
Результат лечения, который прогнозирует истинную цель терапии, не являясь этой целью (например, снижение размера опухоли в качестве заместителя выживаемости)
Источник
Как с помощью ИТ появляются новые лекарства: мишени, ключи и миллиарды долларов
Фармацевтическая индустрия бьет рекорды — с каждым годом выпускается всё больше новых лекарственных препаратов. В 2018 году появилось 68 новых активных фармацевтических субстанций (АФС) — веществ или их смесей, предназначенных для использования в производстве лекарственного препарата. За 9 месяцев 2019 года импорт фармсубстанций в РФ превысил объем поставок за весь 2018 год. Глава евразийского подразделения фармацевтической компании «Босналек» Валентина Бучнева рассказала об этапах разработки лекарств и о том, как появляются новые АФС.
Читайте «Хайтек» в
Разработка новых лекарственных препаратов — долгий и сложный процесс. От исследований в лаборатории до попадания в аптеки и больницы проходит несколько лет — в среднем от 10 до 14. Срок в пять лет — удача для производителя, случается такое крайне редко. Плюс ко всему, из нескольких тысяч веществ, которые исследуются фармацевтами на первых этапах, до аптеки доходит всего одно.
Над созданием препаратов работает команда из нескольких сотен человек. Это биологи, генетики, химики и медики. Первый этап работы — лабораторные исследования.
Прицельное попадание в мишень
Перед тем, как начать разрабатывать лекарство от какого-либо недуга, нужно точно знать причину болезни и ключевую точку, при воздействии на которую болезнь можно остановить и повернуть процесс вспять. Эта точка называется мишенью. Чаще всего это белок или какой-то фермент в организме человека или в болезнетворном организме.
Когда мишень выбрана, начинается формирование целевой терапевтической молекулы — прообраза. Он должен соответствовать поставленным целям и успешно попадать в мишень.
Обычно подходит лишь одно действующее вещество. Для того, чтобы его найти, необходимо перебрать тысячи или даже десятки тысяч вариантов. Сейчас этот процесс выполняется при помощи компьютерных технологий, раньше фармацевты действовали фактически вслепую, методом проб и ошибок, на что уходило гораздо больше времени.
ИТ и математика в фармацевтике
Цифровые технологии позволяют значительно ускорить процесс разработки лекарственных препаратов. Особенно эффективно использование ИТ на начальных стадиях работы по созданию препарата. Для некоторых видов фармацевтических препаратов их лечебные свойства можно предсказать еще на стадии моделирования. Дело в том, что ученым известны параметры модели — физиологические процессы заболевания и мишень. Моделирование дает возможность собрать «ключ» — молекулу, которая идеально подходит для мишени.
Выгода от использования компьютерных технологий еще и в том, что они помогают специалистам обрабатывать огромные массивы данных. Фармацевтические компании обладают гигантскими базами, в которых содержится подробная информация о разработке и свойствах разных препаратов. Мозг человека просто не в состоянии охватить всё это, поэтому на помощь пришли математика, компьютерный анализ, big data и машинное обучение.
В частности, математическая модель ускорила выход на рынок препарата против рассеянного склероза. Его разработчики определили точную концентрацию активного вещества для оказания максимального положительного эффекта на больного. Регулятор из США, FDA, согласился с выкладками ученых и одобрил регистрацию препарата без дополнительных исследований. Пока что это исключение из общего правила, но его можно назвать прецедентным.
Доклинические исследования
Следующий этап — поиск наиболее эффективного действующего вещества. Оптимальный вариант выбирается в ходе тестирования нескольких активных веществ на животных. Фаза называется доклиническими исследованиями. Специалисты оценивают силу биологического действия вещества, наблюдают за возможными побочными эффектами. Это нужно для того, чтобы определить показания к применению препаратов и идентифицировать противопоказания.
Кроме того, доклинический этап исследования позволяет исследователям определить дозозависимость эффектов лекарства плюс максимально возможную безопасную дозу и целесообразность ее повышения. Если доза будет очень большой, лекарство станет токсичным, слишком маленькой — оно может не оказать необходимого лечебного эффекта. Задача — определить терапевтическое окно, то есть такой диапазон доз, когда лекарство дает максимальный эффект, но еще не является токсичным.
На этом этапе тоже используются компьютерные технологии, что снижает количество подопытных животных. К сожалению, полностью отказаться от таких испытаний фармацевты пока не могут. Исследование новых препаратов включает в себя определение общей и специфической токсичности, фармакодинамики (то, как ведет себя препарат в организме) и фармакокинетики (то, как влияет препарат на организм в целом). Математические методы позволяют построить модель как фармакокинетики, так и фармакодинамики. Модель обычно представляет сложную систему, которая учитывает множество факторов.
В ходе доклинических испытаний может отсеяться около 90% потенциально эффективных препаратов.
Клинические испытания
После того, как разработчики препарата провели доклинические испытания, выяснив все важные моменты, наступает стадия клинических испытаний. В ее ходе может отсеяться еще 90% действующих веществ.
Структура клинических испытаний зависит от вида препарата. Обычно выделяют четыре основных этапа клинических испытаний.
- Тестирование препарата на здоровых добровольцах. Как правило, их не должно быть меньше 10. Добровольцы нужны для того, чтобы точно выяснить побочные эффекты, определить переносимость и безопасность препарата. Специалисты на этом этапе проводят новое изучение фармакокинетики и фармакодинамики, но уже на организме человека, а не животных.
- Проверка лечебного воздействия препаратов на пациентах с конкретным заболеванием. Чаще всего добровольцев разделяют на основную группу, которая принимает лекарства, и контрольную группу, которой дают плацебо — лекарство без действующего вещества.
- Масштабная проверка препарата на больших группах добровольцев. Численность таких групп может составлять тысячу человек и больше. Испытуемые должны быть разного возраста, с сопутствующими заболеваниями .
Если всё хорошо, подается заявка на регистрацию препарата (это тысячи документов, отчеты исследователей, результаты доклинических и клинических испытаний). Если у регистрирующих органов возникают какие-то сомнения, заявку могут отправить на доработку или вообще запретить вывод препарата на рынок.
- Пострегистрационный этап, он проводится уже после того, как лекарство выпустили на рынок. Цель — определить эффективность препарата по отношению к аналогам (если они есть), выявить дополнительные побочные эффекты и факторы риска. Если будут найдены серьезные проблемы, лекарство может быть даже отозвано с рынка.
А сколько всё это стоит?
Очень много. По оценке аналитиков, средние затраты фармацевтических компаний на вывод нового лекарственного препарата на рынок составили $802 млн в 2000 году. Через несколько лет сумма увеличилась до $1,7 млрд, сейчас этот показатель еще выше и составляет около $2,5 млрд. А вот вероятность появления на рынке новой молекулы после клинических испытаний составляет всего 11,5%. То есть девять лекарственных препаратов из десяти никогда не попадут в аптеки, несмотря на то, что компании вложили в разработку огромные деньги.
Стоимость исследований постоянно увеличивается, а вот их результативность — падает . По этой причине фармацевтические компании адаптируют свои бизнес-модели к текущим условиям, учитывая такие факторы, как небольшая коммерческая отдача от стадии исследований, замедление роста выручки и конкуренция со стороны других компаний и дженериков (аналоги оригинальных лекарственных препаратов).
Проблема высокой стоимости этапа исследований решается при помощи концепции открытых инноваций — это вовлечение партнеров со стороны в процесс исследований и разработок. Фармацевтические компании активно сотрудничают с научным сообществом, стартапами и институтами развития. В итоге компании помогают исследователям в их разработках, а ученые — приносят пользу фармацевтике за счет новых идей, методов работы, оригинальных решений.
Что касается западных стран, то концепция открытых инноваций там активно работает. В России же она находится на этапе становления. Отечественные фармкомпании начинают активно работать с учеными, научно-исследовательскими организациями и государством. Если всё получится, то российским ученым удастся создать эффективную цепочку производства лекарственных препаратов, ускорив появление новых лекарств и снизив стоимость всего цикла разработки.
Источник